L’association valsartan-inhibiteur de la néprilysine est supérieure à l’enalapril dans le traitement de l’insuffisance cardiaque chronique avec dysfonction systolique
PARADIGM-HF : Prospective Comparison of ARNI [Angiotensin Receptor–Neprilysin Inhibitor] with ACEI [Angiotensin-Converting-Enzyme Inhibitor] to Determine Impact on Global Mortality and Morbidity in Heart Failure Trial
Contexte et hypothèse :
Depuis près de 25 ans, les IEC constituent la composante centrale du traitement de l’insuffisance cardiaque avec dysfonction
systolique, en association aux bêta-bloquants et aux anti-aldostérone. La néprilysine est une endopeptidase neutre, qui dégrade plusieurs peptides endogènes (peptides natriurétiques, bradykinine, adrénomédulline) ; son inhibition permet de rétablir les niveaux de ces peptides et permet ainsi de lutter contre la rétention hydosodée et la vasoconstriction. L’inhibition combinée de la néprilysine et du système rénine angiotensine est susceptible de donner des résultats cliniques favorables synergiques. Dans les premiers essais cliniques, l’inhibition simultanée de la néprilysine et de l’enzyme de conversion a cependant entraîné un risque angio-œdème inacceptable. Le LCZ696, testé dans PARADIGM-HF, associe un inhibiteur de la néprilysine et du valsartan, inhibiteur des récepteurs de l’angiotensine.
L’étude PARADIGM-HF est une étude à long terme comparant directement le LCZ696 et l’enalapril chez des patients insuffisants cardiaques chroniques avec dysfonction ventriculaire gauche.
Critères d’inclusion
Patients adultes de 18 ans ou plus, ayant une insuffisance cardiaque NYHA classe II à IV, avec une fraction d’éjection (FEVG) ≤ 40% (critère abaissé à ≤ 35% par un amendement en cours d’étude).
Les critères suivants devaient être présents :
• BNP ≥ 150 pg/ml ou NT-proBNP ≥600 pg/ml (seuils ramenés à 100 pg/ml et 400 pg/ml, en cas d’hospitalisation pour insuffisance cardiaque dans l’année précédente)
• Sous IEC ou ARA2 avec une dose stable d’IEC (ou ARA2) et de bêta-bloquants pendant au moins 4 semaines avant l’inclusion.
Peu de critères d’exclusion :
• Hypotension artérielle systolique à moins de 100 mm Hg au screening (ou 95 mm Hg lors de la visite de randomisation)
• Débit de filtration glomérulaire < 30 ml/min/1,73 m²
• Kaliémie > 5,2 mmol/l (screening) ou 5,4 mmol/l (randomisation)
• Effets secondaires graves des IEC ou ARA2, en particulier angio-œdème.
Plan d’étude
Première période de 2 semaines avec remplacement de l’IEC ou ARA2 pris au long cours par enalapril (2 fois 10 mg), puis LCZ696 en simple aveugle pendant 4-6 semaines à une dose de 100 mg augmentée à 200 mg deux fois/j.
En l’absence d’intolérance lors des deux phase initiales : randomisation en double aveugle, entre LCZ696 200 mg deux fois/j et enalapril 10 mg deux fois/j.
Critères de jugement
Critère principal : mortalité cardiovasculaire ou hospitalisation pour insuffisance cardiaque
Critères secondaires :
• mortalité toute cause
• modification des symptômes (selon le Kansas City Cardiomyopathy Questionnaire)
• apparition d’une fibrillation atriale
• dégradation de la fonction rénale
Taille de l’échantillon
Estimation : 8000 patients suivis pendant 34 mois, avec 1229 décès cardiovasculaires et 2410 décès cardiovasculaires ou hospitalisations pour insuffisance cardiaque, pour détecter une baisse de 15% des décès cardiovasculaires, avec une puissance de 80% et une baisse de 15% du critère principal, avec une puissance de 97%.
Lors de sa 3ème analyse, au printemps 2014, et alors que le recrutement de l’ensemble de la population était terminé, le Data Safety Monitoring Board a recommandé l’arrêt de l’étude pour efficacité majeure.
Population
Recrutement dans 47 pays et 1043 centres entre décembre 2009 et novembre 2012.
10521 patients participant à la phase de run-in ; 8399 patients randomisés et inclus dans l’étude : 4187 sous LCZ696 et 4212 sous enalapril.
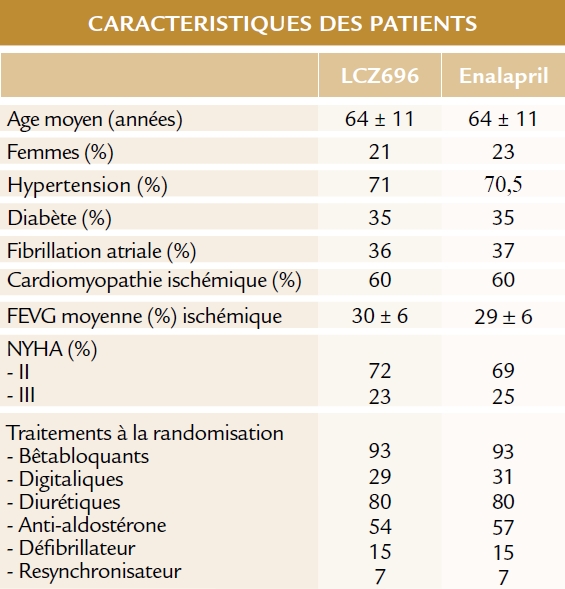
Résultats
• Durée médiane de suivi :
27 mois ; 20 patients perdus de vue (11 LCZ696 et 9 enalapril)
• Critère de jugement principal : mortalité cardio-vasculaire et hospitalisation pour insuffisance cardiaque :
Résultat significatif : 21,8 % vs 26,5 % ; HR 0,80 (0,73-0,87), P<0,001
• Éléments du critère principal :
Mortalité cardiovasculaire : 13,3% vs 16,5% ; HR 0,80 (0,71-0,89), P<0,001
Hospitalisation pour insuffisance cardiaque : 12,8% vs 15,6% ; HR 0,79 (0,71-0,89), P<0,001
• Mortalité totale :
17,0% vs 19,8%, HR 0,84 (0,76-0,93), P<0.001
• Analyses de sous-groupes :
Résultats comparables dans tous les sous-groupes étudiés, à l’exception d’une interaction avec la classe NYHA : effet sur le critère principal moins marqué chez les patients en classe III ou IV (mais pas d’interaction entre traitement, classe NYHA et mortalité cardiovasculaire).
• Événements indésirables et tolérance :
– Taux d’abandon plus élevé sous enalapril que sous LCZ696 pendant la phase de run-in
– Arrêt du traitement 17,8% vs 19,8% (P=0,02)
– Dose moyenne en fin d’étude 375 mg/j vs 19 mg/j
– Hypotension plus fréquente sous LCZ696 14,0% vs 9,2%
– Toux plus fréquente sous elnalapril 11,3% vs 14,3%
– Angio-œdème 0,4% vs 0,2%
Conclusion
L’inhibition combinée de la néprilysine et des récepteurs à l’angiotensine par le LCZ696 réduit de façon significative et importante (20%) le risque de décès cardiovasculaire ou hospitalisation pour insuffisance cardiaque, par rapport à l’enalapril. La mortalité globale est réduite de 16%.
Nicolas Danchin
RÉACTION
PARADIGM-HF : une révolution ?
Cette année, l’étude PARADIGM-HF change la donne dans le traitement de l’IC chronique du patient déjà traité. Le médicament testé, un antagoniste des récepteurs à l’angiotensine (valsartan) couplé avec un inhibiteur de la néprilysine (ARNI), comparé non pas à un placebo mais à l’énalapril bien prescrit (posologie moyenne de 18,9 mg/j), démontre une supériorité statistique sur tous les paramètres de morbi-mortalité (15 à 20% de réduction selon le critère) et dans tous les sous-groupes pré-définis avec une tolérance clinique très satisfaisante.
Certes, il y a significativement plus d’hypotension symptomatique. On n’en est pas surpris car ce nouveau produit a finalement plus d’action vasodilatatrice que l’IEC : il bloque le système rénine-angiotensine par le valsartan mais aussi la dégradation des peptides natriurétiques et celle de la bradykinine par le blocage de la néprilysine (endopeptidase neutre), entraînant une accumulation des deux hormones de fort pouvoir vasodilatateur chacune. Mais cela n’entraîne pas de retrait de la drogue. Et le produit a une meilleure tolérance rénale que l’IEC, ce qui n’était pas gagné !
L’accumulation de bradykinine est responsable d’un taux d’angio-œdèmes un peu supérieur à celui lié à l’IEC mais non significative. Il convient cependant d’être attentif à ce risque puisque l’étude a éliminé, par une double phase de run-in, les patients intolérants à l’un ou l’autre produit, et donc ceux qui ont développé un angio-œdème. En cas de mise sur le marché, cela devra être surveillé car même si la tolérance globale a été bonne, 11% des patients se sont avérés initialement intolérants à l’IEC ou à l’ARNI.
Ces résultats risquent fort de conduire les Sociétés Savantes à revoir leurs recommandations. Il ne s’agit plus d’ajouter une nouvelle classe. Il s’agit d’un traitement qui se pose en candidat au remplacement de l’IEC, tout au début de la stratégie thérapeutique de l’insuffisance cardiaque chronique, chez le patient symptomatique, en substitution chez un patient déjà traité. Une révolution !
Yves Juillière,
Cardiologie, Institut Lorrain du Cœur et des Vaisseaux,
CHU Nancy-Brabois.
L’auteur déclare avoir des liens d’intérêts avec Abbott Vascular, Amgen, Astra-Zeneca, Bayer, Boston Scientific, Bristol-Myers-Squibb, MSD-Schering-Plough, Novartis, Sanofi-Aventis et Servier.
Article paru dans le CORDIAM N°1 (Octobre 2014)
Télécharger l’article
