
Le patient diabétique n’est pas à haut risque de contamination, mais il est à haut risque de complications de la COVID-19 D’après les données épidémiologiques actuellement disponibles, le diabète ne semble pas être un facteur de risque d’infection par le SARS-CoV-2. Il est cependant associé à une maladie plus sévère.
Dans les premières études chinoises, la prévalence du diabète chez les patients avec une infection sévère était le double de celle parmi les patients avec une infection moins sévère, et l’odds ratio de mortalité intra-hospitalière en cas de diabète était élevé à 2,85 (IC 95 % : 1,35-6,05). Plusieurs études ont suggéré que la prévalence du diabète de type 2 chez les patients atteints de COVID-19 légère se situe autour de 6,0 %, comparable à celle de la population générale, tandis qu’elle est quadruplée (22,2%-26,9%) chez ceux atteints plus sévèrement. De même, aux États-Unis, la prévalence du diabète était de 32 % chez les personnes COVID-19 positives hospitalisées avec soins intensifs, contre 6 % chez les personnes COVID-19 positives non hospitalisées, selon les données des Centers for Disease Control and Prevention. On retrouve la même tendance en Europe (Grande-Bretagne) dans la vaste cohorte prospective ISARIC WHO CCP-UK de patients hospitalisés en raison de la COVID-19 ; parmi les comorbidités les plus fréquentes, le diabète était présent chez 20,7% des patients.
Pour quelles raisons les patients diabétiques ont un risque majoré de maladie sévère ?
En général, les personnes atteintes de diabète sont plus à risque de développer des complications lorsqu’elles sont infectées par un virus.
Plusieurs raisons peuvent expliquer ce sur-risque du patient diabétique en cas de COVID-19.
Tout d’abord, les patients diabétiques présentent fréquemment d’autres comorbidités, en particulier cardio-vasculaires. Ensuite, ils présentent un risque accru de présenter des complications liées à une infection virale, comme cela est bien établi avec la grippe saisonnière ou le pneumocoque. La vaccination antigrippale a été associée à des réductions du tiers des taux d’admission à l’hôpital pour des événements cardio- ou neurovasculaires graves.
Aussi, le diabète de type 2 est associé à une inflammation chronique de bas grade en relation avec l’excès de tissu adipeux viscéral. Ce statut inflammatoire affecte la régulation homéostatique du glucose et la sensibilité périphérique à l’insuline. L’hyperglycémie et l’inflammation chroniques peuvent provoquer une réponse immunitaire anormale et inefficace. Cette voie complexe et multifactorielle comprend une mobilisation réduite des leucocytes polymorphonucléaires, une chimiotaxie et une activité phagocytaire, une sécrétion plus faible de cytokines telles que l’interleukine -(IL)-1 et l’IL-6 en réponse aux lipopolysaccharides, à l’inhibition du Tumor Necrosis Factor alpha (TNF- ), à l’activité des lymphocytes T et à la glycation des immunoglobulines.
Le risque de décompensation diabétique est majoré du fait de l’état d’insulinorésistance qui s’accentue en cas d’infection aiguë.
Le rôle du déséquilibre et de la variabilité glycémiques dans la sévérité de la COVID-19 est très probable. Plusieurs études ont montré que l’hyperglycémie à l’admission à l’hôpital pour COVID-19, même chez des patients sans diabète connu, est associée à un risque accru de devoir être admis en Unité de soins intensifs et à un plus mauvais pronostic. Parmi les mécanismes invoqués il faut mentionner que l’hyperglycémie aiguë active fortement l’inflammation qui à son tour peut favoriser un accident cardio-vasculaire. Du fait du stress lié à l’infection les patients sont exposés à de fortes excursions glycémiques, et cela en particulier si le contrôle glycémique était inapproprié avant l’infection. En outre l’hypoglycémie potentialise la réaction immune aux endotoxines en mobilisant les monocytes pro-inflammatoires et augmente la réactivité plaquettaire, pouvant ainsi accroitre le risque de mortalité CV. La variabilité glycémique peut également activer les processus inflammatoires et sa réduction devrait être un objectif thérapeutique supplémentaire. L’utilisation des corticoïdes, fort controversée, peut encore dégrader l’équilibre glycémique. Les traitements expérimentaux anti-COVID-19 tels que l’hydroxychloroquine, le lopinavir/ritonavir, et l’atazanavir peuvent altérer le contrôle glycémique, avec un risque accru d’hypoglycémie sous hydroxychloroquine. Ainsi le contrôle glycémique constitue un enjeu majeur pendant la pandémie de COVID-19. Le monitoring glycémique doit être renforcé. Dans les formes graves de la maladie il peut être difficile à obtenir comme c’est le cas au cours de toute maladie aigue grave.
Considérations sur la possibilité d’un risque lié spécifiquement à la thérapeutique anti-hyperglycémiante.
Jusqu’à présent, il n’a pas été mentionné d’effet délétère spécifique des médicaments anti-hyperglycémiants oraux ni de l’insuline chez un patient atteint de la COVID-19, que ce soit par une éventuelle augmentation du risque d’infection par le SARS-CoV-2 ou par un effet aggravant sur l’infection.
Bien entendu, il est nécessaire d’adapter le traitement anti-hyperglycémiant en cas de troubles de la sphère gastro-intestinale (perte d’appétit, vomissements) ou si survient une insuffisance rénale aiguë, complications qui peuvent se produire en cas de fièvre et d’infection, surtout si elle est sévère ou prolongée.
Plus spécifiquement dans le cadre du traitement d’une forme sévère de la COVID-19, l’utilisation concomitante d’atazanavir ou de lopinavir/ritonavir et de certains anti-hyperglycémiants oraux nécessitent une surveillance. En particulier, la prescription de répaglinide est contre-indiquée en cas de recours à l’atazanavir. (Tableau 1)
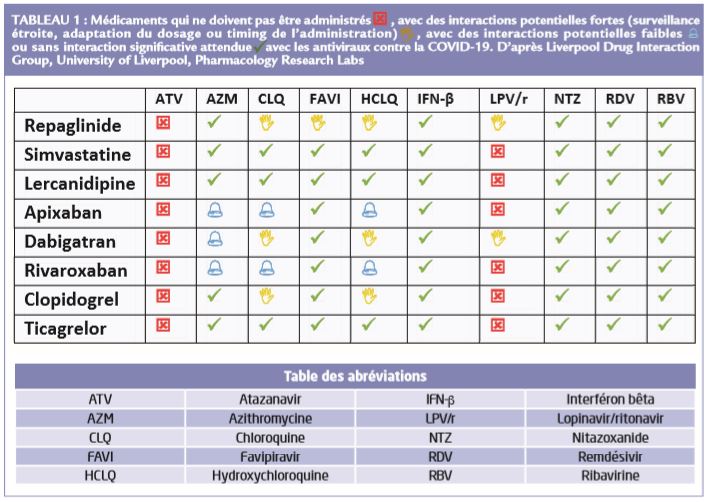
Le site www.covid19-druginteractions.org du Liverpool Drug Interaction Group, University of Liverpool, Pharmacology Research Labs, met à disposition une mise à jour des interactions des principales classes pharmacologiques avec les traitements pouvant être prescrits en cas de forme grave de la COVID-19 (antiviraux ou immunosuppresseurs). Certaines co-administrations sont contre-indiquées (Tableau 1) et d’autres nécessitent des précautions d’emploi.
Médicaments anti-hyperglycémiants susceptibles de modifier le cours évolutif de la COVID.
Les nouvelles classes de médicaments antihyperglycémiants ont un effet de prévention cardiovasculaire maintenant démontré qui permet de leur attribuer une très bonne place chez les patients diabétiques de type 2 à très haut risque cardio-vasculaire, en particulier lorsqu’il existe déjà des atteintes cliniques ou des sténoses artérielles significatives silencieuses. Tel est le cas des agonistes du récepteur du GLP-1 (GLP1-RAs) et des inhibiteurs du SGLT-2 (iSGLT2) qui pourraient jouer un rôle favorable dans la prévention cardio-vasculaire au cours de la COVID-19. Plusieurs classes de médicaments anti-hyperglycémiants augmentent l’expression de ACE2 (enzyme de conversion 2) qui est le récepteur fonctionnel du SARS-CoV-2, c’est à-dire la protéine qui fixe le virus avant son entrée dans la cellule. Elles pourraient ainsi théoriquement influer défavorablement sur la sévérité de l’infection par SARSCoV-2. Tel est le cas des GLP1-RAs, des iSGLT2, de la metformine et de la pioglitazone. À l’opposé, des effets anti-inflammatoires, potentiellement bénéfiques sur le cours de la maladie, ont été rapportés avec la pioglitazone, les GLP1-RAs, les iSGLT2 et l’insuline. La DPP4 est une glycoprotéine transmembranaire omniprésente dans de nombreux tissus, dont les cellules immunitaires. La DPP4 peut augmenter l’inflammation dans le diabète de type 2 via des mécanismes catalytiques ou non. Cette enzyme peut affecter la fonction de plusieurs cytokines, chimiokines et facteurs de croissance, en provoquant leur clivage. Fait notable, la DPP4 a aussi été identifiée comme un récepteur fonctionnel pour la protéine de pointe du MERS-Co-V.
L’inhibition de la DPP4 (iDPP4) pourrait ainsi réduire le risque d’infection par ce virus et atténuer l’inflammation. Certaines méta-analyses ont indiqué un risque accru de nasopharyngite et d’infection urinaire sous iDPP4 tandis que d’autres n’ont pas retrouvé ce phénomène, et en tous cas il ne semble pas exister un risque accru de pneumopathie. Ainsi, la DPP4 peut représenter une cible potentielle intéressante pour prévenir et réduire le risque et la progression des complications respiratoires aiguës telles que celles pouvant être favorisées par un diabète de type 2 chez un patient atteint de la COVID-19.
En pratique
Il est important de respecter rigoureusement les contre-indications des différents traitements, contre-indications qui peuvent évoluer lors de la progression de la maladie. L’hypoxie augmente le risque d’acidose lactique et limite l’utilisation de la metformine. De même, l’insuffisance rénale limite l’usage de la metformine ainsi que de la plupart des sulfamides hypoglycémiants et des iDPP4, des iSGLT2 et des inhibiteurs des alpha-glucosidases. Le risque d’acidocétose et d’évènements hypovolémiques (liés à leur effet diurétique) sous iSGLT2 est potentiellement accru au cours de la maladie. La survenue d’une insuffisance cardiaque limite l’utilisation des sulfamides hypoglycémiants car l’insuffisance cardiaque peut s’aggraver en cas d’hypoglycémie.
Au cours de la COVID-19 les iDPP4, les GLP1-RAs et l’insuline sous-cutanée constituent les meilleures options pour concourir au contrôle glycémique en limitant la variabilité glycémique. Toutefois dans les formes graves de la maladie, nécessitant une hospitalisation, le passage à l’insuline est en règle la meilleure option thérapeutique.
Médicaments à visée cardio-vasculaire souvent prescrits chez un patient diabétique.
Bloqueurs du SRAA
Selon une méta-analyse de huit études incluant 46248 patients avec COVID-19 confirmée en laboratoire, les patients les plus gravement atteints (admission en soins intensifs) étaient plus susceptibles d’avoir une hypertension (odds ratio 2,36 [IC 95% 1,463,83]), une maladie respiratoire (2,46 [1,76-3,44]) ou une maladie cardiovasculaire (3,42 [1,88-6,22]. Cette observation concernant la possible surmortalité associée à l’hypertension a été postulée comme étant liée à l’utilisation d’inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) ou de bloqueurs des récepteurs de l’angiotensine II (ARA II) plutôt qu’à l’hypertension elle-même. La question s’est donc posée de savoir si les IEC et les ARA II augmentaient la morbidité et la mortalité de la COVID-19.
D’après les études animales ces bloqueurs du SRAA favorisent la surexpression de l’ACE2. Cette surexpression pourrait théoriquement augmenter le risque d’infection par SARS-CoV-2. Une étude a montré, chez des patients hypertendus, qu’un traitement de 6 mois par le captopril s’accompagne d’une augmentation des concentrations d’angiotensine, un marqueur indirect de l’action de l’ACE2 dans les poumons.
D’un autre côté, certains arguments plaident en faveur du maintien d’un traitement avec un bloqueur du SRAA. En effet, la surexpression de l’ACE2 aurait probablement une action protectrice contre le risque d’inflammation exacerbée, causant les formes les plus sévères d’infection à COVID-19. L’arrêt brutal d’un IEC ou d’un ARA II chez les patients à haut risque, tels que ceux traités pour une insuffisance cardiaque ou un infarctus du myocarde, peut entraîner une instabilité clinique délétère.
Pour ces raisons, plusieurs sociétés savantes, dont l’American College of Cardiology, l’American Heart Association, la Heart Failure Society of America et l’European Society of Cardiology, ont recommandé la poursuite du traitement avec les bloqueurs du SRAA, d’autant que l’on manque de données concluantes sur le lien théorique entre la régulation positive de l’ACE2 tissulaire et la sensibilité accrue à la COVID-19 chez les patients atteints de maladies cardiovasculaires.
Les hypothèses en faveur du possible bénéfice de l’augmentation de l’ACE2 ont incité à la réalisation d’études pour tester l’hypothèse selon laquelle l’apport de la protéine ACE2 recombinante pourrait prévenir les lésions d’organes liée à la COVID-19. Dans le même esprit, des essais avec le losartan en tant que traitement de la COVID-19 sont menés auprès de patients qui n’avaient pas reçu auparavant de traitement par un bloqueur du SRAA, qu’ils soient hospitalisés (NCT04312009) ou non (NCT04311177).
Dans l’étude observationnelle CORONADO, multicentrique à l’échelle nationale en France, menée chez des personnes atteintes de diabète hospitalisées pour COVID-19, seul l’IMC est resté positivement associé au critère de jugement principal (OR 1,28 [1,10, 1,47]), dans les analyses multivariées. Ainsi, chez les diabétiques, l’HTA et les bloqueurs du SRAA ne modifient pas le pronostic.
Enfin, la question se pose également de l’innocuité de la prescription de l’un ou de plusieurs des traitements de la COVID-19 qui sont à l’étude dans des protocoles de recherche chez des patients suivant un traitement de fond avec un bloqueur du SRAA.
Spironolactone
La spironolactone augmenterait de 3 à 5 fois l’expression de l’ACE2 dans le plasma, contrairement aux IEC et ARA II. La spironolactone pourrait, en théorie, réduire l’expression de l’ACE2 à la surface des cellules endothéliales pulmonaires, car, contrairement aux IEC et ARAII, elle n’agit pas sur le SRAA pulmonaire. Bien que les taux de rénine soient améliorés lors de l’utilisation d’IEC, d’ARA II ou de diurétiques épargneurs de potassium, la différence entre les sites de blocage des effets de la rénine peut conduire à un microenvironnement métabolique contraire dans le SRAA au niveau pulmonaire.
Par conséquent, le remplacement des IEC ou ARA II par la spironolactone pourrait répondre aux préoccupations mentionnées ci-dessus.
Antagonistes calciques
La nifédipine et l’amlodipine ont été associées à une réduction de la mortalité et à une diminution du risque d’intubation et de ventilation mécanique chez les patients âgés hospitalisés pour COVID-19.
Les antagonistes calciques de la famille des dihydropyridines sont généralement utilisés dans l’hypertension artérielle. Ils ont également été utilisés dans le traitement de divers troubles pulmonaires avec vasoconstriction. Le SARS-CoV-2 a été impliqué dans le développement d’effets vasoconstricteurs, pro-inflammatoires et pro-oxydants.
Dans une étude rétrospective, les patients traités avec un antagoniste calcique étaient significativement plus susceptibles de survivre que ceux qui ne l’étaient pas (50% contre 14,6% p = 0,0036). De même, ils étaient beaucoup moins à risque de subir une intubation et une ventilation mécanique (4,2% contre 39,0% p = 0,0026). La nifédipine et l’amlodipine ont été associées à une amélioration significative de la mortalité et à une diminution du risque d’intubation et de ventilation mécanique chez les patients âgés hospitalisés avec COVID-19. Cependant, d’autres études cliniques sont justifiées.
Statines
La majorité des patients diabétiques sont sous traitement par statines. Par leurs effets anti-inflammatoires démontrés et leur effet bénéfique sur la fonction endothéliale les statines pourraient être protectrices vis-à-vis des complications cardio-vasculaires de la COVID-19. Cependant les statines peuvent exacerber les signaux de réponse immune et certaines données expérimentales suggèrent qu’elles augmentent l’expression de l’ACE2. Les études sur les effets bénéfiques ou délétères des statines sur le SDRA sont contradictoires . D’autres études sont indispensables pour clarifier les interrelations complexes avec ces mécanismes dans le cadre des infections par les nouveaux coronavirus.
À ce jour il n’y a pas d’argument justifiant l’arrêt des statines au cours de la COVID-19. Toutefois le risque de toxicité musculaire des statines doit être rigoureusement surveillé au cours de la maladie.
Antithrombotiques
Près de 20% des patients atteints de COVID-19 présentent de graves anomalies de coagulation, qui peuvent survenir dans presque tous les cas graves et critiques de COVID-19. Le lien entre la COVID-19 et une défaillance multiviscérale peut dépendre du fait que la plupart des patients COVID-19 développent une pneumopathie, qui est connue pour être associée à des changements précoces de coagulation et d’activation plaquettaire et de dysfonctionnement artériel. Ces changements peuvent impliquer des événements liés à la thrombose tels que l’infarctus du myocarde et les AVC ischémiques. La maladie thromboembolique veineuse concomitante, une cause potentielle de décès inexpliqués, a été fréquemment signalée dans les cas de COVID-19, mais sa prise en charge reste difficile en raison de l’hypercoagulabilité et du risque hémorragique accru. Ainsi, les méthodes physiques de prévention, utilisées seules, ne sont pas suffisantes pour contrôler l’hypercoagulabilité clinique. La survenue d’une CIVD est plus fréquente, avec une résistance à la thromboprophylaxie dans cette situation aiguë. La posologie classique de la thromboprophylaxie peut ne pas être suffisante pour cette condition. Par ailleurs, la plupart des patients COVID-19 sévères et gravement malades peuvent avoir des maladies sous-jacentes, des troubles de la coagulation, des antécédents de traitement hormonal ou d’autres circonstances telles qu’un dysfonctionnement hépatique sévère, entraînant une augmentation du risque de saignement, de sorte que les facteurs pouvant entraîner des saignements doivent être corrigés activement.
Le traitement antithrombotique, à la fois antiplaquettaire et anticoagulant, avant l’admission ne semble pas montrer d’effet protecteur dans les formes sévères de COVID-19 avec SDRA à la présentation et évoluant rapidement vers la mort.
Les patients sous traitement par un anticoagulant oral direct (AOD) et qui reçoivent des médicaments antiviraux montrent une augmentation alarmante des concentrations plasmatiques de l’AOD selon une étude italienne. Afin de prévenir les complications hémorragiques, les auteurs estiment que chez les patients atteints de la COVID-19 il devrait être envisagé de suspendre les AOD et de les remplacer par des antithrombotiques en parentéral aussi longtemps que les agents antiviraux sont jugés nécessaires.
Il existe un index thérapeutique étroit entre la prévention et le traitement de la thrombose veineuse et artérielle chez les patients atteints de la COVID-19 et le risque de saignement. Un document de synthèse publié par Watson et al dans Hospital Practice (2020) a été proposé pour aider les médecins à traiter les patients cardio-vasculaires à haut risque pendant cette pandémie (Tableau 2).

Antiarythmiques
Dans une enquête mondiale auprès de plus de 1 100 professionnels de l’électrophysiologie cardiaque concernant les patients hospitalisés COVID-19, diverses manifestations arythmiques ont été observées, allant de bénignes à potentiellement mortelles. Les événements indésirables observés liés à l’utilisation de l’hydroxychloroquine associée à l’azythromycine comprenaient le prolongement de l’intervalle QTc ainsi que les torsades de pointes nécessitant l’arrêt du médicament. Selon les auteurs, de grandes études prospectives pour mieux définir les manifestations arythmiques ainsi que la sécurité des stratégies de traitement chez les patients COVID-19 sont justifiées. La prescription concomitante d’amiodarone augmente le risque d’allongement important du QTc.
Sevrage tabagique
Les données en provenance de Chine ont montré que les hommes avaient une atteinte plus sévère de COVID-19 que les femmes. Étant donné que la prévalence du tabagisme est très élevée chez les hommes chinois par rapport aux femmes, il a été émis l’hypothèse que le tabagisme pourrait être un facteur de mauvais pronostic. Cela était également soutenu par la prévalence plus élevée de comorbidités, dont beaucoup sont liées au tabac, chez les patients atteints de COVID-19 sévère. Une méta-analyse a confirmé ces résultats, rapportant un risque accru (OR 2,25 [IC 95% 1,49-3,39]) de développer une COVID-19 sévère chez les patients ayant des antécédents de tabagisme.
De même, dans une revue systématique, il a été constaté que le tabagisme est un facteur de risque de progression vers une COVID-19 sévère. Le tabagisme semble provoquer une régulation à la hausse et dose-dépendante de l’ACE2, le récepteur d’entrée cellulaire du virus, ce qui pourrait expliquer le risque plus élevé de COVID-19 sévère chez les fumeurs.
Cependant, dans une autre méta-analyse, une prévalence étonnamment faible du tabagisme actif a été observée chez les patients atteints de COVID-19 en Chine, représentant environ le quart de la prévalence du tabagisme dans la population générale. Certains auteurs ont émis l’hypothèse d’un rôle protecteur de la nicotine. Elle pourrait maintenir ou restaurer la fonction du système anti-inflammatoire cholinergique et ainsi contrôler la libération et l’activité des cytokines pro-inflammatoires. Ces résultats, ainsi que les effets immunomodulateurs bien établis de la nicotine, suggèrent que la nicotine pharmaceutique devrait être considérée comme une option potentielle de traitement dans COVID-19, bien que les conseils généralisés pour arrêter de fumer comme mesure de réduction des risques pour la santé restent valables.
N°35 – Sept 2020
Pierre Attali – Pôle Cardiovasculaire médico-chirurgical, Nouvel Hôpital Civil, Hôpitaux Universitaires de Strasbourg.
Paul Valensi – Unité d’Endocrinologie Diabétologie Nutrition, Hôpital Jean Verdier ; Université Paris Nord, CINFO, CRNH-IdF. Bondy
Paul Valensi déclare avoir fait des conférences rémunérées à la demande des companies Abbott, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Merck Sharp & Dohme, Novartis, Novo Nordisk, Sanofi, Servier ; avoir obtenu des crédits de recherche de AstraZeneca et Novo Nordisk ; avoir participé à des comités d’experts pour Abbott, AstraZeneca, Boehringer Ingelheim, Daiichi Sankyo, Merck Sharp & Dohme, Novo Nordisk, Sanofi.
Pierre Attali déclare avoir fait des conférences à la demande d’Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Bristol Myers Squibb (BMS), Merck Sharp Dohme, Novartis, Pfi zer, Servier.
RÉFÉRENCES
1. Fadini, G.P., et al., Prevalence and impact of diabetes among people infected with SARS-CoV-2. J Endocrinol Invest, 2020. 43(6): p. 867-869.
2. Yan, Y., et al., Clinical characteristics and outcomes of patients with severe covid-19 with diabetes. BMJ Open Diabetes Res Care, 2020. 8(1).
3. Du, Y., et al., Clinical Features of 85 Fatal Cases of COVID-19 from Wuhan. A Retrospective Observational Study. Am J Respir Crit Care Med, 2020. 201(11): p. 1372-1379.
4. Team, C.C.-R., Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 – United States, February 12-March 28, 2020.
MMWR Morb Mortal Wkly Rep, 2020. 69(13): p. 382-386.
5. Docherty, A.B., et al., Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. Bmj, 2020. 369: p.m1985.
6. Vamos, E.P., et al., Effectiveness of the infl uenza vaccine in preventing admission to hospital and death in people with type 2 diabetes. Cmaj, 2016. 188(14): p. E342-e351.
7. Iacobellis, G., et al., Admission hyperglycemia and radiological fi ndings of SARS-CoV2 in patients with and without diabetes. Diabetes Res Clin Pract, 2020. 164: p. 108185.
8. Wu, C., et al., Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med, 2020.
9. Ceriello, A., S.W. Zarich, and R. Testa, Lowering glucose to prevent adverse cardiovascular outcomes in a critical care setting. J Am Coll Cardiol, 2009. 53(5 Suppl): p. S9-13.
10 .Wang, A., et al., Timely blood glucose management for the outbreak of 2019 novel coronavirus disease (COVID-19) is urgently needed. Diabetes Res Clin Pract, 2020. 162: p. 108118.
11. Zhou, J. and J. Tan, Diabetes patients with COVID-19 need better blood glucose management in Wuhan, China. Metabolism, 2020. 107: p. 154216.
12. Iqbal, A., et al., Effect of Hypoglycemia on Infl ammatory Responses and the Response to Low-Dose Endotoxemia in Humans. J Clin Endocrinol Metab, 2019. 104(4): p. 1187-1199.
13. Ceriello, A., et al., Evidence that hyperglycemia after recovery from hypoglycemia worsens endothelial function and increases oxidative stress and infl ammation in healthy control subjects and subjects with type 1 diabetes. Diabetes, 2012. 61(11): p. 2993-7.
14. Ceriello A, Standl E, Catrinoiu D, Itzhak B, Lalic NM, Rahelic D, Schnell O, Škrha J, Valensi P, on behalf of the “Diabetes and Cardiovascular Disease (D&CVD)” EASD Study Group
Issues of Cardiovascular Risk Management in People With Diabetes in the COVID-19 Era. Diabetes Care, 2020. 43(7): p. 1427-1432.
15. Sanders, J.M., et al., Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19): A Review. JAMA, 2020.
16. Cosentino, F., et al., 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J, 2020. 41(2): p. 255-323.
17. Yang, W., et al., DPP-4 inhibitors and risk of infections: a meta-analysis of randomized controlled trials. Diabetes Metab Res Rev, 2016. 32(4): p. 391-404.
18. Yang, J., et al., Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. Int J Infect Dis, 2020. 94: p. 91-95.
19. Cadegiani, F.A., Can spironolactone be used to prevent COVID-19-induced acute respiratory distress syndrome in patients with hypertension? Am J Physiol Endocrinol Metab, 2020. 318(5): p. E587-e588.
20. Luque, M., et al., Effects of captopril related to increased levels of prostacyclin and angiotensin-(1-7) in essential hypertension. J Hypertens, 1996. 14(6): p. 799-805.
21. South, A.M., D.I. Diz, and M.C. Chappell, COVID-19, ACE2, and the cardiovascular consequences. Am J Physiol Heart Circ Physiol, 2020. 318(5): p. H1084-H1090.
22. Vaduganathan, M., et al., Renin-Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med, 2020. 382(17): p. 1653-1659.
23. Bozkurt, B., R. Kovacs, and B. Harrington, Joint HFSA/ACC/AHA Statement Addresses Concerns Re: Using RAAS Antagonists in COVID-19. J Card Fail, 2020. 26(5): p. 370.
24 Kuster, G.M., et al., SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J, 2020. 41(19): p. 1801-1803.
25. Liu, Y., et al., Anti-hypertensive Angiotensin II receptor blockers associated to mitigation of disease severity in elderly COVID-19 patients. medRxiv, 2020: p. 2020.03.20.20039586.
26. Pechere-Bertschi, A., B. Ponte, and G. Wuerzner, [Renin-angiotensin-aldosterone blockers and Covic-19 infection : friends or enemies ?]. Rev Med Suisse, 2020. 16(693): p. 1003-1007.
27.Reynolds, H.R., et al., Renin-Angiotensin-Aldosterone System Inhibitors and Risk of Covid-19. N Engl J Med, 2020.
28.Cariou, B., et al., Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study. Diabetologia, 2020: p. 1-16.
29.Solaimanzadeh, I., Nifedipine and Amlodipine Are Associated With Improved Mortality and Decreased Risk for Intubation and Mechanical Ventilation in Elderly Patients Hospitalized for COVID-19. Cureus, 2020. 12(5): p. e8069.
30.Dashti-Khavidaki, S. and H. Khalili, Considerations for Statin Therapy in Patients with COVID-19. Pharmacotherapy, 2020. 40(5): p. 484-486.
31.Tikoo, K., et al., Tissue specifi c up regulation of ACE2 in rabbit model of atherosclerosis by atorvastatin: role of epigenetic histone modifi cations. Biochem Pharmacol, 2015. 93(3): p. 343-51.
32.Makris, D., et al., Effect of pravastatin on the frequency of ventilator-associated pneumonia and on intensive care unit mortality: open-label, randomized study. Crit Care Med, 2011. 39(11): p. 2440-6.
33.Rogers, A.J., et al., Association of Elevated Plasma Interleukin-18 Level With Increased Mortality in a Clinical Trial of Statin Treatment for Acute Respiratory Distress Syndrome. Crit Care Med, 2019.
47(8): p. 1089-1096.
34.Zhai, Z., et al., Prevention and Treatment of Venous Thromboembolism Associated with Coronavirus Disease 2019 Infection: A Consensus Statement before Guidelines. Thromb Haemost, 2020. 120(6): p. 937-948.
35.Violi, F., et al., Hypercoagulation and Antithrombotic Treatment in Coronavirus 2019: A New Challenge. Thromb Haemost, 2020. 120(6): p. 949-956.
36.Ciavarella, A., F. Peyvandi, and I. Martinelli, Where do we stand with antithrombotic prophylaxis in patients with COVID-19? Thromb Res, 2020. 191: p. 29.
37.Bikdeli, B., et al., COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up: JACC State-of-the-Art Review. J Am Coll Cardiol,
2020. 75(23): p. 2950-2973.
38. Russo, V., et al., Clinical impact of pre-admission antithrombotic therapy in hospitalized patients with COVID-19: A multicenter observational study. Pharmacol Res, 2020. 159: p. 104965.
39. Testa, S., et al., Direct oral anticoagulant plasma levels’ striking increase in severe COVID-19 respiratory syndrome patients treated with antiviral agents: The Cremona experience. J Thromb Haemost, 2020. 18(6): p. 1320-1323.
40. Watson, R.A., et al., Anti-coagulant and anti-platelet therapy in the COVID-19 patient: a best practices quality initiative across a large health system. Hosp Pract (1995), 2020: p. 1-11.
41. Gopinathannair, R., et al., COVID-19 and cardiac arrhythmias: a global perspective on arrhythmia characteristics and management strategies. J Interv Card Electrophysiol, 2020: p. 1-8.
42. Cattaruzza, M.S., et al., Tobacco smoking and COVID-19 pandemic: old and new issues. A summary of the evidence from the scientifi c literature. Acta Biomed, 2020. 91(2): p. 106-112.
43. Patanavanich, R. and S.A. Glantz, Smoking is Associated with COVID-19 Progression: A Meta-Analysis. Nicotine Tob Res, 2020.
44. Farsalinos, K., A. Barbouni, and R. Niaura, Systematic review of the prevalence of current smoking among hospitalized COVID-19 patients in China: could nicotine be a therapeutic option? Intern Emerg Med, 2020: p. 1-8.
45. Farsalinos, K., et al., Editorial: Nicotine and SARS-CoV-2: COVID-19 may be a disease of the nicotinic cholinergic system. Toxicol Rep, 2020. 7: p. 658-63.
46. Leung, J.M., C.X. Yang, and D.D. Sin, COVID-19 and nicotine as a mediator of ACE-2. Eur Respir J, 2020. 55(6).
