Indicateurs de Qualité : êtes-vous ISO 9001 ?
Il y a des sujets qui passionnent les cardiologues et d’autres qui ne les intéressent pas du tout. Les Indicateurs de Qualité (IQ) appartiennent à cette seconde catégorie et pour cause, ils ressemblent à des recommandations sans en être et leurs rares utilisations ne débouchent quasiment jamais sur du concret. On doit pourtant admettre qu’il y a un besoin constant de mise à jour et d’amélioration de la qualité des soins. Or l’amélioration passe par la mesure de la qualité et donc par les indicateurs. À une époque où tout le monde évalue toutes sortes d’actions, il serait bon que les médecins s’intéressent aux IQ et à leurs utilisations avant que d’autres ne s’en occupent pour eux.
C’est par exemple le cas du Service d’Hygiène Hospitalière qui m’a récemment informé d’un défaut de qualité des soins observé dans un des secteurs du Service de Cardiologie : l’ICSHA 2023 n’est qu’à 74% ! Sous cet acronyme se cache un Indicateur : celui de la Consommation de Solutions Hydro-Alcooliques qui est mesuré chaque année, dans chaque secteur d’hospitalisation de chaque service et dans chaque hôpital en France. En lisant plus attentivement le rapport, je comprends que cet indicateur est calculé comme le rapport du nombre de litres de solution hydro alcoolique utilisés divisé par le nombre de litres « attendus ». Un groupe d’experts qu’on ne remerciera jamais assez a estimé que pour chaque patient hospitalisé en service de Médecine, il y avait 10 contacts par jour avec le personnel. Et donc 10 opportunités de se frictionner les mains avec le gel désinfectant. Ce nombre varie selon le secteur, car il n’y a que 5 contacts/j en hôpital de jour et jusqu’à 28 en soins intensifs. En comptant 3ml de solution par désinfection, on attend une consommation de 30ml de gel par patient et par jour (Figure 1).
Si le mode de calcul de l’indicateur est détaillé, la relation entre les 30ml/patient et par jour et d’éventuelles conséquences cliniques ne sont pas décrites. On va admettre qu’il est probable que plus on utilise de gel désinfectant, plus on fait attention à l’ensemble des mesures d’hygiène et moins on expose le patient à une infection. Pour satisfaire l’ICSHA dans mon secteur, il aurait fallu consommer 43 litres de gel supplémentaires en 2023. Le calcul est vérifiable : avec environ 5 100 journées d’hospitalisation, si les 10 désinfections quotidiennes attendues avaient été réalisées avec chaque fois 3ml de gel, on aurait consommé les 166litres de solution requis, or il n’y en a été délivré que 123 litres. Mais tous ces détails ne révèlent pas la nature du problème : est-ce que ce faible résultat sur l’ICSHA est le reflet d’un défaut d’éducation du personnel médical ou paramédical qui ne se désinfecte pas les mains avant d’entrer dans une chambre, ou bien d’une mauvaise technique de désinfection avec 2,23 ml de gel par désinfection au lieu des 3ml règlementaires ou est-ce que l’indicateur ne correspond pas à la typologie des patients de ce secteur qui, plus valides, n’ont pas besoin de tous ces passages de personnel et qui n’auraient eu que de 7 à 8 contacts quotidiens au lieu de 10 ? L’incertitude rend les mesures correctives difficiles à déterminer et finalement j’avais décidé de ne faire aucun commentaire. Mais, le soir même, je me suis surpris à me désinfecter les mains ostensiblement et en utilisant plus de gel que nécessaire.
Intuitivement, le seul IQ valide devrait être l’évolution clinique des patients si on admet qu’une prise en charge de qualité aboutit à une meilleure santé et une moindre morbi-mortalité. Alors, plutôt qu’un rapport de quantité de gel consommé/attendu on aurait pu simplement mesurer le taux d’infections nosocomiales. Le clinicien comprendrait mieux mais dans le domaine de mesure de qualité, la mesure du « process » (la quantité de gel) s’avère plus adaptée que la mesure de l’« outcome » (taux d’infection). Si, par exemple, pour apprécier la qualité de la prise en charge de l’infarctus aigus on se base sur la mortalité à 1 mois ou à 1 an, l’estimation sera exacte au niveau d’une nation mais pas au niveau d’un centre ou d’un médecin. Comme le pourcentage de décès est faible, la mise en évidence d’une différence sur une période d’un ou deux ans est impossible et surtout, la mortalité post infarctus dépend plus de l’âge, des co-morbidités et de l’état hémodynamique à l’admission que de la qualité des soins1.
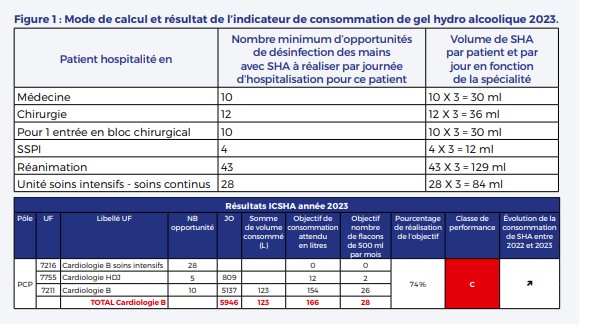
Tout critiquable que soit l’ICSHA, il s’agit d’un IQ valide pour la prévention des complications. Il en a les caractéristiques nécessaires car il couvre un domaine de soins précis, s’applique à une population définie (les patients hospitalisés), le résultat est attribuable à une catégorie professionnelle déterminée (le personnel qui a un contact avec le patient dans un secteur donné). De plus, l’ICSHA a les qualités métrologiques indispensables à un IQ ; la mesure de quantité de gel est aisée et fiable, la valeur de référence est déterminée ainsi que les objectifs pour décréter l’atteinte ou non de l’objectif. Et au total, dans mon expérience, cet IQ a provoqué une action correctrice après avoir eu connaissance de l’ICSHA, en droite ligne avec la philosophie d’Avedis Donabedian, pionnier dans ce domaine et auteur du fameux : « mesurer la qualité dans le but de l’améliorer2 ».
Les IQ en cardiologie :
Depuis quelques années, les recommandations de la Société Européenne de Cardiologie (ESC) sont systématiquement accompagnées d’une liste d’IQ3. Que ces indicateurs soient étroitement liés aux recommandations ne signifie pas qu’il s’agit d’une liste restreinte de recommandations prioritaires, car ils sont définis pour mesurer au mieux et de la façon la plus simple possible une qualité de soins dans l’ensemble des « domaines » de soins : organisationnel (l’équipement des centres et le travail en réseau), l’estimation du risque, la prise en charge interventionnelle et médicamenteuse, la prévention des complications ou la récidive et la perception des soins et de la maladie par le patient. Pour chacun de ces domaines, un indicateur (principal) est défini ainsi que des indicateurs secondaires pour permettre la mesure dans des situations particulières ou quand l’IQ principal n’est pas applicable.
Dans l’exemple de l’infarctus aigu, des IQ sont définis pour la prise en charge préhospitalière, la reperfusion, le traitement antithrombotique, le traitement de sortie et la perception des soins par le patient. Cette évaluation segmentée par domaines est ensuite compactée et résumée dans des IQ « composites », calculés à partir des indicateurs de chaque domaine. Les IQ composites expriment la mesure de qualité en une seule valeur, qualitative (bonne/mauvaise) ou quantitative (le pourcentage de la qualité maximale possible pour le patient)4,5,6.
Qui mesure la qualité des soins ?
La presse, les assurances, les agences ou les médecins ? La presse avait ouvert le feu en 1998 par un « Classement des Hôpitaux » (Figure 2) qui a fait grand bruit et donné l’exemple de la plus mauvaise utilisation possible des indicateurs. Le classement des hôpitaux et des services était principalement basé sur le volume d’activité ; clairement, l’intention du magazine n’était pas l’amélioration des pratiques mais plutôt les ventes du numéro. Le succès commercial de cette édition a été majeur et a mis en évidence l’intérêt du public pour les classements des hôpitaux, intérêt partagé par les agences et assurances mais pas par les professionnels. Aux États Unis, ce sont les compagnies d’assurances qui ont été pionnières dans les mesures de la qualité des soins. Là aussi le but n’était pas d’améliorer la prise en charge, mais de montrer aux cotisants que la compagnie remboursait des soins de qualité et même coûteux quand il y avait un bénéfice clinique : montrer, par exemple qu’elles remboursaient des stents actifs plutôt que des stents « nus » à une époque où la différence de prix était importante. En France, la Haute Autorité de Santé est responsable de la mesure régulière de qualité dans de nombreuses pathologies, incluant l’infarctus aigu. La méthodologie est parfaite, mais le résultat, s’il est communiqué aux centres, ne produit pas forcément de mesures d’amélioration. Enfin, les patients aussi donnent leur classement sur le net : sur « RateMDs.com » aux Etats Unis ou « Medecine4i » en France.
Et les médecins ? Ils sont les premiers concernés, mais surtout ils sont les mieux placés pour déterminer où se cache la qualité et inversement où se trouve le « maillon faible » dans une prise en charge complexe et multidisciplinaire. Mais ce domaine les intéresse peu. Sans contrainte, ni certification, ni valorisation ou incitation financière, la mesure de qualité stagne et même les sociétés savantes se contentent d’empiler des listes d’IQ pour différentes situations cliniques, sans dire ni même savoir qu’en faire7.
La mesure de qualité n’a donc pas d’avenir ?
Comme pratiquée jusqu’à présent, effectivement, on ne voit pas pourquoi les médecins devraient s’y intéresser. Il faut admettre que le mode d’emploi des indicateurs de qualité n’a jamais été communiqué et il n’y a pas beaucoup d’exemples de mesures d’indicateurs qui auraient entraîné des modifications de pratiques. Au niveau individuel, les programmes d’évaluation des Pratiques Professionnelles initiés en 2009 par la Haute Autorité de Santé n’ont pas été mis à jour et n’ont plus grand intérêt actuellement, tant les pratiques ont changé. ( https://www.has-sante.fr/jcms/c_778859/ criteres-depp-pour-les-maladies-cardio-vasculaires).

Au niveau d’un service hospitalier, le besoin d’un contrôle qualité régulier existe car on ne peut pas nier qu’il existe une hétérogénéité de la qualité en fonction des centres5,6,8. Si on regarde du côté de l’industrie, le contraste est net car les contrôles qualité y sont réalisés en routine, procédures indispensables pour délivrer des produits qui correspondent bien au cahier des charges, dans les délais et à moindre coût. Ces démarches et certifications de qualité sont affichées fièrement comme un gage de confiance auquel le client peut se fier ; la certification « ISO 9001 » en est un exemple. Alors pourquoi pas d’ISO 9001 en médecine ?
« Quality Control » (QC), la meilleure façon d’utiliser les Indicateurs de qualité.
Un QC est une procédure complexe qui s’apparente à un audit interne en 5 étapes. Il est souvent représenté par un cercle car il ne s’agit pas d’une action ponctuelle mais d’un procédé récurrent pour s’assurer d’une vérification périodique. Les étapes sont résumées par l’acronyme DMAIC : Définir, Mesurer, Analyser, Innover et Contrôler (Figure 3).
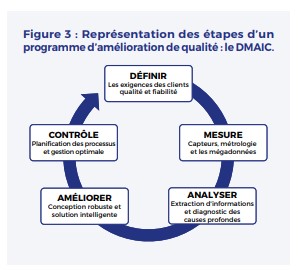
La première étape (définir) correspond au choix du thème souvent dicté par la connaissance ou suspicion d’un défaut de qualité et/ou de marge d’amélioration. Les deux étapes suivantes (mesurer et analyser) imposent la collecte de données qui ressemblent à une étude observationnelle, à la différence qu’il s’agit d’un questionnaire proposé aux cliniciens, complété de données patients.
L’étape de mesure des données permet de confirmer ou non le défaut de qualité et, si le défaut est confirmé, l’analyse cherche à identifier les mécanismes qui ont conduit aux lacunes et pour proposer des propositions adaptées. Celles-ci font l’objet de débat avec les professionnels afin de s’assurer qu’elles sont applicables, simples, sans surcout. Et la boucle DMAIC se ferme avec une seconde évaluation pour vérifier que les changement proposés sont applicables et ont réellement corrigé le problème.
EuroPath IV : un exemple de QC sur la prévention lipidique après un syndrome coronarien aigu (SCA).
L’intérêt de réaliser un QC est évident devant la constatation dans les études observationnelles que la moitié des patients en post SCA n’ont pas de statines à forte intensité et que l’objectif du LDL-c < 55mg/dL n’est observé que dans 20% des cas9,10.
Ces résultats correspondent à un défaut de prévention alors que les traitements sont disponibles. Et sur ces deux points, il existe des indicateurs de qualité: le taux de prescription de statines de forte intensité à la sortie après un SCA11 et le pourcentage de patients non à l’objectif du LDL-c12.
L’enquête Europath IV s’avérait tout à fait utilisable pour un QC car elle comporte à la fois un questionnaire pour les cardiologues et un recueil de données de leurs patients. Dans la phase d’analyse, c’est le taux des deux IQ qui a été mesuré13. Il est apparu que le taux du premier indicateur était plus élevé que prévu avec 80% des patients avaient soit une statine de forte intensité ou un équivalent (statine de moindre intensité mais associé à l’ézétimibe). On a donc conclu que, pour la cohorte des participants (500 cardiologues européens) il n’y avait pas lieu de programmer une campagne d’amélioration. En revanche, le second indicateur n’était atteint que dans moins de 20% des cas lors de la première visite et 31% au bout d’un an. La recherche des cause et de solutions s’est doncconcentrée sur ce second indicateur avec une étude des pratiques point par point depuis la prescription initiale jusqu’à 12 mois. Dans la phase d’Initiation, des modifications de stratégies ont été discutées avec une partie des professionnels participants pour aboutir à une liste de 10 changements de pratique susceptibles d’améliorer le taux de patient à l’objectif de LDL-c.
Pourquoi une telle complexité ?
Il est intéressant de constater que cette démarche de QC est très lourde car elle impose d’impliquer un grand nombre de cliniciens, d’élaborer un questionnaire et un recueil de données, de se baser sur des indicateurs de qualité ; il faut ensuite organiser plusieurs réunions, et elle produit finalement des conclusions comparables à celles d’un simple groupe d’experts dans un papier de consensus14. La force d’un QC réside dans la participation active des intéressés. Les conclusions ne viennent pas d’un groupe d’experts dont certains, possiblement, ne prescrivent plus depuis longtemps, mais de l’analyse de ce que connaissent et pensent les médecins et de ce qu’ils ont réellement fait pour leurs patients. Alors, même si les Indicateurs Qualité ne vous intéressent pas, vous pourriez adorer participer à un Contrôle Qualité qui en est l’utilisation reine et afficher fièrement votre certification !7
François Schiele, Besançon
1. Bradley EH, Herrin J, Elbel B, McNamara RL, Magid DJ, Nallamothu BK, et al. Hospital quality for acute myocardial infarction: correlation among process measures and relationship with short-term mortality. Jama. 2006;296(1):72-8.
2. Donabedian A. Evaluating the quality of medical care. The Milbank Memorial Fund quarterly. 1966;44(3):Suppl:166-206.
3. Aktaa S, Batra G, Wallentin L, Baigent C, Erlinge D, James S, et al. European Society of Cardiology methodology for the development of quality indicators for the quantification of cardiovascular care and outcomes. Eur Heart J Qual Care Clin Outcomes. 2022;8(1):4-13.
4. Couralet M, Leleu H, Capuano F, Marcotte L, Nitenberg G, Sicotte C, et al. Method for developing national quality indicators based on manual data extraction from medical records. BMJ Qual Saf. 2013;22(2):155-62.
5. Schiele F, Capuano F, Loirat P, Desplanques-Leperre A, Derumeaux G, Thebaut JF, et al. Hospital case volume and appropriate prescriptions at hospital discharge after acute myocardial infarction: a nationwide assessment. Circ Cardiovasc Qual Outcomes. 2013;6(1):50-7.
6. Schiele F, Gale CP, Simon T, Fox KAA, Bueno H, Lettino M, et al. The 2020 ESC-ACVC quality indicators for the management of acute myocardial infarction applied to the FAST-MI registries. Eur Heart J Acute Cardiovasc Care. 2021;10(2):207-15.
7. Schiele F. After the success of ‘quality indicators’ season 1, it is time for the sequel: ‘quality assurance’. Eur Heart J Acute Cardiovasc Care. 2022;11(11):806-7.
8. Zusman O, Bebb O, Hall M, Dondo TB, Timmis A, Schiele F, et al. International comparison of acute myocardial infarction care and outcomes using quality indicators. Heart. 2019;105(11):820-5.
9. Ray KK, Haq I, Bilitou A, Manu MC, Burden A, Aguiar C, et al. Treatment gaps in the implementation of LDL cholesterol control among high- and very high-risk patients in Europe between 2020 and 2021: the multinational observational SANTORINI study. Lancet Reg Health Eur. 2023;29:100624.
10. Ray KK, Molemans B, Schoonen WM, Giovas P, Bray S, Kiru G, et al. EU-Wide Cross-Sectional Observational Study of Lipid-Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. Eur J Prev Cardiol. 2021;28(11):1279-89.
11. Schiele F, Aktaa S, Rossello X, Ahrens I, Claeys MJ, Collet JP, et al. 2020 Update of the quality indicators for acute myocardial infarction: a position paper of the Association for Acute Cardiovascular Care: the study group for quality indicators from the ACVC and the NSTE-ACS guideline group. Eur Heart J Acute Cardiovasc Care. 2021;10(2):224-33.
12. Aktaa S, Gencer B, Arbelo E, Davos CH, Desormais I, Hollander M, et al. European Society of Cardiology Quality Indicators for Cardiovascular Disease Prevention: developed by the Working Group for Cardiovascular Disease Prevention Quality Indicators in collaboration with the European Association for Preventive Cardiology of the European Society of Cardiology. Eur J Prev Cardiol. 2022;29(7):1060-71.
13. Schiele F, Catapano AL, De Caterina R, Laufs U, Jukema JW, Zaman A, et al. Quality control to improve LDL-cholesterol management in patients with acute coronary syndromes based on the ACS EuroPath IV project. Eur Heart J Acute Cardiovasc Care. 2024;13(1):46-54.
14. Krychtiuk KA, Ahrens I, Drexel H, Halvorsen S, Hassager C, Huber K, et al. Acute LDL-C reduction post ACS: strike early and strike strong: from evidence to clinical practice. A clinical consensus statement of the Association for Acute CardioVascular Care (ACVC), in collaboration with the European Association of Preventive Cardiology (EAPC) and the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy. Eur Heart J Acute Cardiovasc Care. 2022;11(12):939-49.
