Disponibles depuis moins de 6 ans, les anticoagulants oraux directs (AODs), offrent une excellente alternative à l’utilisation des médicaments anti vitamine K (AVK) pour la prévention et le traitement des pathologies thromboemboliques. Contrairement aux AVK, les propriétés pharmacologiques des AOD permettent une administration à dose fixe et sans surveillance biologique dans la plupart des cas. Cependant, la variabilité de l’exposition aux AOD reste non négligeable. Une bonne connaissance des principales sources de variabilité est donc primordiale afin de pouvoir identifier certaines situations à risque, et ainsi de prévenir la survenue d’une surexposition voir d’un accident hémorragique.
Parmi ces sources de variabilité, on retrouve deux grandes catégories : les insuffisances d’organes et les interactions médicamenteuses. Cet article a pour but de décrire ces deux grands types de sources de variabilité ainsi que les conduites à tenir recommandées. Un bref rappel des caractéristiques pharmacologiques de base de chaque produit sera effectué.
Rappel sur la pharmacologie des AOD
Absorption/Elimination (généralités)
Concernant leur absorption, les AODs disponibles sur le marché sont tous rapidement absorbés avec un pic de concentration atteint entre 0.5 et 3 heures après la prise. Seul le dabigatran 1 est administré sous la forme d’un pro médicament, le dabigatran etexilate (DE). Ce dernier est rapidement hydrolysé en dabigatran dans le foie et le plasma. Les autres AODs (Rivaroxaban 2, Apixaban 3 et Edoxaban 4) sont tous administrés sous forme active. Leur biodisponibilité, c’est à dire la fraction et la vitesse à laquelle la dose ingérée atteint la circulation sanguine, est incomplète (DE: 7%, apixaban: 50%, edoxaban: 60%, rivaroxaban: 80%) principalement dû à des problèmes de solubilité à l’origine d’une part importante de la variabilité pharmacocinétique de ces médicaments. Leur biodisponibilité n’est pas influencée par la prise de nourriture sauf pour le rivaroxaban.
Concernant leur élimination, toutes les molécules possèdent une pharmacocinétique linéaire (concentration proportionnelle à la dose administrée) pour les doses thérapeutiques. Leur demi-vie est relativement courte de 10-12 h.
Le dabigatran est principalement (environ 80%) éliminé sous forme active par le rein. L’élimination rénale du rivaroxaban, de l’apixaban et de l’edoxaban est plus modérée (environ 40%). Pour l’edoxaban, une part importante (environ 45%) est éliminée par voie biliaire sous forme active.
Transport
Tous les AODs sont des substrats de protéine de transport membranaire et notamment de la glycoprotéine (P-gp). Elle joue un rôle de pompe d’efflux vis-à-vis de nombreux médicaments et limite leur passage à travers les principales barrières de l’organisme, comme au niveau de la paroi intestinale ou elle limite l’absorption et diminue la biodisponibilité des AODs. D’autres protéines de transport ont été identifiées comme la protéine BCRP (Breast Cancer Resistance Protein) pour le rivaroxaban ainsi que l’apixaban et qui se comporte de la même façon que la P-gp.
Métabolisme
Du point de vue de l’élimination, on peut définir deux types de profils d’AODs. Le premier groupe correspond aux molécules à faible métabolisme hépatique. Il est composé du dabigatran, qui est métabolisé à hauteur de 20% par l’UDP-glucosyltransferase (UGT), et de l’edoxaban dont moins de 5% est métabolisé par le cytochrome P450 3A4 (CYP3A4). L’apixaban et le rivaroxaban constituant le second groupe, sont quant à eux métabolisés respectivement à hauteur de 50% et 75% par le CYP3A4. Le rivaroxaban est aussi métabolisé par le CYP2J2.
Insuffisances d’organes
Insuffisance rénale
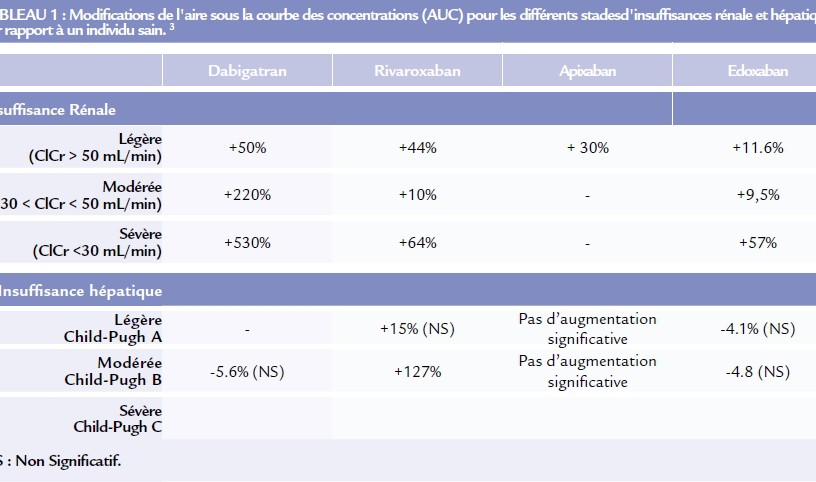
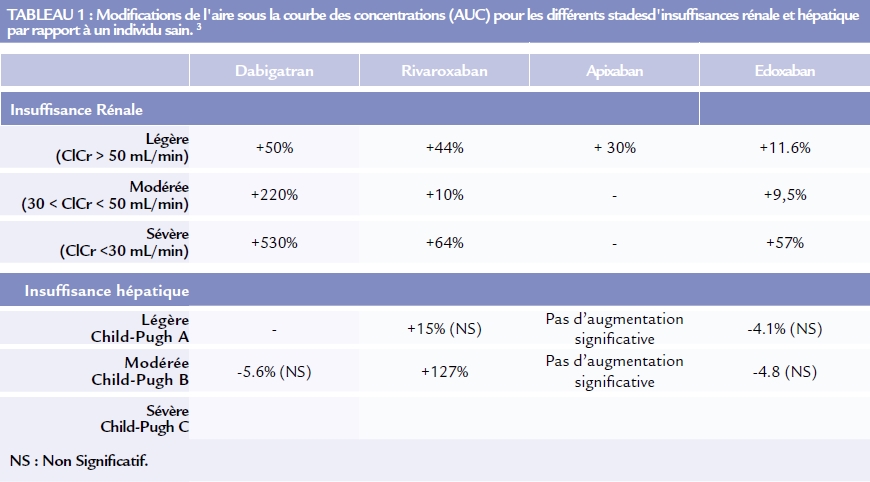
Le dabigatran étant principalement éliminé sous forme inchangée dans les urines, l’exposition des patients au dabigatran est augmentée de 50% chez le sujet insuffisant rénal léger, de 220% chez le sujet insuffisant rénal modéré, et de 530 % chez le sujet insuffisant rénal sévère par rapport au patient ayant une fonction rénale normale (tableau I). En pratique, le dabigatran est donc contre indiqué chez les patients avec une insuffisance rénale sévère. Pour les patients ayant une insuffisance rénale modéré une réduction de posologie de 300mg/j à 220mg/j pourra être proposée chez les patients à risque élevé de saignement.
L’élimination rénale sous forme active du rivaroxaban, de l’apixaban et de l’edoxaban étant plus faible (environ 40%), l’impact de l’insuffisance rénale est beaucoup moins marqué mais une accumulation reste possible (tableau I). En pratique, l’utilisation du rivaroxaban, de l’apixaban et de l’edoxaban est contre indiquée chez les patients avec une clairance de la créatinine inférieure à 15 mL/min. Pour le rivaroxaban, Une réduction de dose de 20 mg/j à 10 mg/j est recommandée chez les patients ayant une insuffisance rénale sévère à modérée (clairance de la créatinine entre 15 et 50 mL/min). De même pour l’edoxaban une réduction de dose de 60mg/j à 30 mg/j est recommandée. Aucun ajustement posologique n’est recommandé pour l’apixaban.
Insuffisance hépatique
*Concernant l’influence de l’insuffisance hépatique, seule l’exposition au rivaroxaban est augmentée de manière significative lors d’une insuffisance hépatique modérée (Child-Pugh B).
Concernant l’insuffisance hépatique sévère, en l’absence de donnée disponible, la prescription d’AODs n’est pas recommandée du fait du risque de coagulopathies.
Pour les insuffisances hépatiques légères à modérées et en l’absence de coagulopathie, le rivaroxaban, l’apixaban et l’edoxaban peuvent être administrés sans ajustement de dose mais avec précaution.
Interactions médicamenteuses
Les interactions médicamenteuses avec les AODs semblaient moins importantes que celles concernant les AVK (plus de 70 interactions répertoriées dans le guide ANSM des interactions médicamenteuses), cependant deux sources ont été identifiées comme pouvant entraîner des modifications significatives : celles impliquant la P-gp et/ou le CYP3A4. De nombreux médicaments sont susceptibles de moduler l’activité de ces protéines mais seul les puissants inducteurs ou inhibiteurs de la P-gp et/ou du CYP3A4 entraînent des modifications significatives de la pharmacocinétique des AODs. Le tableau II résume les informations publiées à ce jour pour chacun des AODs disponibles sur le marché.
On remarque que seules les molécules ayant une activité inhibitrice ou activatrice du CYP3A4 et/ou de la P-gp sont associées à des changements significatifs. Les molécules étant seulement des substrats de ces protéines, elles ne modifient pas significativement la pharmacocinétique des AODs. Il est a remarquer que la plupart des modulateurs de P-gp, le sont également pour le CYP3A4. Selon les cas, il est conseillé des précautions d’emploi, ou recommandé d’éviter l’association.
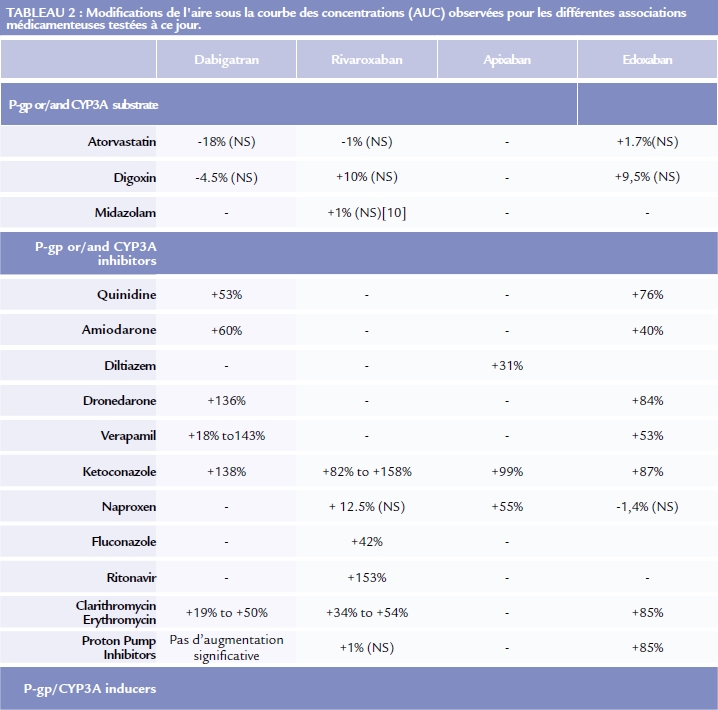
On retrouve seulement pour le dabigatran des interdictions formelles de co prescriptions avec le kétoconazole, la ciclosporine, l’itraconazole et la dronédarone qui sont de puissants inhibiteurs de la P-gp.
Il est de plus recommandé d’éviter l’association du dabigatran aux inducteurs de P-gp tels que la rifampicine, la carbamazépine ou la phénitoïne qui induisent une diminution de l’exposition au dabigatran.
Les données présentées dans le tableau II illustrent l’impact des interactions sur la pharmacocinétique des AODs, cependant leurs conséquences cliniques sont méconnues et peu étudiées.
De plus, ces données sont issues de travaux étudiant séparément chacune des interactions. Aucune étude clinique n’a considéré à ce jour le cas des interactions multiples.Or en pratique clinique courante, il est évident que ces situations sont extrêmement fréquentes.
Chez les patients souffrant d’arythmie cardiaque par fibrillation auriculaire et traités par rivaroxaban, un travail récent a montré que deux tiers des patients prenaient plus de 5 médicaments.
Le risque de saignements majeurs et/ou cliniquement pertinents était augmenté respectivement de 16% chez les patients prenant de 5 à 9 médicaments et de 47% pour ceux prenant plus de 10 médicaments 5.
Place de la biologie ?
Dans la vie réelle, les patients peuvent donc être exposés à une combinaison de plusieurs des facteurs décrits ci-dessus. L’association d’une insuffisance rénale modérée et d’interactions médicamenteuses en est un exemple. Les conséquences cliniques de telles combinaisons étant peu connues mais potentiellement dramatiques, la mise en place d’un suivi biologique pourrait être discutée chez certains patients à haut risque de complications.
Ce suivi pourrait être réalisé en début de traitement afin de déterminer une dose personnalisée.
Une étude prospective récente montre que la survenue d’une complication hémorragique ou d’une récidive thrombotique est significativement associée à des concentrations d’AODs en dehors de l’intervalle inter quantiles (95%) des données observées 6.
Un problème de taille demeure néanmoins, la définition de la cible thérapeutique optimale et des tests biologiques utilisés.
Conclusion
La pharmacocinétique des AODs est principalement modifiée par l’insuffisance rénale ainsi que par la co-médication avec les inhibiteurs/inducteurs du CYP3A4 et de la P-gp. Même si individuellement ces facteurs de risques de surexposition sont bien connus, leur impact clinique seul ou en combinaison reste encore mal étudié. Dans ces situations complexes, le suivi thérapeutique pourrait à l’avenir s’avérer utile.
L’auteur déclare ne pas avoir de liens d’intérêt.
Edouard, Ollier1 ; Xavier Delavenne1,2 ; Patrick Mismetti1,3 – ed.ollier@gmail.com
1. SAINBIOSE U1059, Equipe Disfonction Vasculaire et Hémostase, Université Jean Monnet – Saint-Etienne (France)
2. Laboratoire de pharmacologie, toxicologie, gaz du sang, CHU de Saint-Étienne, Saint-Étienne, France
3. Service de Médecine Vasculaire et Thérapeutique, Hôpital Nord, CHU de Saint-Etienne (France)
Références
1. European Medicines Agency. CHMP: Pradaxa, INN- dabigatran etexilate. EMEA, editor. 2008 http://www.ema.europa.eu/docs/fr_FR/document_library/EPAR_-_Product_Information/human/000829/WC500041059.pdf
2. European Medicines Agency. CHMP: Xarelto, INN-Rivaroxaban. EMEA editor, 2008 http://www.ema.europa.eu/docs/fr_FR/document_library/EPAR_-_Product_Information/human/000944/WC500057108.pdf
3. European Medicines Agency. CHMP: Eliquis, INN-apixaban. EMEA, editor. 2011 http://www.ema.europa.eu/docs/fr_FR/document_library/EPAR_-_Product_Information/human/002148/WC500107728.pdf
4. European Medicines Agency. CHMP: Eliquis, INN-edoxaban. EMEA, editor. 2011 http://ec.europa.eu/health/documents/community-register/2015/20150619132091/anx_132091_fr.pdf
5. Piccini JP, Hellkamp AS, Washam JB, Becker RC, Breithardt G, Berkowitz SD, Halperin JL,Hankey GJ, Hacke W, Mahaffey KW, Nessel CC, Singer DE, Fox KA, Patel MR. Polypharmacy and the Efficacy and Safety of Rivaroxaban Versus Warfarin in the Prevention of Stroke in Patients With Nonvalvular Atrial Fibrillation. Circulation. 2016 Jan 26;133(4):352-60.
6. Baldin, B., Warembourg, M., Bardy, G., Startari, L., Rocher, F., Spreux, A., … & Drici,M. D. (2015). Is Therapeutic Drug Monitoring of Direct Anticoagulants Really Unnecessary?. Circulation, 132(Suppl 3), A11598-A11598.
