
Les anticoagulants oraux directs (AOD), anti-IIa (dabigatran etexilate) ou anti-Xa directs (rivaroxaban et apixaban), sont maintenant les anticoagulants oraux de première intention utilisés dans le traitement de la maladie thromboembolique veineuse ou dans la fibrillation atriale non valvulaire en remplacement des antivitamines K (AVK). Malgré des propriétés pharmacologiques prévisibles, le risque hémorragique spontané ou provoqué des AOD demeure une préoccupation majeure et des traitements efficaces pour reverser leurs effets sur l’hémostase en cas d’hémorragie mortelle sont nécessaires…
Un seul antidote spécifique est actuellement disponible : l’idarucizumab qui est un antidote spécifique du dabigatran. Des antidotes contre les anti-Xa directs seront probablement bientôt disponibles. Jusqu`à présent, la gestion optimale des saignements chez les patients prenant des AOD utilisait des agents hémostatiques non spécifiques même si les preuves scientifiques à l’appui de ces traitements sont faibles. Cet article fait un point sur les antidotes et les traitements utilisables chez un patient présentant une hémorragie sous AOD.
Agents hémostatiques non spécifiques
Le charbon actif permet de limiter l’absorption des AOD, mais il n’a d’intérêt que dans les 6 premières heures suivant la prise. La dialyse permet de réduire la concentration en dabigatran mais n’est en aucun cas efficace sur les anti-Xa. Elle a peu de place depuis la commercialisation de l’idarucizumab.
Deux agents hémostatiques non spécifiques sont proposés en cas d’hémorragie grave associée aux AOD 1. Il s’agit des concentrés de complexe prothrombinique non activé (CCP ou anciennement définis comme PPSB) ou activé (Factor Eight Inhibitor Bypassing Activity ou FEIBA® initialement prescrit dans le traitement des hémophiles avec inhibiteurs). Le rFVIIa ne doit jamais être proposé en raison de son fort potentiel thrombogène.
L’efficacité des agents hémostatiques pour contrer les effets anticoagulants des AOD n’a jamais fait l’objet d’essai clinique. Ils n’ont été évalués qu’in vitro, chez l’animal ou le volontaire sain.
Lee et al. 2 dans une revue analysant les 11 études animales et 2 essais chez l’homme concluait à une grande hétérogénéité des résultats. Un argument convaincant pour les CCP provient d’une étude randomisée contrôlée en double aveugle menée chez 110 volontaires sains traités par edoxaban à doses thérapeutiques 3 (l’edoxaban n’est à ce jour pas encore commercialisé en France). Les CCP semblaient avoir un effet dose-dépendant permettant à forte dose de normaliser la durée du saignement.
Agents hémostatiques spécifiques
Idarucizumab
L’idarucizumab (Praxbind®), seul antidote commercialisé en 2017, est spécifique du dabigatran. Il s’agit d’un fragment d’anticorps humanisé dirigé contre le dabigatran. Il a été développé par Boehringer Ingelheim (qui commercialise déjà le dabigatran). L’idarucizumab permet la neutralisation des effets anticoagulants du dabigatran en s’y liant avec une très forte affinité, approximativement 300 fois plus puissante que l’affinité du dabigatran pour la thrombine. Aucune activation de la coagulation 4 ni immunisation significative 5 n’a été observée après injection d’idarucizumab.
Les données ayant permis sa commercialisation proviennent de la publication des résultats intermédiaires de RE-VERSE AD, étude prospective en ouvert, non randomisée et non contrôlée 6. L’antidote était administré à la dose de 2 fois 2,5 gr à 2 groupes de patients : des patients traités par dabigatran et présentant une hémorragie menaçant le pronostic vital, ou des patients nécessitant une chirurgie urgente. L`objectif principal de REVERSE-AD était l’efficacité jugée sur des critères biologiques de réversion des effets anticoagulants du dabigatran. Ce critère a été parfaitement atteint avec une réversion de quasiment tous les paramètres biologiques durant les 24 heures suivant la réversion. Cependant, aucun groupe contrôle n’a été inclus dans cet essai. De plus, la mortalité dans REVERSE-AD a été retrouvée comparable à celle observée dans les registres de pharmacovigilance français sur plus de 1000 patients ayant saignés sous dabigatran 7. Enfin, l’antidote a été administré dans près d’un quart des cas à des patients non anticoagulés puisque leur concentration circulante de dabigatran était nulle.
En ce qui concerne le suivi des patients après utilisation de l’idarucizumab, plusieurs cas décrivent depuis sa commercialisation chez des patients présentant des hémorragies sous dabigatran des rebonds de la concentration de dabigatran circulant à des taux significatifs après neutralisation 8. Ce point pose problème lorsque la normalisation de l’hémostase est nécessaire de manière durable et suggère qu’une surveillance biologique et une éventuelle seconde administration de l’antidote pourrait être utile dans certaines situations cliniques ou le saignement n`aurait pas été contrôlé.
En conclusion, l’idarucizumab a obtenu l’autorisation de mise sur le marché pour la neutralisation rapide des effets du dabigatran pour une procédure invasive urgente ou en cas de saignements incontrôlés ou menaçant le pronostic vital. Ces effets ont été confirmés avec succès dans de nombreux cas dans la littérature, même si de nombreuses questions persistent quant à son utilisation optimale et son amélioration de pronostic chez les patients recevant ce traitement. La posologie est de 5 g et aucun ajustement posologique n’est à ce jour préconisée en fonction de la concentration initiale de dabigatran ou de la clinique des malades devant subir une réversion des effets anticoagulants du dabigatran.
Andexanet alpha
L’andexanet alpha (PRT064445) est l’antidote dont le développement est le plus avancé pour les anti-Xa 9. C’est un FXa recombinant commercialisé par la société Portola qui est modifié en jouant le rôle de leurre. Il serait dépourvu d’activité catalytique et incapable de lier les phospholipides membranaires et donc de s’intégrer au complexe prothrombinase. Il serait capable de reverser les effets anticoagulants des AOD anti-Xa mais aussi des HBPM et du fondaparinux. Ce produit n’a pas encore d’autorisation de mise sur le marché. Les résultats intermédiaires de l’essai clinique ANNEXA-4, évaluant l’efficacité et la sécurité de l’andexanet alpha chez 67 patients traités par un anti-Xa oral (rivaroxaban et apixaban) ou injectable (enoxaparine) et présentant une hémorragie menaçant le pronostic vital semblent montrer un intérêt pour cette molécule 10. L’antidote a été administré en bolus suivi d’une perfusion continue de 2h.
Comme pour l’idarucizumab, l’objectif principal d’ANNEXA-4 était l’efficacité jugée sur des critères biologiques de réversion des effets anticoagulants des molécules anti-Xa. Cet objectif est partiellement atteint si on considère que cet effet est transitoire. En effet, dès l’arrêt de la perfusion, les concentrations circulantes de rivaroxaban et apixaban réaugmentent. Ainsi, lorsque la normalisation de l’hémostase sera nécessaire pendant une période prolongée, il faudra prévoir une administration intraveineuse prolongée. Comme pour l’idarucizumab, l’absence de groupe contrôle empêche de se prononcer sur l’efficacité clinique de l’andexanet alpha, d’autant plus que des évènements thrombotiques étaient signalés chez 12 patients dans les 30 jours suivant l’administration de l’antidote. Ces potentiels effets prothrombotique avaient été évoqué dans les études chez le volontaire, chez qui une augmentation des DDimères, marqueurs d’activation de la coagulation, avaient été observés.
Autres antidotes en développement
L’aripazine (PER977, ciraparantag®) est un antidote universel développé par la société Perosphère. Les études in vitro, in vivo et chez des volontaires sains semblent montrer son efficacité à réverser l’apixaban, le rivaroxaban et l’enoxaparine. Cet effet serait stable au-delà de 24 heures. Aucune donnée sur des malades présentant des hémorragies n’est disponible à ce jour.
Un autre FXa recombinant, le FXa116L est aussi en développement11. Le FXa116L s’intègre au complexe prothrombinase et permettrait le by-pass des effets anticoagulants des AOD. Aucune donnée sur des volontaires sains ou des malades présentant des hémorragies n’est disponible à ce jour.
Biologie et AOD
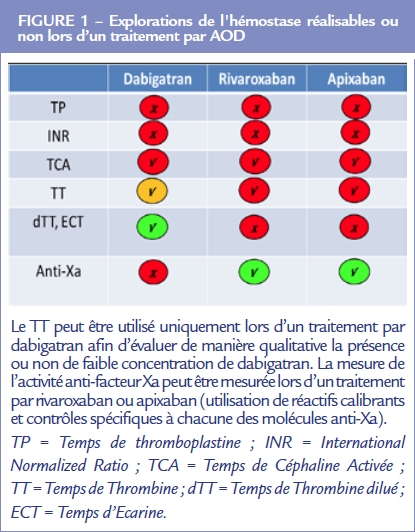
De par leur pharmacocinétique prévisible, leurs larges fenêtres thérapeutiques et leurs faible interactions médicamenteuses ou alimentaires, les anticoagulants oraux directs (AOD) sont prescrits à doses fixes et ne nécessitent pas de surveillance biologique à l’instauration du traitement, ou pour réaliser une adaptation posologique. Les AOD modifient les tests globaux d’hémostase. Cette interférence est variable selon les molécules et dépend des réactifs utilisés qui ne permettent qu’une appréciation relative de la concentration plasmatique d’AOD. De plus, un taux de prothrombine (TP) et un temps de céphaline activé (TCA) normaux n’excluent pas des concentrations plasmatiques d’AOD significatives. Les données disponibles reliant les taux d’AOD avec les événements cliniques thrombotiques ou hémorragiques ont été réalisées et ne permettent pas l’établissement de liens entre dosage et événement clinique. Cependant, une concentration d’AOD supérieure à 400 ng/mL doit être un signal d’alerte en cas d’hémorragie. Elle doit être interprétée en fonction de l’heure de la dernière prise et de la fonction rénale. L’évaluation de la fonction rénale semble le seul paramètre qui influence la survenue d’événements
cliniques 12-14. Ainsi, comme pour les HBPM, l’évaluation de la fonction rénale des patients traités par AOD doit être estimée par la formule de Cockcroft et Gault avant la mise en route, puis régulièrement notamment en cas d’événement intercurrent.
Propositions de prise en charge
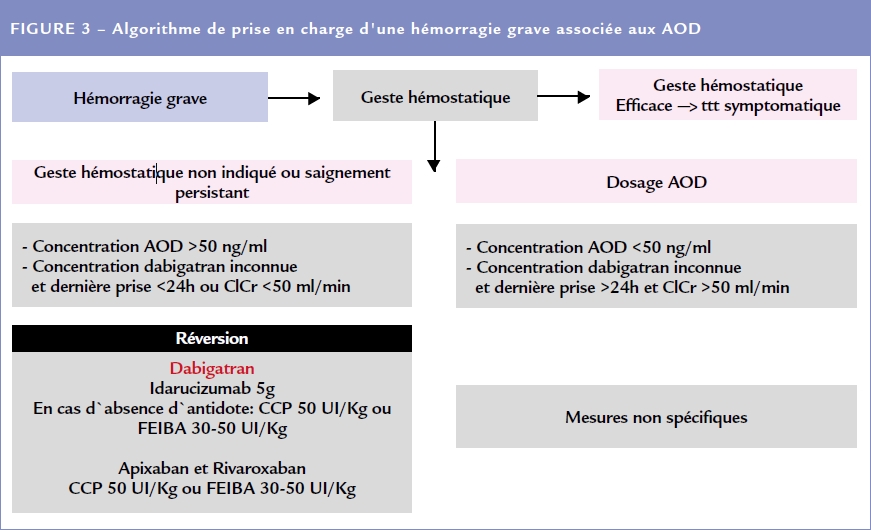
Il faut distinguer les hémorragies survenant dans un organe critique ou associées à un choc hémorragique non contrôlé 17 (figure 2). Les hémorragies graves ont été définies selon la Haute Autorité de Santé lors de la rédaction de la prise en charge des saignements sous AVK 18. Des propositions de prise en charge des hémorragies associées aux AOD peuvent être faites à partir des différents textes du GIHP pour les hémorragies engageant le pronostic vital et les hémorragies graves (Figures 2 et 3) 17, 19.
Dans les conditions d’urgences (geste chirurgical ou hémorragie engageant le pronostic vital) où le dosage des AOD peut être nécessaire, l’estimation de l’activité anticoagulante des AOD par le TP et le TCA est inappropriée 15 et doit être réalisée avec des réactifs, contrôles et calibrants adaptés pour un rendu, en ng/ml, de leur concentration (Figure 1).
Dans les tests globaux de la coagulation, seul le temps de thrombine peut être utilisé pour détecter la présence de dabigatran circulant 16. L’évaluation des hémorragies sous AOD, d’une chirurgie et/ou geste invasif à réaliser en urgence sous AOD ou encore l’arrêt des AOD en cas de chirurgie ou geste invasif programmés fait l’objet d’accord d’experts francophones publiés par le groupe d’hémostase périopératoire (GIHP)

Elles intègrent la gravité de l’hémorragie et le dosage systématique de la concentration en AOD. Pour les hémorragies engageant le pronostic vital la réversion doit être réalisée immédiatement, sans attendre le résultat du dosage de l’AOD. Dans les autres hémorragies graves, la prise en charge est guidée par le résultat du dosage de l’AOD. Lorsque la concentration est inférieure à 50 ng/mL, l’AOD ne favorise pas le saignement, la réversion n’est donc pas indiquée. Si la concentration est supérieure à 50 ng/mL, l’AOD peut participer au saignement. Si les mesures hémostatiques locales et le traitement symptomatique sont insuffisants, la réversion des AOD est proposée 19. Les hémorragies non graves sont les plus fréquentes. Leur traitement est uniquement symptomatique, sans recours aux agents de réversion. Le choix des agents de réversion dépend de leur disponibilité et de l’AOD.
Pour le dabigatran, le traitement recommandé est l’idarucizumab comme précisé précédemment. S’il n’est pas disponible, les CCP (50 UI/kg) ou le FEIBA® (30-50 UI/kg) peuvent être utilisés.
Pour les anti-Xa le traitement recommandé repose sur les CCP ou le FEIBA® aux mêmes posologies que pour la réversion du dabigatran 19.
Conclusion
L’Idarucizumab et les autres antidotes des AOD à venir présentent de nouvelles options thérapeutiques lorsque des saignements non contrôlés sous AOD se produisent et/ou lorsque la chirurgie d’urgence est justifiée. Ces antidotes pourront supplanter vraisemblablement les CCP, activés ou non, dans les protocoles de réversion. Des données sur l’efficacité clinique réelle des antidotes devront faire l’objet de nouvelles études tout comme le suivi notamment biologique de l’efficacité de la réversion afin d’affiner le bon usage de ces produits.
L’auteur déclare avoir des liens d’intérêt avec : Léo Pharma ; Boerhinger-Ingelheim ; BMS/Pfizer ; Bayer
David Smadja – Hôpital Européen Georges Pompidou, Service d’Hématologie biologique, INSERM UMR-S 1140, Université Paris Descartes, Paris, david.smadja@aphp.fr
Références
1. Godier A, Gouin-Thibault I, Rosencher N, Albaladejo P. [Management of direct oral anticoagulants for invasive procedures]. J Mal Vasc. 2015 May;40(3):173-81.
2. Lee FM, Chan AK, Lau KK, Chan HH. Reversal of new, factor-specific oral anticoagulants by rFVIIa, prothrombin complex concentrate and activated prothrombin complex concentrate: a review of animal and human studies. Thromb Res. 2014 May;133(5):705-13.
3. Zahir H, Brown KS, Vandell AG, Desai M, Maa JF, Dishy V, et al. Edoxaban effects on bleeding following punch biopsy and reversal by a 4-factor prothrombin complex concentrate. Circulation. 2015 Jan 06;131(1):82-90.
4. Schmohl M, Glund S, Harada A, Imazu S, De Smet M, Moschetti V, et al. Idarucizumab does not have procoagulant effects: Assessment of thrombosis biomarkers in healthy volunteers. Thromb Haemost. 2017 Jan 26;117(2):269-76.
5. Norris S, Ramael S, Ikushima I, Haazen W, Harada A, Moschetti V, et al. Evaluation of the immunogenicity of the dabigatran reversal agent idarucizumab during Phase I studies. Br J Clin Pharmacol. 2017 Feb 23.
6. Pollack CV, Jr., Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015 Aug 6;373(6):511-20.
7. Trinh-Duc A, Lillo-Le Louet A, Tellier E, Viard T, Le Gal G, Smadja DM. Interpretation of idarucizumab clinical trial data based on spontaneous reports of dabigatran adverse effects in the French pharmacovigilance database. Thromb Res. 2016 Oct;146:43-5.
8. Gendron N, Feral-Pierssens AL, Jurcisin I, de Raucourt E, Bouton V, Fischer AM, et al. Real-world use of idarucizumab for dabigatran reversal in three cases of serious bleeding. Clin Case Rep. 2017 Mar;5(3):346-50.
9. Siegal DM, Curnutte JT, Connolly SJ, Lu G, Conley PB, Wiens BL, et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med. 2015 Dec 17;373(25):2413-24.
10. Connolly SJ, Milling TJ, Jr., Eikelboom JW, Gibson CM, Curnutte JT, Gold A, et al. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. N Engl J Med. 2017 Sep 22;375(12):1131-41.
11.Thalji NK, Ivanciu L, Davidson R, Gimotty PA, Krishnaswamy S, Camire RM. A rapid pro-hemostatic approach to overcome direct oral anticoagulants. Nat Med. 2017 Aug;22(8):924-32.
12. Hijazi Z, Hohnloser SH, Oldgren J, Andersson U, Connolly SJ, Eikelboom JW, et al. Efficacy and safety of dabigatran compared with warfarin in relation to baseline renal function in patients with atrial fibrillation: a RE-LY (Randomized Evaluation of Long-term Anticoagulation Therapy) trial analysis. Circulation. 2014 Mar 04;129(9):961-70.
13. Alphonse RS, Vadivel A, Fung M, Shelley WC, Critser PJ, Ionescu L, et al. Existence, functional impairment, and lung repair potential of endothelial colony-forming cells in oxygen-induced arrested alveolar growth.Circulation. 2014 May 27;129(21):2144-57.
14.ADMINISTRATION USFD. FDA Cardiovascular Renal Advisory Comittee 2010-2015:www.fda.gov.
15.Baglin T, Hillarp A, Tripodi A, Elalamy I, Buller H, Ageno W. Measuring Oral Direct Inhibitors (ODIs) of thrombin and factor Xa: A recommendation from the Subcommittee on Control of Anticoagulation of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2013 Jan 24.
16.Lessire S, Douxfils J, Baudar J, Bailly N, Dincq AS, Gourdin M, et al. Is Thrombin Time useful for the assessment of dabigatran concentrations? An in vitro and ex vivo study. Thromb Res. 2015 Sep;136(3):693-6.
17.Albaladejo P, Pernod G, Godier A, GIHP Gdiehp. Prise en charge des hémorragies et des gestes invasifs urgents chez les patients recevant un anticoagulant oral et direct anti-IIa (dabigatran). httpwwwgihporg. 2016:1-22.
18.HAS. Prise en charge des surdosages en antivitamines K, des situations à risque hémorragique et des accidents hémorragiques chez les patients traités par antivitamines K en ville et en milieu hospitalier. Haute Autorité de Santé. 2008.
19.Pernod G, Albaladejo P, Godier A, Samama CM, Susen S, Gruel Y, et al. Management of major bleeding complications and emergency surgery in patients on long-term treatment with direct oral anticoagulants, thrombin or factor-Xa inhibitors: proposals of the working group on perioperative haemostasis (GIHP) – March 2013. Arch Cardiovasc Dis. 2013 Jun-Jul;106(6-7):382-93.
