
En septembre de cette année sera célébré le 40e anniversaire de la première angioplastie coronaire. Les pionniers de cette technique ont créé une nouvelle méthode susceptible de remplacer diverses interventions chirurgicales.
La cardiologie interventionnelle représente sans aucun doute une révolution dans l’histoire de la cardiologie car elle s’inscrit indiscutablement dans une évolution plus générale du remplacement de gestes agressifs par un procédé peu invasif. Elle fut rapidement adoptée par les médecins et les patients qui ont vite apprécié une approche percutanée, sans cicatrice et autorisant une sortie rapide de l’hôpital
La première angioplastie coronaire
La première intervention a été réalisée par Andreas Gruentzig 1 le 14 septembre 1977 (Figure 1). Andreas Gruentzig, originaire de Dresde en Allemagne, avait émigré avec sa famille en Argentine et était revenu en 1956 à Leipzig pour effectuer des études en Allemagne et en particulier à Heidelberg. Puis il gagna Zurich et se spécialisa en angéiologie.

En 1971, il travailla dans le département de Bollinge qui utilisait la dilatation mécanique prônée par Charles Dotter 2 dans les artères fémorales. Apprenant que Portmann à Berlin-Est utilisait des ballons en plastique entourés d’une cage métallique il tenta de construire de la même manière des ballons uniquement en plastique à utiliser dans les coronaires. Le 22 octobre 1975, avec des ballons fabriqués sur sa table de cuisine il effectua la première dilatation coronaire chez le chien. Après le sacrifice de l’animal les anatomopathologistes notèrent l’élargissement de la lumière artérielle au prix d’une dissection du vaisseau : en conséquence ils recommandèrent vivement d’arrêter cette recherche.
L’année suivante il partit pour San Francisco où il effectua des dilatations coronaires per-opératoires avec Richard Myler : trois procédures furent couronnées de succès. De retour en Suisse Andreas Gruentzig chercha vainement un patient pour pouvoir faire une dilatation coronaire chez l’homme. C’est Bernard Meier qui allait identifier le patient adéquat : un ingénieur de 38 ans souffrant d’une angine de poitrine de classe III avec une ischémie myocardique évidente au test d’effort.
Le 14 septembre 1977 avec un ballon assez artisanal il effectua la dilatation d’une sténose de l’artère interventriculaire antérieure proximale avec un bon résultat (Figure 2). Celui ci fut contrôlé le 16 septembre avec un résultat qui se maintient et enfin le 20 octobre l’artère avait retrouvé un calibre assez satisfaisant. Andreas Gruentzig effectuait de longues marches dans les Alpes avec un cardiologue allemand Martin Kaltenbach. Ils avaient décidé de faire la première tentative à Zurich et la seconde à Francfort. Il est intéressant de noter que deuxième dilatation portait en fait sur un tronc commun coronaire gauche : l’intervention fut effectuée avec succès et dans la foulée un troisième patient avec un tronc commun plus une artère coronaire droite fut traité. Ceci fut suivi de quatre dilatations chez d’autres patients sans aucune complication.

Après publication des premiers résultats, la technique connut un grand succès mais Gruentzig soucieux de garder une technique de qualité organisa des démonstrations lors de symposia très suivis à Zurich. Il trouva enfin une firme qui accepta de préparer et commercialiser les ballons de dilatation (Schneider Medintag).
Toutefois pour que d’autres investigateurs puissent obtenir ce matériel il était nécessaire d’avoir assisté à un de ses cours à Zurich et les cathéters ne pouvaient être obtenus qu’au compte-goutte.
De 1977 à 1981 la technique se développe très lentement car le cathéter est très gros et trop rigide: le montage du matériel d’angioplastie sur la table de cathétérisme est très compliqué. L’inflation du ballonnet se fait par une seringue métallique remplie de produit de contraste poussé par une pompe à pied. A cette date Gruentzig lui-même disait que la technique serait limitée à quelques cas, en particulier les sténoses de l’artère interventriculaire proximale et du premier/deuxième segment de la coronaire droite. L’artère circonflexe était le plus souvent inaccessible car ces cathéters dont l’extrémité se terminait par un petit flexible (Figure 3 ) étaient trop rigides pour pouvoir prendre le virage tronc commun artère circonflexe. A cette époque un cardiologue américain, Maurice Buchbinder, avait créé un matériel dont la parte distale pouvait être pliée et s’adapter à ce virage.
En France la première dilatation coronaire fut réalisée par Jean Léon Guermonprez à Paris et presque simultanément par Jean Marco à Toulouse et Michel Bertrand à Lille. Au Canada Robert David et aux États-Unis, Spencer King et John Douglas réalisèrent leurs premières angioplasties en 1980.
Première révolution : le guide dirigeable ‘steerable guidewire’
La technique connut une première révolution lorsque John Simpson 3 décrivit la technique du “steerable guidewire” c’est-à-dire un cathéter coaxial se déplaçant sur un fil métallique très flexible à son extrémité et que l’on pouvait façonner de manière à le diriger vers des branches coronaires et jusqu’aux extrémités les plus distales. La méthode se retrouva extraordinairement simplifiée et le nombre de cas d’angioplastie augmenta de façon exponentielle. Il y avait cependant des limites à cette technique dans la mesure où l’on pouvait difficilement échanger le ballon pour utiliser des ballons de taille plus importante ce qui impliquait le retrait et donc la perte de la sécurité qu’offrait le maintien du guide à travers la sténose.
Il fut proposé des rallonges emmanchées sur le guide et aussi la technique du long guide proposé par Martin Kaltenbach.
Quelque temps plus tard un cardiologue interventionnel de Fribourg, Tassilio Bonzel 4 proposa la technique du monorail qui permet d’échanger très facilement des ballons de tailles différentes, le guide restant en place.

À partir de 1985, le nombre de procédures augmenta très sérieusement mais il restait quand même un certain nombre de problèmes à régler. Le premier était d’améliorer la sécurité de la procédure car l’angioplastie coronaire pouvait entraîner une occlusion liée soit à une dissection de l’artère soit à une thrombose in situ de telle sorte que 6 à 10 % des patients dilatés étaient envoyés en urgence en chirurgie cardio-vasculaire pour un pontage. Le plus souvent cette intervention de sauvetage laissait quand même une nécrose myocardique d’importance variable. En deuxième lieu on s’aperçut que 35 à 40 % des patients traités développaient une resténose à l’endroit dilaté et devaient faire l’objet soit d’une nouvelle dilatation soit même d’un pontage coronaire.
Parallèlement de nouveaux outils furent proposés : l’imagination des cardiologues interventionnels est sans limite. On a vu ainsi éclore des outils comme l’athérectomie directionnelle, permettant de réaliser une véritable biopsie de la sténose coronaire. Plus tard est apparu le TEC (Transluminal extracting coronaire de Richard Stack) permettant d’aspirer les débris créés par un outil rotatif tranchant : il était surtout employé à traiter les sténoses du pontage aortocoronaire dégénéré.
En 1990 Michel Bertrand et Jean-Louis Fourier ont effectué le premier Rotablator c’est-à-dire l’utilisation d’une technique avec une fraise rotative tournant à grande vitesse qui abrasait la plaque d’athérosclérose et la réduisait en microparticules éliminées à travers les capillaires sanguins et captées par le système réticuloendothélial.
D’autres auteurs avaient proposé l’utilisation du laser : la première tentative peropératoire fut effectuée chez l’homme durant un pontage en 1983 et réalisée par Jean Marco, Dan Choy, Simon Stertzer et Fournial à Toulouse. Divers outils ont été proposés en espérant qu’il provoquerait moins de resténoses : citons le ballon chauffant de Richard Spears, le Rotacs de Martin Kaltenbach pour les occlusions chroniques, le ballon à éversion linéaire de Thomas Fogarty, les ultrasons thérapeutiques de Robert Siegel, le Cutting ballon de Peter Barath. Presque tous ces outils ont été abandonnés à l’exception du cutting ballon et du rotablator.
À cette époque on pensait que la resténose était entièrement liée à un processus d’hyperplasie de type cicatriciel et de ce fait de multiples essais tentèrent de prévenir cette cicatrisation exubérante par la prescription de médicaments les plus divers : c’est ainsi que pendant plusieurs années 67 essais randomisées comparant une nouvelle drogue à un placebo ont été effectués chez près de 50 000 patients. Pratiquement tous ces essais se sont montrés négatifs et la recherche du médicament miracle pour prévenir la resténose se présentait un peu comme la quête du St Graal.
Parallèlement les indications de l’angioplastie coronaire évoluaient : initialement réservée aux patients avec une ou deux lésions coronaires, d’autres investigateurs se sont attaqués aux multi tronculaires en particulier sous l’impulsion de Geoffrey Hartzler un cardiologue de Kansas City, particulièrement habile.
Toutefois il restait un certain nombre de problèmes de sécurité puisque environ 5 à 10 % des patients traités par angioplastie devaient encore être envoyés en chirurgie pour un pontage coronaire en urgence qui dans la plupart des cas permettait de sauver le malade en laissant un infarctus quelquefois important. Mais surtout, persistait le problème irritant de la resténose.
La seconde révolution : le stent coronaire
La seconde révolution de l’angioplastie coronaire est le stenting. Il s’agit ni plus ni moins que de maintenir l’artère ouverte à l’endroit de la dilatation ou en d’autres mots d’effectuer une sorte de tunnellisation du vaisseau. Il faut savoir cependant que autrefois les Égyptiens traitaient les sténoses post-gonococciques de l’urètre par l’introduction d’un fin tube de bambou et que en 1912 Alexis Carrel avait publié des résultats de l’intubation permanente de l’aorte thoracique ; c’est en 1969 que Charles Dotter avait introduit des tubes dans les artères périphériques Le stent coronaire est né de la rencontre de deux Suédois vivant à Zurich : l’un est Hans Wallsten, un industriel préparant du matériel d’imprimerie et l’autre un chirurgien thoracique, Ake Senning. C’est au cours d’un cocktail à Zurich que le chirurgien a expliqué à l’industriel qu’il avait bataillé toute l’après-midi avec une dissection aortique. Celui-ci lui a suggéré de placer un tube en grillage métallique pour stabiliser les parois du vaisseau.

Cette sorte de ressort pour être introduit dans l’artère devait être contraint par une membrane inventée par un ingénieur anglais Christian Imbert. La rétractation de cette membrane permettait l’auto expansion du grillage qui venait donc se plaquer contre la paroi du vaisseau et maintenait donc la lumière ouverte (Figure 4).
Deux groupes d’investigateurs avaient effectué des recherches sur l’animal : Jacques Puel à Toulouse et Ulrich Sigwart à Lausanne 5. La première implantation chez l’homme fut effectuée par Jacques Puel à Toulouse en mars 1986 chez un patient porteur d’une lésion de l’interventriculaire antérieure proximale (Figure 5 et 6).
Cette deuxième révolution fut sensationnelle car l’implantation d’un stent permettait de stabiliser les dissections et occlusions per opératoires et d’éviter ainsi la chirurgie de pontage en urgence qui pour la plupart des équipes ne deviendra nécessaire que dans moins de 0,1 % des cas (Figure 7).

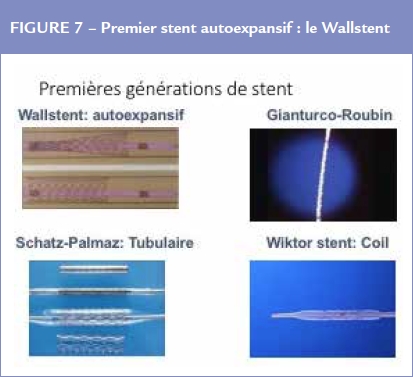
Les investigateurs commencèrent à effectuer des implantations électives c’est-à-dire en dehors des cas d’urgence mais très vite il apparut que le stent était le moyen le plus sûr pour créer une thrombose coronaire expérimentale chez l’animal. Si les premiers patients n’ont pas eu de thrombose coronaire, les cas suivants développèrent une occlusion thrombotique dont le nombre avoisinait les 15%, malgré l’administration d’anticoagulants puissants. Il en résulta que le nombre d’implantations électives diminua.
De nombreux protocoles d’anticoagulation furent proposés : ils étaient de plus en plus agressifs mais n’empêchaient pas la thrombose et déterminaient des saignements et des hématomes importants notamment au point d’introduction des cathéters avec des faux anévrismes nécessitant une réparation chirurgicale. Fin 1990 début 1991 le stent était pratiquement mort et n’était presque plus employé en dehors des procédures de sauvetage.
C’est presque par hasard que fut découverte, l’efficacité du double traitement antiagrégant plaquettaire. Paul Barragan avait participé à une étude clinique dirigée par Michel Bertrand et qui évaluait l’efficacité d’un antiagrégant plaquettaire, la ticlopidine, pour la prévention de la procédure de la resténose. Cet essai dénommé TACT ne montra aucune action de la ticlopidine pour prévenir la resténose mais on nota moins d’accidents, pendant la procédure. Lors des réunions de cardiologie interventionnelle, chaque équipe rapportait ses résultats et seul Barragan ne déplorait pas de thrombose de stent : un registre français fut ouvert et en procédant par étape chez des malades qui recevaient aspirine et ticlopidine, on observa que l’on pouvait supprimer divers anticoagulants et que l’on avait moins de saignements, de réparation chirurgicale et de thrombose de stent à condition de donner pendant un mois l’association de ces 2 antiagrégants plaquettaires. Parallèlement en Italie, Antonio Colombo utilisant extensivement l’échographie endocoronaire soutenait que la thrombose des stents était liée à une mauvaise implantation de la prothèse.
Les essais randomisés comparant ticlopidine+aspirine au traitement conventionnel furent conduits simultanément en Allemagne par A. Schömig et en France par Michel Bertrand. Ces deux essais confirmèrent la presque disparition de la thrombose de stent par ce double traitement anti agrégant plaquettaire et ceci fut confirmé plus tard par un essai américain STAR.
L’essai clinique CLASSIC démontra que le clopidogrel était plus sûr que la ticlopidine ; dès lors le traitement standard après pose d’un stent était cette double association d’antiagrégant plaquettaire. Avec les nouveaux stents apparus sur le marché, commença
une véritable ‘Stentomania’. Parallèlement les essais Benestent 1 & 2 de Patrick Serruys confirmèrent le rôle préventif mais modeste de ces prothèses sur la resténose (Figure 8).

La troisième révolution : le stent actif
Il fallut attendre encore 10 ans pour que le problème de la resténose soit réglé en habillant les barreaux de la prothèse par un polymère imprégné d’une substance antiproliférative. Serruys et De Souza réaliserent une première évaluation de ces nouvelles prothèses habillées “drug eluting stent” chez 15 patients suivis par angiographie coronaire quantitative et échographie endocoronaire. Ils constatèrent l’absence de prolifération intrastent et l’absence de resténose. Un essai de plus grande ampleur RAVEL 6 comparant ces stents actifs à des stents standard montra à la grande stupeur des cardiologues interventionnels la disparition de la resténose. Ce fut la troisième révolution dans l’histoire de la cardiologie interventionnelle coronaire. D’autres substances anti prolifératives furent proposées et plusieurs essais SIRIUS-TAXUS confirmèrent le bénéfice immédiat dans diverses situations cliniques, en notant toutefois que chez les diabétiques et les vaisseaux de petit calibre persistaient un petit pourcentage de resténose péri ou intra stent (Figure 9).
Toutefois divers auteurs firent remarquer que l’on pouvait observer des thromboses tardives, au-delà du premier mois suivant la pose de prothèse. C’est ainsi qu’en 2002, à Barcelone au congrès de la société européenne de cardiologie une publication fit état de survenue tardive d’infarctus ou de mort subite après pose d’un stent actif. Toutefois après quelques moments de flottement, la communauté cardiologique interventionnelle fut rassurée à condition que soit prolongé le double traitement antiagrégant plaquettaire. La longueur de cette prolongation fait encore débat aujourd’hui.
Rassuré sur la sécurité des procédures comportant l’implantation d’un stent actif, plusieurs essais randomisés ont comparé la chirurgie de pontage aorto coronaire moderne c’est-à-dire avec des greffons artériels, à l’angioplastie avec implantation de stent actif chez les patients pluri tronculaires. L’essai SYNTAX permit d’établir un score autorisant des indications plus précises en particulier chez les malades avec lésions multi tronculaires. Un peu plus tard l’essai FREEDOM démontra que chez les diabétiques multi tronculaires la chirurgie de pontage moderne était supérieure en termes d’événements et de nécessité d’intervention ultérieure. Enfin Serruys et coll s’attachèrent à la mise au point d’un stent résorbable qui offre l’avantage de restituer à la paroi une vasomotricité acceptable et de ne pas laisser indéfiniment un corps étranger dans la paroi vasculaire 7.
Pendant longtemps, en raison de la taille des cathéters à ballonnet, on utilisa des cathéters guides de gros diamètre : 8F et même 9F (soit 3mm de diamètre). Le corollaire était la survenue d’hématomes importants au point de ponction et de faux anévrysmes nécessitant une réparation chirurgicale de l’artère fémorale. Les fabricants de cathéters fabriquèrent des cathéters guides de plus petit diamètre mais avec une paroi mince autorisant une large lumière. Parallèlement les cathéters à ballonnet furent plus profilés et passaient facilement dans ces cathéters guides de taille 5F ou 6F. Cette évolution ouvrit la porte à la voie radiale. Jusqu’alors, le cathétérisme diagnostique et interventionnel se faisait par la voie fémorale ce qui nécessitait une compression prolongée et le repos strict au lit pendant 24 heures, retardant d’autant la sortie du patient. Ferdinand Kiejmenedj proposa la voie radiale : les mini cathéters provoquaient moins de réaction spastique de la radiale. Cette technique, née en Europe, vulgarisée par Louvart et Hamon, mit plusieurs années avant de franchir l’Atlantique. Un autre progrès important fut la mesure de la FFR “fractional flow reserve”. Proposée par Nico Pils, elle permet d’identifier les sténoses véritablement ischémiques et d’éviter des dilatations inutiles pouvant cependant resténoser.
La quatrième révolution : le remplacement valvulaire percutané
Le cadre de la cardiologie interventionnelle dépassa celui des artères coronaires et s’intéressa à d’autres domaines et en particulier les lésions valvulaires. Peu après les débuts de l’angioplastie coronaire, certains auteurs essayèrent d’appliquer la dilatation
au ballonnet à des rétrécissements valvulaires : en cardio-pédiatrie, la sténose valvulaire pulmonaire fut traitée par dilatation avec succès. Au niveau mitral un ou deux gros ballons introduits par voie transseptale permettaient d’élargir l’orifice mitral sténosé au décours d’un rhumatisme articulaire aigu. Ces procédés de dilatation furent simplifiés par l’utilisation de la technique d’Inoué qui devint le standard de dilatation du rétrécissement mitral. Un grand nombre de patients bénéficièrent de cette technique comme le montra l’impressionnante série de Vahanian. Avec l’éradication du rhumatisme articulaire aigu, le nombre de rétrécissements mitraux diminua très sensiblement.
Rapidement on observa que la pathologie valvulaire la plus fréquente était le rétrécissement aortique du sujet âgé, un rétrécissement serré, dégénératif, calcifié. Cette pathologie longtemps silencieuse nécessitait une intervention chirurgicale dès qu’elle devenait symptomatique .La mortalité s’élève à 80% des cas dans les 3 ans suivant l’apparition des symptômes : toutefois le remplacement valvulaire chirurgical chez un patient âgé et porteur de diverses comorbidités est irréalisable dans plus d’un tiers des cas et les résultats de cette chirurgie sont limites chez des octo ou nonagénaires.

En 1985 Alain Cribier proposa de dilater l’orifice valvulaire aortique calcifié avec un ballonnet : les résultats immédiatement encourageants furent rapidement décevants par la réapparition de la sténose. C’est dans ces conditions que Cribier 8 proposa la mise en place d’un stent incluant une bio prothèse valvulaire au niveau de l’orifice aortique (Figure 10).
Cette technique avait été initialement effectuée par Philip Bonhoeffer au niveau de l’orifice pulmonaire. Toutefois le challenge était plus important et plus difficile au niveau de l’orifice aortique. Au Danemark, Anderson avait effectué une étude expérimentale d’implantation percutanée d’une bio prothèse niveau aortique.
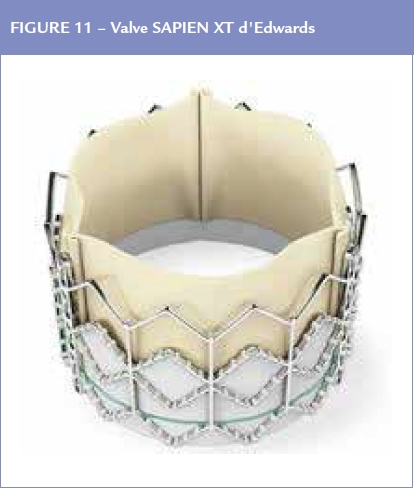
C’est Alain Cribier qui réalisa chez un malade âgé avec déchéance poly viscérale et une gangrène des membres inférieurs la première implantation (Figure 11).
Celle-ci fut un succès et dès lors les études se succédèrent montrant les bénéfices importants que l’on pouvait atteindre chez des patients à haut risque puis à risques intermédiaires au point de faire de cette technique (TAVI : Transaortic Valvular Implantation) une alternative à la chirurgie de remplacement valvulaire. Le nombre de TAVI augmenta de façon substantielle ; des modifications et les améliorations de la prothèse permirent de considérer cette technique comme probablement susceptible de remplacer complètement la chirurgie de remplacement valvulaire.
Dans le domaine mitral, l’insuffisance mitrale a fait ces dernières années l’objet d’un certain nombre de travaux concernant sa correction par voie percutanée : cerclage de l’anneau mitral et surtout le Mitraclip qui en transformant l’orifice mitral unique en deux orifices séparés en canon du fusil permet de réduire la régurgitation mitrale.
Plus récemment une technique plus ou moins comparable commence à s’attaquer à l’insuffisance tricuspidienne.
Conclusion
La cardiologie interventionnelle fut l’une des grandes révolutions de la cardiologie de la fin du siècle dernier, et continue d’évoluer de façon très satisfaisante grâce à l’innovation sans limite des chercheurs, des ingénieurs et des cardiologues.
Elle a débordé dans d’autres domaines (gastro entérologie, néphrologie, pneumologie etc..) et s’inscrit dans cette évolution médicale très importante consistant à remplacer un geste agressif par une technique simple, peu invasive et ambulatoire dans une grande majorité de cas. On peut, sans risque de se tromper, dire que la cardiologie interventionnelle n’a pas fini de nous étonner et qu’elle est promise à un très brillant avenir.
Michel E. Bertrand – mbertrand2007@gmail.com, Professeur Honoraire de Cardiologie à l’Université de Lille, Past-Président de la Société Européenne de cardiologie
Références
1-Gruentzig A Transluminal dilatation of coronary-artery stenosis Lancet 1978;1(8058):263
2-Dotter CT, Judkins MP :Transluminal treatment of arteriosclerotic obstruction : Description of a new technic and a preliminary report of its application Circulation 1964;30: 654-670.
3-Simpson JB, Baim DS, Robert EW, Harrison DC.A new catheter system for coronary angioplasty. Am J Cardiol. 1982;49(5):1216-22.
4-Bonzel T, Wollschläger H, Kasper W, Meinertz T, Just H.The sliding rail system (monorail): description of a new technique for intravascular instrumentation and its application to coronary angioplasty.Z Kardiol. 1987;76 Suppl 6:119-22.
5-Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty..N Engl J Med. 1987;316(12):701-6
6-Morice MC, Serruys PW, Sousa JE, Fajadet J, Ban Hayashi E, Perin M, Colombo A, Schuler G, BarraganP, Guagliumi G, MolnàrF, Falotico R; RAVEL Study Group. A randomized comparison ofa sirolimuseluting stent with a standard stent for coronary revascularization.N Engl J Med. 2002;346(23):1773-80
7-Serruys PW, Ormiston J, van Geuns RJ, de Bruyne B, Dudek D, Christiansen E, Chevalier B, Smits P, McClean D, Koolen J, Windecker S, Whitbourn R, Meredith I, Wasungu L, Ediebah D, Veldhof S, Onuma Y. A Polylactide Bioresorbable Scaffold Eluting Everolimus for Treatment of Coronary Stenosis: 5-Year Follow-Up. J Am Coll Cardiol. 2016; 67(7):766-76.
8- Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, Derumeaux G, Anselme F, Laborde F, Leon MB.Aortic Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific stenosis: first human case description .Circulation. 2002 ;106(24):3006-8.
