 Erwan Donal, Anne Guerin,
Erwan Donal, Anne Guerin,
Service de Cardiologie et Maladie Vasculaire
Service de Chirurgie Cardio-thoracique et Vasculaire – CHU Rennes
erwan.donal@chu-rennes.fr
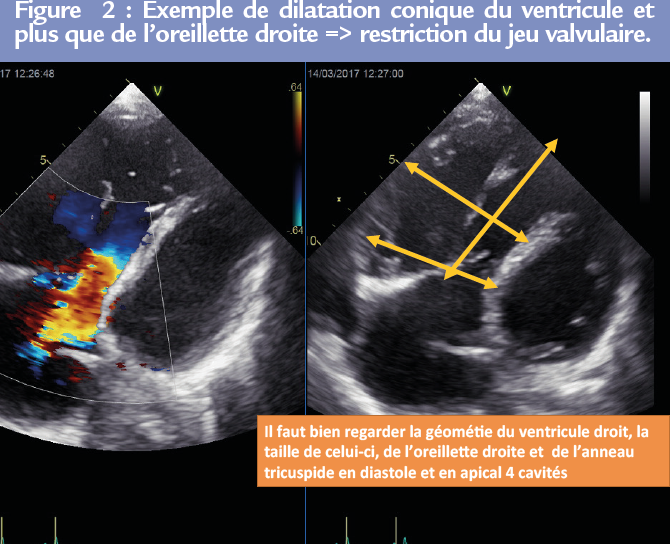
La valve tricuspide : il faut y penser ! Lors de toute échocardiographie, il faut mesurer l’anneau tricuspide en diastole et en vue apicale 4-cavités. Il faut aussi regarder l’anatomie du ventricule droit et pas uniquement le TAPSE ou l’onde s’.
La fuite tricuspide reste un sujet thérapeutique diffi cile mais pour laquelle des innovations arrivent. L’échocardiographie progresse, l’IRM aussi. Une surface de l’orifice régurgitant > 40mm est associée à un pronostic plus sombre.
Primitive ou secondaire ?
La régurgitation tricuspide peut être « Secondaire » ou anciennement « fonctionnelle ». Il faut préférer le terme secondaire car ce sont les anomalies du ventricule droit et /ou l’oreillette droite qui causent la régurgitation. Ou « Primitive », plus rare, lorsqu’il y a une anomalie anatomique des feuillets de la valve tricuspide (prolapsus par exemple).
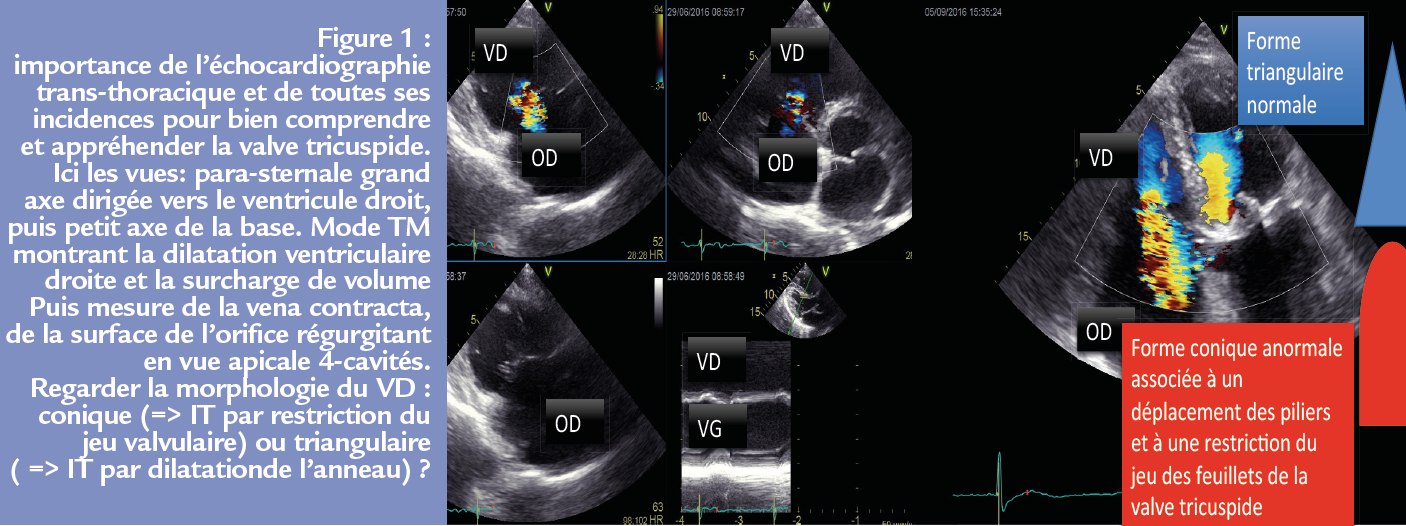
Le pronostic de la régurgitation tricuspide reste imparfaitement connu et son traitement est mal codifié Figure 1. Pour les insuffisances tricuspides primitives, le raisonnement est celui adopté dans l’insuffisance mitrale primitive. Concentrons-nous maintenant sur les formes secondaires.
On notera, et c’est pour cela que l’échocardiographie est importante dans le suivi des insuffi sants cardiaques et valvulaires (des patients dyspnéiques) que l’insuffisance tricuspide va, rester cliniquement très longtemps bien tolérée. Ce n’est que lorsque le retentissement de la fuite sur l’oreillette et le ventricule droit devient important que le patient présente des signes cliniques. Ceux-ci peuvent être aspécifiques (asthénie) mais la surcharge droite avec les oedèmes, l’ascite et le bas débit sont souvent des signes apparaissant lorsque le retentissement de la fuite est devenu trop sévère pour envisager alors une correction de la régurgitation.
L’orifice tricuspide doit être analysé lors de toute échocardiographie en particulier lorsqu’il existe une cardiopathie gauche valvulaire ou autre.
Anatomie de la valve tricuspide
La valve tricuspide n’est pas un orifi ce circulaire mais un orifice semi-lunaire (1-3). Rappelons que le coeur droit entoure une partie du ventricule gauche.
La valve tricuspide est un complexe comportant :
• Trois feuillets valvulaires antérieur, postérieur, septal, (le plus souvent). Le feuillet septal est proche du noeud atrio-ventriculaire. Ces cordages attachés au septum en font un acteur particulier des fuites tricuspides secondaires (rôle majeur joué par la cinétique du septum inter ventriculaire)
• Des cordages tendineux
• Trois piliers (plus ou moins bien individualisés) avec le pilier antérieur et postérieur qui sont prédominants et, à la différence de la valve mitrale, des piliers qui donnent des cordages pour leur feuillet valvulaire respectif et pas pour les autres feuillets.
Insuffisance tricuspide secondaire
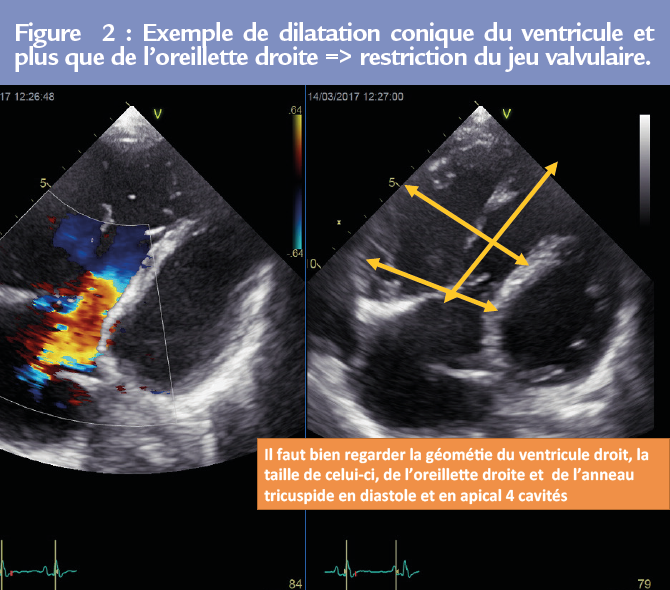
L’insuffisance tricuspide (IT) secondaire (fonctionnelle) paraît relever de deux mécanismes différents. Figure 2
• la restriction de mobilité des feuillets tricuspides avec traction (« tenting ») valvulaire secondaire à une dilatation du ventricule droit,
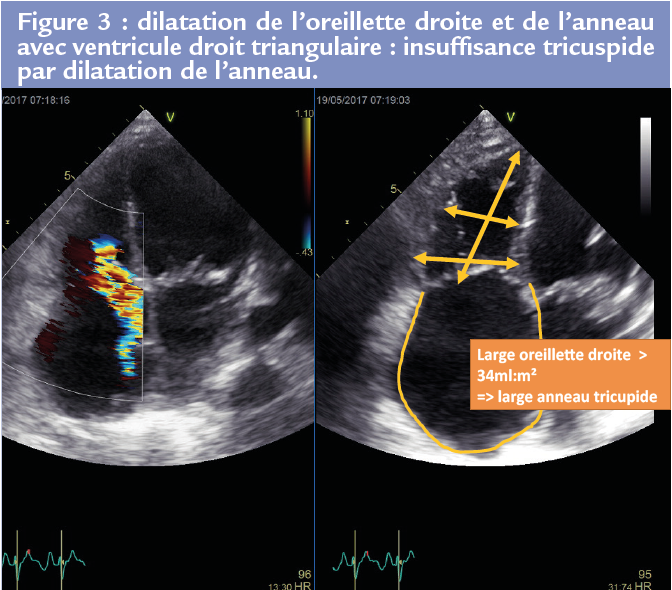
• la dilatation isolée de l’anneau, secondaire à la dilatation de l’oreillette droite et de la base du ventricule droit (4).
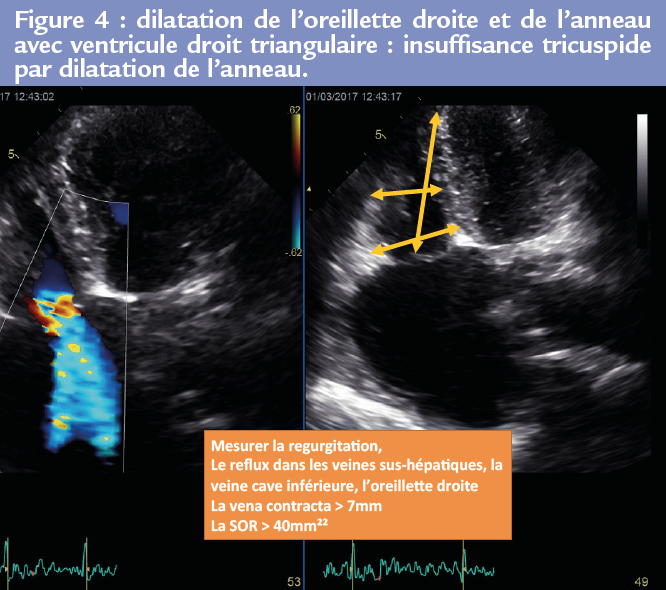
Le vieillissement de la population, les pathologies du coeur gauche, la fibrillation atriale, les pathologies pulmonaires, peuvent faire le lit de ces 2 types d’insuffi sance tricuspide fonctionnelle par remodelage des cavités cardiaques droites. La caractérisation du remodelage des cavités droites, les déterminants de ces 2 types d’IT, leurs conséquences pronostiques respectives sont peu ou pas connues. De plus, l’intérêt et le moment de la prise en charge thérapeutique de ces 2 types d’IT restent, comme indiqué dans les recommandations européennes, mal codifiés. On retiendra qu’à coté du remplacement valvulaire tricuspide et de l’annuloplastie, de nombreuses techniques chirurgicales ont été proposées : plastie d’agrandissement, déplacement des cordages, bicuspidisation… Figures 3 et 4
Cette régurgitation tricuspide « secondaire » (fonctionnelle) est-elle simplement la conséquence d’autres pathologies cardio-vasculaires plus importantes à considérer ou un élément clé qu’il faut envisager de traiter spécifiquement, et selon quelles modalités et dans quelles indications ?
Le diagnostic des insuffisances tricuspides (IT) est souvent réalisé au stade de dysfonction ventriculaire droite en raison de la bonne tolérance prolongée de la fuite, mais aussi en raison de la possibilité d’avoir une dysfonction VD sévère malgré une fraction d’éjection VD normale et donc faussement rassurante. Les fuites de grade ≥ 2 représenteraient 0.8% dans la population générale (5) tandis que les grades ≥ 3 représenteraient environ 10% des échographies de l’adulte (6). Les fuites « secondaires » sont majoritaires (75%), 15% à 20% en préopératoire des valvulopathies du coeur gauche [16% en cas d’insuffi sance mitrale dégénérative] (7) et 19% en pré-TAVI (8). Elles concerneraient entre 15% et 67% des patients 10 ans après une chirurgie mitrale (9). La dysfonction VG et la fibrillation atriale sont à la fois facteur causal et facteur d’aggravation de l’IT Figure 3. Les fuites de grade ≥ 2 sont retrouvées chez 35% des patients en fibrillation atriale isolée et chez 30% des patients ayant une dysfonction VG isolée.
Les fuites primitives (25%), caractérisées par une atteinte anatomique des feuillets ou de l’appareil valvulaire, sont principalement liées aux lésions induites par les sondes de stimulateurs cardiaques (+25% après la pose d’un stimulateur cardiaque) (10). Les autres causes incluent les lésions traumatiques (traumatisme à coeur fermé, biopsie endomyocardique), les tumeurs carcinoïdes, les endocardites, et les pathologies dégénératives de type prolapsus.
L’exploration du coeur droit et de la valve tricuspide a été pendant longtemps essentiellement qualitative.
L’échocardiographiste était classiquement plus concentré sur le coeur gauche que sur le coeur droit. De nombreuses publications ont cependant démontré l’intérêt de l’exploration quantitative du coeur droit et de l’insuffisance tricuspide basée sur l’échocardiographie 2D incluant l’analyse de déformation myocardique, ou encore l’échographie 3D. D’autres techniques d’imagerie telles que l’angiographie isotopique ou l’IRM cardiaque ont également été utilisées pour l’exploration du VD. Si l’échographie reste la technique de choix en pratique clinique, il faudra ne pas hésiter à avoir recours au cathétérisme cardiaque droit (vérifier l’absence d’une hypertension pulmonaire qui contreindiquerait un geste sur la valve tricuspide), à l’ IRM ou à la gamma-angiographie (pour s’assurer que la dysfonction, n’est pas trop sévère de la fonction ventriculaire droite). L’intérêt de ces techniques d’imagerie cardio-vasculaire pour l’exploration du coeur droit par rapport à l’échocardiographie n’est pas clairement défini mais, comme souvent lorsque la prise en charge est difficile, l’approche multi-modalité semble être de mise.
L’insuffisance tricuspide a une valeur pronostique assez clairement établie. La présence d’une fuite tricuspide sévère est un facteur indépendant de mortalité avec une survie médiane de 2 ans (11). La surface de l’orifice régurgitant de cette régurgitation tricuspide > 40mm2 a une valeur pronostique forte et indépendante. En cas de valvulopathie gauche, plusieurs études suggèrent que la dilatation annulaire tricuspide pourrait être le reflet d’une modification structurelle non réversible de l’anneau favorisant l’aggravation ou le développement ultérieur d’une fuite fonctionnelle. Cette hypothèse repose sur les travaux de Dreyfus et al (12) montrant qu’une annuloplastie préventive en cas de dilatation annulaire diminue les fuites post opératoires. Ces observations ont été confi rmées par une étude randomisée de Benedetto (13) démontrant le bénéfice de l’annuloplastie préventive sur la réduction des fuites post-opératoires, le remodelage ventriculaire droit et la symptomatologie chez les patients ayant une IT de grade ≤2 et un anneau ≥40mm. Ces notions restent cependant basées sur de petites séries et concernent des IT associées à une pathologie valvulaire du coeur gauche, sans discrimination du mécanisme de l’IT en dehors de la dilatation annulaire.
En cas d’IT isolée, le pronostic a été analysé rétrospectivement à propos de 353 patients dont 68 avaient des IT considérées comme sévère selon la méthode PISA. La surface de l’orifice régurgitant ressort comme un marqueur pronostique indépendant dans cette étude ayant un suivi de 10 ans (14-16). Un article récent stipule que l’insuffisance tricuspide isolée doit faire rechercher une insuffisance cardiaque à fraction d’éjection préservée. Aucune stratégie claire concernant le traitement ne se dégage à ce jour.
Au vu de ces données, il nous est apparu pertinent d’analyser les caractéristiques cliniques et échocardiographiques, ainsi que le pronostic des patients ayant une fuite tricuspide « fonctionnelle » de sévérité moyenne à sévère (grade 2 à 4) secondaire à une atteinte du coeur gauche, en l’absence de valvulopathie significative évolutive ou de dysfonction systolique marquée. Un observatoire prospectif et pronostique appelé TRAP est initié sous l’égide de la Filiale d’Imagerie Cardio-Vasculaire de la Société Française de Cardiologie. Celui-ci fera appel à une relecture des échocardiographies dans un centre spécifi que pour homogénéiser la quantifi cation de la fuite et de la fonction ventriculaire droite. Nous espérons ainsi mieux comprendre les tenants et aboutissants de ces régurgitations tricuspides secondaires qui sans nul doute justifi eront rapidement des traitements nouveaux. La chirurgie d’annuloplastie restrictive reste la référence mais comme sur la régurgitation mitrale secondaire, elle donne des résultats à long terme qui ne correspondent pas toujours aux les attentes. Des plasties plus complexes et un peu moins codifiées ont été proposées, le remplacement valvulaire tricuspide plutôt par bioprothèse restant d’actualité pour quelques cas difficiles. Il existe également de forts espoirs dans l’avènement de traitements percutanées. Ainsi, le mitraclip en position tricuspide a été essayé, d’autres approches sont à l’étude et les valves percutanés en position tricuspide devraient se développer dans les mois ou années à venir. Toutes ces nouvelles technologies seront naturellement à évaluer dans le cadre d’essais.
L’auteur déclare ne pas avoir de lien d’intérêt avec le sujet traité.
CE QU’IL FAUT RETENIR :
1) Bien regarder le coeur droit dans plusieurs incidences lorsque l’on effectue une échocardiographie
2) Rechercher une modifi cation de la géométrie du ventricule droit (conique plus que triangulaire en vue apicale)
3) Regarder le jeu des valves tricuspides : ce jeu est-il restreint ? Y-a -t-il 3 ou 4 feuillets ? l’anneau en diastole et en apical 4 cavités est-il plus large que 40mm ?
4) Une surface de l’orifi ce régurgitant > 40mmÇ est un marqueur pronostique indépendant.
5) Ne pas se limiter à l’échocardiographie : un cathétérisme droit après déplétion hydrosodée, une gamma-angiographie VD ou une IRM peuvent être effectués pour s’assurer de la concordance des techniques pour l’estimation de la fonction VD.
6) Autant l’annuloplastie « préventive » lorsque l’anneau > 40mm est recommandée lors d’une chirurgie cardiaque pour une autre raison, autant la chirurgie isolée de la valve tricuspide, dans ses indications et ses résultats, reste débattue et une discussion collégiale indispensable.
RÉFÉRENCES
1. Dreyfus GD, Martin RP, Chan KM, Dulguerov F, Alexandrescu C. Functional tricuspid regurgitation: a need to revise our understanding. J Am Coll Cardiol. 2015;65(21):2331-6.
2. Bolling SF. Tricuspid regurgitation after left heart surgery: does it matter? J Am Coll Cardiol. 2014;64(24):2643-4.
3. Geske JB, Scantlebury DC, Thomas JD, Nishimura RA. Hemodynamic evaluation of severe tricuspid regurgitation. J Am Coll Cardiol. 2013;62(20):e441.
4. Topilsky Y, Khanna A, Le Tourneau T, Park S, Michelena H, Suri R, et al. Clinical context and mechanism of functional tricuspid regurgitation in patients with and without pulmonary hypertension. Circulation Cardiovascular imaging. 2012;5(3):314-23.
5. Singh JP, Evans JC, Levy D, Larson MG, Freed LA, Fuller DL, et al. Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study). Am J Cardiol. 1999;83(6):897-902.
6. De Meester P, Van De Bruaene A, Voigt JU, Herijgers P, Budts W. Outcome and determinants of prognosis in patients undergoing isolated tricuspid valve surgery: retrospective single center analysis. International journal of cardiology. 2014;175(2):333-9.
7. Yilmaz O, Suri RM, Dearani JA, Sundt TM, 3rd, Daly RC, Burkhart HM, et al. Functional tricuspid regurgitation at the time of mitral valve repair for degenerative leafl et prolapse: the case for a selective approach. The Journal of thoracic and cardiovascular surgery. 2011;142(3):608-13.
8. Wilbring M, Tugtekin SM, Ritzmann M, Arzt S, Schmidt T, Matschke K, et al. Transcatheter aortic valve implantation reduces grade of concomitant mitral and tricuspid valve regurgitation and pulmonary hypertension. European journal of cardio-thoracic surgery : offi cial journal of the European Association for Cardio-thoracic Surgery. 2014;46(5):818-24.
9. Kwak JJ, Kim YJ, Kim MK, Kim HK, Park JS, Kim KH, et al. Development of tricuspid regurgitation late after left-sided valve surgery: a single-center experience with long-term echocardiographic examinations. American heart journal. 2008;155(4):732-7.
10. Paniagua D, Aldrich HR, Lieberman EH, Lamas GA, Agatston AS. Increased prevalence of signifi cant tricuspid regurgitation in patients with transvenous pacemakers leads. The American journal of cardiology. 1998;82(9):1130-2, A9.
11. Nath J, Foster E, Heidenreich PA. Impact of tricuspid regurgitation on long-term survival. J Am Coll Cardiol. 2004;43(3):405-9.
12. Dreyfus GD, Corbi PJ, Chan KM, Bahrami T. Secondary tricuspid regurgitation or dilatation: which should be the criteria for surgical repair? The Annals of thoracic surgery. 2005;79(1):127-32.
13. Benedetto U, Melina G, Angeloni E, Refi ce S, Roscitano A, Comito C, et al. Prophylactic tricuspid annuloplasty in patients with dilated tricuspid annulus undergoing mitral valve surgery. The Journal of thoracic and cardiovascular surgery. 2012;143(3):632-8.
14. Topilsky Y, Nkomo VT, Vatury O, Michelena HI, Letourneau T, Suri RM, et al. Clinical outcome of isolated tricuspid regurgitation. JACC Cardiovascular imaging. 2014;7(12):1185-94.
15. Pettersson GB, Rodriguez LL, Blackstone EH. Severe tricuspid valve regurgitation is not an innocent fi nding to be ignored! JACC Cardiovascular imaging. 2014;7(12):1195-7.
16. O’Gara PT. Additional perspectives on the prognostic signifi cance of tricuspid regurgitation: more lessons from the study of patients with low-fl ow aortic stenosis. JACC Cardiovascular interventions. 2015;8(4):597-9.
