La plastie aortique est maintenant reconnue comme une alternative au remplacement valvulaire prothétique afin de réduire la mortalité du remplacement valvulaire prothétique qui peut atteindre 30% à 15 ans après implantation d’une bioprothèse et 26% après remplacement valvulaire mécanique chez les 45-54 ans réduisant ainsi leur espérance de vie par rapport à la population générale 1. C’est la raison pour laquelle les recommandations européennes 2017 préconisent une discussion multidisciplinaire pour sélectionner les candidats potentiels à une plastie aortique.
Elle s’adresse aux patients porteurs d’une dystrophie de l’aorte ascendante à valve souples bicuspides ou tricuspides, incluant les anévrismes et les insuffisances aortiques isolées 2 (Tableau 1).

Indications opératoires
Les indications opératoires des anévrismes de l’aorte ascendante restent basées sur le diamètre aortique maximal mesuré en diastole sur un scanner synchronisé, en coupes transverses perpendiculaires à l’axe du vaisseau. Au niveau des sinus de Valsalva, la mesure doit être de fond de sinus à fond de sinus, correspondant à la mesure grand axe bord d’attaque à bord d’attaque en échographie.
En l’absence de facteur de risque, le seuil d’intervention est de 50 mm de diamètre pour syndrome de Marfan et de 55 mm pour les formes idiopathiques et les bicuspides. En présence de facteur de risque (antécédents familiaux ou personnel de dissection ou de mort subite, IA sévère, désir de grossesse, croissance anévrysmale > 3 mm par an, coarctation) le critère opératoire est abaissé de 5 mm 2. L’hypertension artérielle n’est considérée comme un facteur de risque que dans le syndrome de Marfan et dans la bicuspidie.
Pour les insuffisances aortiques isolées, l’indication chirurgicale est liée à la présence de symptôme et/ou à une altération de la fonction ventriculaire gauche (fraction d’éjection ventriculaire gauche au repos (VG) <50 à 55 % ou diamètre télésystolique VG> 50 mm (25 mm/m2) ou diamètre télédiastolique non indexé VG >70 mm) 2.
De l’analyse échocardiographique à la plastie aortique
Le bilan échographique d’une racine aortique repose sur :
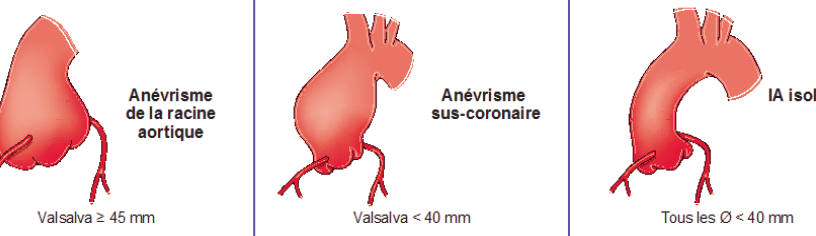
- la mesure des 4 diamètres caractéristiques de l’aorte ascendante (base de l’anneau aortique, sinus de Valsalva, jonction sino-tubulaire et aorte sus-coronaire),
- l’analyse du nombre de cuspides,
- la mesure de la coaptation valvulaire. L’anneau aortique sera considéré comme dilaté au-delà de 25 mm.
On distingue 3 phénotypes d’aorte ascendante en fonction du diamètre des sinus de Valsalva : les anévrismes de la racine aortique (sinus de Valsalva ≥45 mm), les anévrismes sus-coronaires et les insuffisances aortiques isolées (sinus de Valsalva <40 mm) (Figure 1) 3.
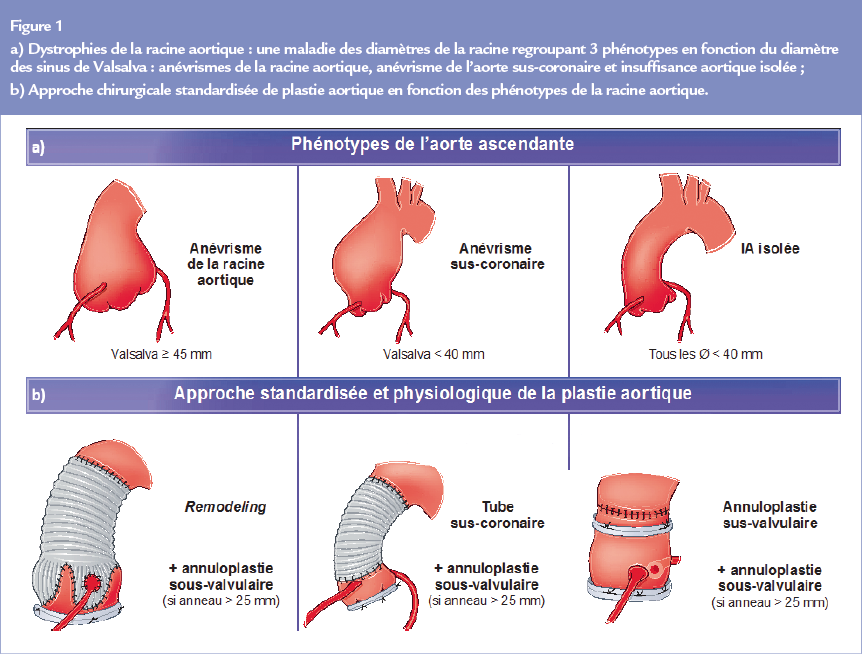
L’analyse valvulaire en petit axe précise le nombre de cuspides (par ordre de fréquence) : tricuspide, bicuspide, unicuspide, quadricuspide (Figure 2). La présence d’un raphé entre 2 cuspides est caractéristique d’une bicuspidie dont on précisera le type en fonction des cuspides fusionnées et du nombre de raphés (exemple : Bicuspidie type I coronaire droite-coronaire gauche). Le positionnement des commissures peut aider au diagnostic. En cas de valve tricuspide les 3 commissures sont à 120°, avec une ouverture des feuillets jusqu’à la commissure.
En cas de valve bicuspide, l’angulation des commissures varie entre 120 et 180° ; en regard du raphé l’ouverture des feuillets valvulaires n’atteint pas la commissure. La présence de 2 raphés signe une valve unicuspide. Le point de départ du jet peut être central, commissural ou s’étendre sur toute la coaptation. Le caractère central ou excentré d’une fuite aortique se définit en coupe grand axe. La présence d’un jet excentré signe une lésion valvulaire. En cas de prolapsus, le jet sera opposé à la cuspide prolabée.
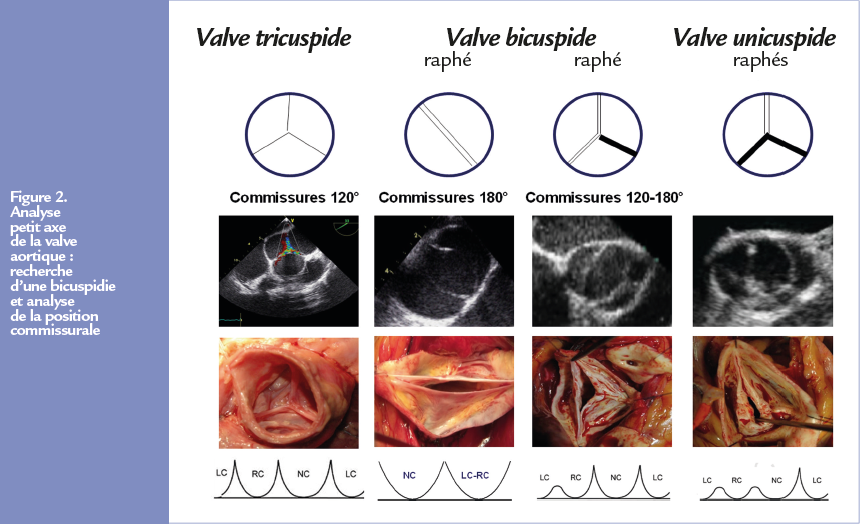
L’évaluation de la coaptation valvulaire se décompose en 2 paramètres (Figure 3) : la hauteur de coaptation (Hc : 4-5 mm) correspondant à la zone d’apposition des feuillets (normal 4-5 mm) et la hauteur effective (He 8-10 mm) correspondant à la distance entre le plan de l’anneau et le sommet de la coaptation valvulaire.
Principes de la plastie aortique
Les plasties aortiques visent à rétablir la coaptation valvulaire, en conservant ou réparant la valve native. En cas d’anévrisme de la racine aortique, le Remodeling et la Reimplantation sont les interventions de conservation valvulaire les plus fréquemment réalisées.
Le Remodeling décrit par Yacoub et coll en 1983 réalise un remplacement de la racine aortique au moyen d’un tube en Dacron festonné en trois néo-sinus, dans lesquels seront réimplantés les ostia coronaires 4. De nombreuses études in vitro et in vivo ont montré que le Remodeling procure une reconstruction physiologique de la racine avec des mouvements valvulaires proches de la normale, mais cette technique ne traite pas la dilatation de l’anneau aortique 3, 5.
À l’inverse la technique de la « Reimplantation » décrite par David et coll réalise une inclusion de la valve dans un tube en dacron, ancré en position sous-valvulaire 6. Cette procédure traite la dilatation de l’anneau aortique, mais fixe la valve dans un tube inextensible altérant la dynamique valvulaire 3, 5. De nombreuses variantes techniques ont été décrites, visant à associer la préservation de la dynamique de la racine avec le traitement de la dilatation de l’anneau aortique natif 3, 5. Il en résulte un manque de standardisation qui limite la diffusion de ces procédures.
Nous proposons une approche standardisée et physiologique de la réparation valvulaire aortique, qui associe les avantages de la technique du Remodeling à ceux de la Réimplantation, par l’association d’un remodelage de la racine aortique à une annuloplastie sous-valvulaire aortique externe afin d’augmenter la hauteur de coaptation valvulaire 3, 5, 7.
Cette approche physiologique utilise un anneau aortique prothétique expansible. A l’instar de l’annuloplastie mitrale, l’annuloplastie aortique traite la dilatation de l’anneau natif et augmente la surface de coaptation des cuspides protégeant la réparation valvulaire. Cette approche a fait l’objet d‘une évaluation multicentrique comparative étude CAVIAAR montrant une supériorité de la plastie aortique par rapport au Bentall mécanique avec une réduction de la mortalité et les événements majeurs liés à la valve à 4 ans 7-8-9.
En cas d’insuffisance aortique isolée et/ou associée à un anévrisme sus-coronaire, nous proposons d’associer une annuloplastie sous-valvulaire aortique externe à la correction des lésions valvulaires et au remplacement de l’aorte sus coronaire si nécessaire. Cette technique standardisée permet d’avoir une espérance de vie similaire à la population générale avec une absence de ré opération de 98.9% à 7 ans.
Le principe de la réparation des lésions valvulaires consiste à effectuer une ré suspension du bord libre de chaque cuspide afin d’obtenir chirurgicalement une hauteur effective supérieure à 9 mm 10.
La bicuspidie, une bonne indication de plastie
La plastie aortique des valves bicuspides donne des résultats superposables à ceux des plasties de valves aortiques tricuspides 8, 11.
Le principe de la plastie aortique dans les bicuspidies (0 raphé ou I raphé) est de transformer la valve en bicuspidie symétrique afin d’aligner la longueur du bord libre de la valve fusionnée sur celle de la valve non fusionnée en positionnant les commissures à 180°.
La réparation est systématiquement protégée par une annuloplastie sous valvulaire afin d’augmenter la surface de coaptation valvulaire.
La réparation des valves unicuspides (2 raphés), est plus complexe car elle nécessite la reconstruction d’une commissure en péricarde autologue pour une bicuspidisation symétrique.
Elle ne se justifie qu’en pédiatrie ou chez l’adulte jeune en alternative à une bio prothèse ou une intervention de Ross.
Quel substitut valvulaire en cas de valve non réparable ?
Conformément aux recommandations ce choix doit être celui du patient éclairé en fonction de sa qualité de vie, de son âge, de son risque opératoire. Au regard de la morbi mortalité à long terme du remplacement valvulaire mécanique et de la bioprothèse, l’intervention de Ross qui consiste à faire une autogreffe de la valve pulmonaire en positon aortique revient en choix de première intention chez l’adulte actif de moins de 50 ans. En effet à 20 ans elle montre une supériorité de survie (95%) par rapport à la valve mécanique (68%) 12. De plus à l’instar de la plastie aortique, l’autogreffe pulmonaire selon la procédure de Ross est le seul substitut valvulaire qui permet d’avoir une survie similaire à celle de la population générale.
Conclusion
Les plasties aortiques permettent de réduire la morbimortalité liée à la valve par rapport au remplacement valvulaire prothétique. Elles se positionnent en choix thérapeutique de première intention pour la prise en charge des insuffisances aortiques à valves souples bicuspides ou tricuspides. En cas de valve non réparable, l’intervention de Ross se justifie chez l’adulte actif de moins de 50 ans en alternative au remplacement prothétique afin d’avoir comme pour les plasties une survie à long terme similaire à la population générale. L’évaluation multicentrique rigoureuse des résultats à long terme tel qu’actuellement organisé dans le cadre du registre AVIATOR (AorticValve repair InternATiOnal Registry) de la Heart Valve Society est indispensable pour clarifier la place de chaque option technique dans la stratégie de prise en charge chirurgicale de ces patients.
Emmanuel Lansac a, Isabelle Di Centa b; Jean Luc Monin a
a Département de Pathologie Cardiaque, Institut Mutualiste Montsouris, 75014 Paris, France,
b Service de Chirurgie vasculaire, Hôpital Foch, Suresnes
Le docteur Lansac déclare avoir des liens d’intérêt avec la compagnie Coronéo.
RÉFÉRENCES
1. Goldstone AB, Chiu P, Baiocchi M, Lingala B, Patrick WL, Fischbein MP, Woo YJ. Mechanical or Biologic Prostheses for Aortic-Valve and Mitral-Valve Replacement. N Engl J Med. 2017 Nov 9;377(19):1847-1857
2. Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, Iung B, Lancellotti P, Lansac E, Munoz DR et al: 2017 ESC/EACTS Guidelines for the management of valvular heart disease: The Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur J Cardiothorac Surg 2017;52:616-664.
3. Lansac E, Di Centa I. From dynamic anatomy to aortic annuloplasty: the tale of the ring. In Yankah CA, Weng Y, Hetzer R Editors. Aortic Root Surgery: The biological Solution. Springer-Verlag, Berlin Heigdelberg. 2010: 102-132
4. Yacoub MH, Gehle P, Chandrasekaran V, et al. Late results of a valve sparing operation in patients with aneuryms of the ascending aorta and root. J Thorac Cardiovasc Surg. 1998, 115, 1080-1090
5. Lansac E, de Kerchove L. Eur J Cardiothorac Surg. 2018 Jun 1;53(6):1101-1107
6. David TE, Feindel CM. An aortic valve-sparing operation for patients with aortic incompetence and aneurysm of the ascending aorta. J Thorac Cardiovasc Surg. 1992, 103, 617-622
7. Lansac E, Di Centa I, Sleilaty G, et al. An aortic ring: from a physiological reconstruction of the root to a standardized approach of aortic valve repair. J Thorac Cardiovasc Surg 2010; 140: S28-S35
8. Lansac E, Di Centa I, Sleilaty G, Lejeune S, Khelil N, Berrebi A, Diakov C, Mankoubi L, Malergue MC, Noghin M et al: Long-term results of external aortic ring annuloplasty for aortic valve repair. Eur J Cardiothorac Surg 2016, 50(2):350-360.
9. Lansac E, Bouchot O, Arnaud Crozat E, Hacini R, Doguet F, Demaria R, Leguerrier A, Jouan J, Chatel D, Lopez S, Folliguet T, Acar C, Leprince P, Langanay T, Jegaden O, Bessou JP, Albat B, Latremouille C, Fabiani JN, Fayad G, Fleury JP, Pasquet B, Debauchez M, Di Centa I, Tubach F. Standardized approach to valve repair using an expansible aortic ring versus mechanical Bentall: early outcomes of the CAVIAAR multicentric prospective cohort study. J Thorac Cardiovasc Surg. 2015 Feb;149(2 Suppl):S37-45.
10. Bierbach BO, Aicher D, Issa OA, Bomberg H, Gräber S, Glombitza P, et al. Aortic root and cusp confi guration determine aortic valve function. Eur J Cardiothorac Surg. 2010; 38:400-6.
11. Lansac E, Di Centa I, Sleilaty G, Lejeune S, Berrebi A, Zacek P, Debauchez M. Remodeling root repair with an external aortic ring annuloplasty. J Thorac Cardiovasc Surg. 2017 May;153(5):1033-1042.
12. Buratto E, Shi WY, Wynne R, Poh CL, Larobina M, O’Keefe M, Goldblatt J, Tatoulis J, Skillington PD. Improved Survival After the Ross Procedure Compared With Mechanical Aortic Valve Replacement. J Am Coll Cardiol. 2018;71(12):1337-1344
