
La fibrillation atriale (FA), décrite pour la 1ère fois chez l’homme en 1906, est l’arythmie la plus fréquente en pratique clinique et constitue une cause majeure de morbidité et de mortalité. Le 1er tracé de FA est publié par Willem Einthoven, l’inventeur de l’électrocardiogramme (ECG), la même année.1 Une fois les risques de la FA bien établis,2 prévenir ses complications grâce à un diagnostic précoce a toujours représenté un challenge pour le cardiologue, et de nombreuses innovations actuelles et à venir dans le domaine de l’ECG sont en passe de rendre ce dépistage beaucoup plus aisé.
En effet, la gravité de la FA est liée au risque thromboembolique et d’insuffisance cardiaque. L’enjeu principal de sa prise en charge est de prévenir la survenue de ces accidents, notamment les accidents vasculaires cérébraux (AVC) ischémiques. La FA est la première cause d’AVC cardio-embolique, et les AVC liés à une FA sont le plus souvent sévères, en termes de mortalité et de séquelles fonctionnelles. Les facteurs de risque thromboembolique sont bien identifiés. Ce risque varie de 1 à plus de 10% par patient/année.2 Il est comparable, que la FA soit paroxystique ou permanente. Il est donc primordial de dépister la FA chez les patients asymptomatiques, notamment chez ceux à haut risque. Le diagnostic de FA est donc un enjeu thérapeutique majeur.
Simple dans les formes permanentes, il est beaucoup plus difficile dans les formes paroxystiques. La FA paroxystique échappe en effet aux ECG de routine et la répétition des Holter ECG est peu contributive. D’autres méthodes sont proposées : monitoring ECG continu, ECG trans-téléphonique, enregistreurs ECG à mémoire boucle, Holter ECG prolongé… Les modalités de diagnostic restent débattues, mais des données récentes suggèrent fortement que l’enregistrement continu et prolongé de l’ECG augmente significativement le taux de détection de la FA.3-5 Ces dernières années, des nouvelles technologies vouées au diagnostic des arythmies ont vu le jour. Cet article passe en revue les outils disponibles et analyse leur utilité pour le diagnostic de la FA dans le cadre de la pratique clinique quotidienne.
Diagnostic de la fibrillation atriale
Selon les recommandations de la société européenne de cardiologie (ESC),6 la FA est défi nie comme une arythmie cardiaque présentant les caractéristiques suivantes :
- l’ECG de surface montre une irrégularité «absolue» des intervalles RR (les intervalles RR ne doivent pas se répéter selon un cycle identifiable) ;
- l’absence d’onde P individualisable sur l’ECG de surface ;
- la durée du cycle atrial (intervalle entre deux activations atriales), s’il est visible, est variable et inférieur à 200 ms (> 300 bpm).
Étape 1 : savoir y penser
- devant des symptômes qui amènent le patient à consulter : (palpitations, dyspnée, malaise, fatigue, etc…) ;
- devant des signes cliniques évocateurs de FA à l’auscultation qui doit être systématique chez les sujets de plus de 65 ans : battements cardiaques irréguliers et souvent rapides ;
- lors de la réalisation d’un ECG pour un autre motif ou à l’examen de l’enregistrement du rythme cardiaque par un Holter ECG ; ou bien en interrogeant les mémoires d’un pacemaker, d’un défibrillateur ou de tout autre dispositif implanté ;
- devant une complication : épisode thromboembolique (AVC/AIT, embolie artérielle), poussée d’insuffisance cardiaque…
Étape 2 : affirmer le diagnostic par un ECG 12 dérivations
Si des battements cardiaques irréguliers peuvent être évocateurs d’une FA, le diagnostic de certitude doit toujours être confirmé par un ECG qui est l’examen clé. 6
L’ECG permet également dans certains cas d’orienter vers certaines causes. Attention aux logiciels d’interprétation automatisée qui peuvent méconnaître ce diagnostic dans près de 20% des cas.7 L’utilisation d’adénosine triphosphate peut se révéler nécessaire dans les rares cas litigieux.
Méthodes de dépistage de la fibrillation atriale
Au quotidien dépister une FA paroxystique reste un défi, et il est très souvent nécessaire de recourir à un enregistrement plus ou moins prolongé de l’ECG pour l’objectiver. L’émergence de dispositifs de monitoring cardiaque continu, de ce point de vue, constitue une avancée importante.
Le présent : efficacité des durées d’enregistrement prolongées !
ECG 12 dérivations
Bien qu’une méta-analyse ait montré que le dépistage systématique par ECG chez des patients ≥ à 65 ans augmentait les nouveaux cas de FA détectés, suggérant qu’un ECG systématique comparé à celui prescrit selon les symptômes pourrait contribuer à la prévention des AVC, ce mode de dépistage est loin d’être le plus performant en population générale.8 En effet l’incidence globale de FA méconnue était de 1% dans cette méta-analyse, et de 1,4% chez les patients ≥ 65 ans. Une étude multicentrique randomisée sur 14802 volontaires a montré qu’un dépistage systématique par le biais d’un courrier envoyé à toutes les personnes ≥ 65 ans, leur demandant de réaliser un ECG, et par la sensibilisation des médecins généralistes à la réalisation d’un ECG systématique chez toute personne avec pouls irrégulier permettait de dépister un nombre plus important de FA qu’un suivi habituel (1,63% vs 1,04%).7 L’étude SAFE a en plus démontré que ce type de dépistage au-delà de 65 ans était pertinent sur le plan médicoéconomique. 9,10 Un ECG est donc recommandé chez toute personne de plus de 65 ans avec pouls irrégulier à l’examen afin de détecter les FA silencieuses (niveau d’évidence IB).6
Méthodes d’enregistrement continu
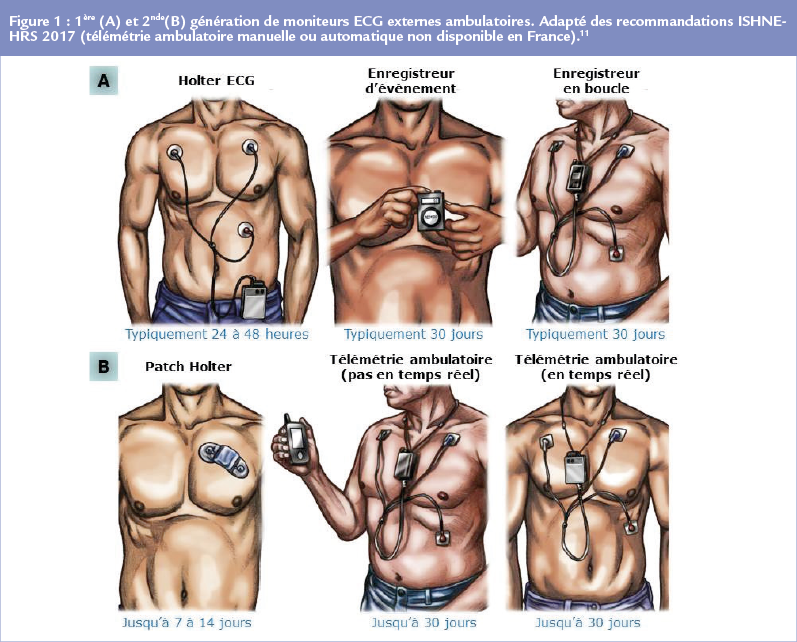
Un enregistrement prolongé de type Holter ECG de 24 ou 48 heures, voire plus, est indiqué pour des épisodes paroxystiques (Figure 1).11 Cependant, tolérance et compliance sont les principales limites des durées d’enregistrement très prolongées.
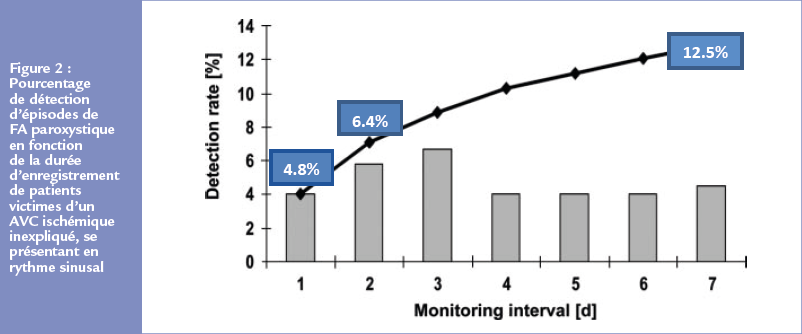
L’étude Find-AF3 a été l’une des premières à montrer que la probabilité de détecter un épisode de FA paroxystique après un AVC était proportionnellement corrélée à la durée d’enregistrement (Figure 2). Ces résultats ont été confirmés par ceux de l’étude EMBACE.4
Il est actuellement bien établi que la multiplication des moyens de surveillance et d’enregistrement (externes ou internes) contribue à l’augmentation de l’incidence de la FA (Figure 3).12 De fait, en plus des FA révélées par des symptômes cliniques ou des complications notamment thromboemboliques, la FA peut-être diagnostiquée fortuitement, par un ECG systématique, sur un scope, un Holter ECG, ou encore le biais des mémoires de dispositifs implantés (pacemakers, défibrillateurs, moniteurs ECG sous-cunatés).
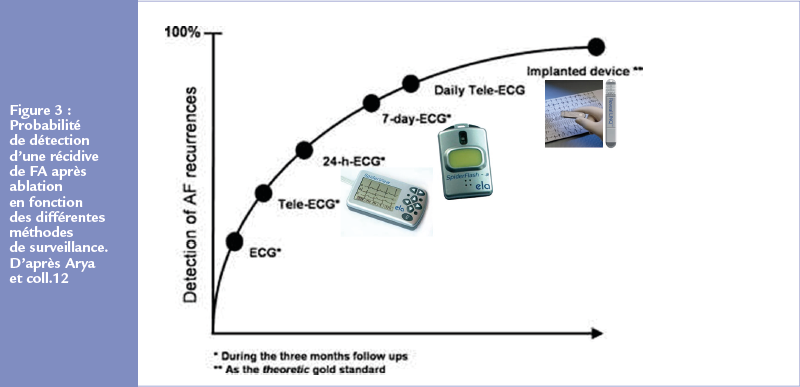
Plus la durée d’enregistrement est prolongée, plus grande seront les chances de “capturer” une FA paroxystique et/ ou infra-clinique.
Surveillance (monitoring) continue
Dans le cas d’un monitoring continu (scope), la FA est défi nie selon les critères de l’ESC mais sa durée doit être d’au moins 30 secondes.6 En dessous de cette valeur, on parlera de salve supraventriculaire ou de FA non soutenue. L’absence de symptôme clinique fera porter le diagnostic de FA silencieuse. La bonne maîtrise des logiciels d’analyse des centrales de monitorage est une limite à leur utilisation par des non cardiologues : en effet, les critères diagnostiques pour émettre une alarme sonore et/ou stocker une arythmie peuvent varier selon les fabricants. De plus de brefs épisodes de FA silencieuse peuvent ne pas être diagnostiqués, soit par défaut de relecture des alarmes journalières, soit par manque de sensibilité du logiciel.
Dans une étude en réanimation médicale chez des patients en choc septique, pourtant télémétrés en continu, 34% des FA dépistées par un Holter concomitant n’avaient pas été dépistées par les cliniciens.13
Holters externes et enregistreurs externes en boucle
De la même manière que pour le monitoring continu, les recommandations européennes définissent le critère de durée de FA à plus de 30 secondes. Un grand nombre de dispositifs sont commercialisés. Aux côtés du classique Holter de 24-48 heures, dont les performances dans le dépistage de la FA sont limitées par sa durée,3,4 d’autres enregistreurs externes de plus longue durée sont disponibles (Figure 1).
On distingue les Holters de longue durée qui vont enregistrer le rythme cardiaque sur une période allant de 48 heures à 30 jours, avec une bande passante analysée en permanence et le stockage des épisodes d’intérêt prédéfinis dans la mémoire de l’appareil (par exemple, brady ou tachycardie, FA), et les déclencheurs d’événements qui seront uniquement activés manuellement par le patient, que ce soit de manière systématique ou en cas de symptômes.
Holters implantables
Face aux limites des enregistreurs externes, ont été mis sur le marché depuis une vingtaine d’année des moniteurs ECG implantables sous-cutanés qui se présentent sous la forme d’un boîtier de la taille d’une clé USB. Du fait de leur miniaturisation, les nouvelles générations sont plus facile à implanter, sous anesthésie locale, habituellement en parasternal gauche en regard du coeur. À la différence des pacemakers et défibrillateurs, ils enregistrent bien un ECG sous-cutané et non des électrogrammes locaux. Ils peuvent être soumis aux mêmes contraintes techniques que les Holters ECG classiques en termes de qualité du recueil et d’analyse du signal, notamment du fait de la présence de parasites internes (mouvements, myopotentiels…) ou externes au patient (champs électromagnétiques). Les algorithmes de détection de la FA sur ces dispositifs sont désormais très performants, limitant ainsi les faux-positifs.14 Du fait de leur algorithmie, il n’est cependant pas possible, à l’heure actuelle, de dépister une FA de moins de deux minutes, qui est donc le seuil minimal pour lequel l’appareil classifiera un événement rythmique en FA. Les points forts de ces Holters sont leur longévité (3 ans) et la possibilité d’une interrogation à distance par un boîtier de télécardiologie.
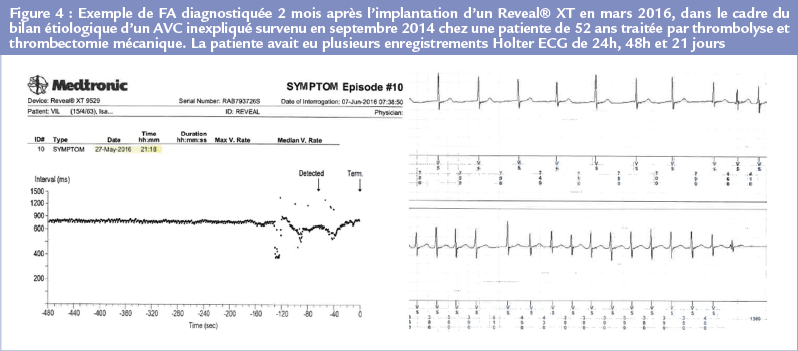
Jusqu’à récemment réservé au seul bilan des syncopes récidivantes inexpliquées, leurs indications se sont élargies au bilan étiologique des AVC cryptogéniques (classe IIaB),6 depuis la publication des résultats de l’étude CRYSTAL AF.5 Ils sont dorénavant remboursés en France dans cette indication (Figure 4)
Pacemakers/défibrillateurs
Des épisodes atriaux rapides (atrial high rate episodes [AHRE]) sont détectés dans les mémoires des pacemakers et défibrillateurs d’au moins un tiers des patients appareillés, voire jusqu’à 88,5% en cas d’antécédent d’arythmie atriale.15 Sur un appareil simple chambre, établir un diagnostic précis n’est toujours pas facile. À l’inverse les appareils double chambre permettent un recueil direct du signal atrial, et ont ainsi une bien meilleure sensibilité (proche de 100%) et spécificité qu’un Holter de 24h (1,3%) ou même de 30 jours (22,8%) pour le dépistage de la FA.16
Ces épisodes atriaux rapides ne correspondent cependant pas tous à de la FA (farfield ventriculaire, bruit atrial…). En cas de doute, il est donc indispensable de confirmer le diagnostic de FA par un ECG.6 La 1ère étude à avoir démontré une corrélation entre ces épisodes atriaux rapides et la survenue d’AVC est l’étude MOST (RR 2.79 ; IC 95% [1.51 – 5.15], p = 0.0011).17 Ces résultats ont été confirmés par ceux de l’étude ASSERT (RR 2.50, p = 0.008).18 Toutefois, le lien temporel entre FA et AVC n’est pas démontré,19 et l’intérêt d’un traitement anticoagulant guidé par les alertes de télécardiologie n’est pas prouvé.20
Le futur immédiat : vers un e-dépistage ?
L’essor de l’internet et des nouvelles technologies
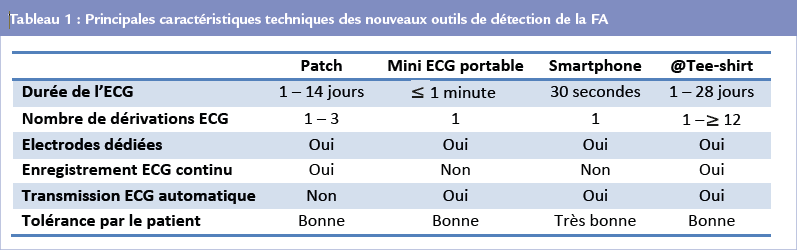
numériques rend désormais accessible à tout un chacun la possibilité de surveiller soi-même différents paramètres de sa santé (« quantify yourself »), et notamment le rythme cardiaque. Le dépistage de masse de la FA silencieuse par les nouvelles technologies, dans cette optique, est une voie de développement majeure de la santé connectée.21,22 De nombreuses solutions d’enregistrement de l’ECG (une ou plusieurs dérivations) sont disponibles sur le marché, dont certaines ont démontré scientifiquement leur fiabilité et sont recommandées pour la détection des arythmies cardiaques (Tableau 1).11,22
Patchs Holters-ECG
La 1ère grande catégorie de nouveaux outils proposés pour le dépistage de la FA concerne des patchs cutanés capables d’effectuer des enregistrements du rythme cardiaque en continu sur une durée de 7 voire 14 jours. C’est une nouvelle classe d’enregistreurs Holter, le boîtier enregistreur étant clipsé sur l’électrode patch ou directement intégré dans l’électrode patch (et alors à usage unique). Ils sont résistants à l’eau. On les colle en règle générale sur la partie supérieure du torse (Figure 1), et leur principal atout est leur grande simplicité d’utilisation et leur bonne tolérance. En revanche, plusieurs problèmes se posent quant à l’accessibilité aux données (via le fabricant), le coût et le délai entre la dépose et l’analyse (faite par le fabricant). D’autre part, la faible distance inter-électrode peut induire une amplitude de tracé ECG plus ou moins microvoltée. Leur intérêt pour la détection de la FA a été démontré dans plusieurs études.23,24
Moniteur ECG monocanal portable sans fil
Simple et pratique, cet ECG de poche permet d’enregistrer, de stoker et de transférer 30 secondes de tracé ECG et fournit, lorsque cela est possible un message de fréquence cardiaque moyenne après la mesure ECG. Il s’agit d’une catégorie d’enregistreurs discontinus qui peuvent être utilisés au moment d’un symptôme (enregistreur post-événement) ou à la discrétion du patient (routine ECG). Différents modes d’enregistrement sont proposés, digitale (Figure 5), thoracique ou par câble ECG.

Ces ECG de poche ont, contrairement aux patchs enregistreurs, la capacité de transmettre quasiment en temps réel l’ECG au centre de surveillance ou au cardiologue. Le dépistage à large échelle de la FA en milieu gériatrique a été réalisé avec succès par ce type de dispositif. 25, 26
Smartphones
Ils appartiennent à la même catégorie d’enregistreurs ECG que les ECG de poche. Dans cette version, l’ECG est embarqué dans un smartphone et enregistré entre les doigts des deux mains à l’aide d’une électrode métallique clipsée sur le téléphone (figure 6). De tous les nouveaux outils d’enregistrement de l’ECG, le smartphone est sans doute celui qui a l’objet de la plus large évaluation clinique. 24, 30-37
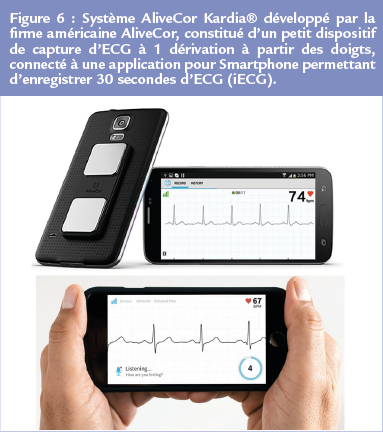
Dans l’étude SEARCH-AF 21 l’utilisation d’un smartphone a montré une incidence de FA nouvellement détectée de 1,5% semblable à celle rapportée avec l’ECG de routine, et d’excellentes sensibilité et spécificité (Tableau 2). Le rapport coût-efficacité était plus favorable. Des résultats similaires ont été rapportés dans une autre étude de dépistage de 13 122 volontaires.27 L’ECG-smartphone est apparu globalement fiable puisque seuls 0,4% des tracés ont été jugés ininterprétables. Une FA méconnue a pu être diagnostiquée chez 101 (0,8%) des personnes dépistées, asymptomatique dans deux tiers des cas. Leur score de CHA2DS2-VASc était de 3.1, soulignant ainsi l’intérêt d’un ciblage plus précis de la population à risque.

Plus intéressant, l’essai randominé REHEARSE-AF a ciblé les personnes ≥ 65 ans, présentant au moins 1 facteur de risque d’AVC et pas de FA connue.28 1.001 participants ont été randomisés pendant 1 an entre la réalisation 2 fois par semaine d’un ECG ambulatoire via le système AliveCor, et le suivi de routine. Sur la période d’étude, 19 patients dans le groupe ECG par smartphone ont eu un diagnostic de FA contre 5 dans le groupe assigné au suivi de routine. Les chances de dépister une FA étaient 4 fois plus élevées dans le premier groupe. Le suivi par ECG-smartphone après ablation de FA suscite beaucoup d’espoir,29 et une étude est en cours dans le bilan des AVC cryptogéniques.30
Pour s’affranchir des électrodes, une solution purement logicielle a été proposée : utiliser la grande sensibilité de l’accéléromètre et le gyroscope du smartphone pour capter les battements cardiaques lorsque le téléphone est placé à plat sur la poitrine. Le traitement de ces battements par le logiciel permet ensuite de diagnostiquer une FA avec une sensibilité et une spécificité de l’ordre de 95%.31 Une autre approche par l’utilisation de l’appareil photo et la lumière LED du smartphone a également été proposée.32,33 Le doigt posé sur l’objectif photo et en téléchargeant une application dédiée, il est possible d’obtenir des chiffres et une courbe animée à partir des formes d’ondes acquises (Figure 7). L’appareil photo capture la lumière réfléchie qui change en fonction des pulsations sanguines, et le signal est affiché sous forme d’un « pseudo ECG », équivalent à la photopléthysmographie digitale. Attention il ne s’agit que d’indications du passage du sang au niveau alors qu’aucun signal électrique n’est enregistré. Cela ne reflète donc pas l’activité électrique propre du coeur. Malgré tout, une étude comparant cette solution à la coque ECG démontre des performances diagnostiques équivalentes.34

Webcams
En filmant le visage d’un individu, un cap supplémentaire vient d’être franchi par les chercheurs de la Rochester’s School of Medicine : grâce à la grande résolution des webcams, avec un logiciel dédié, il leur a été possible de déterminer les battements cardiaques en analysant les subtiles variations de coloration cutanée faciale.35 En effet, l’hémoglobine « absorbant » plus dans le spectre de la lumière verte, la variation de cette couleur est indicative de la quantité de sang qui circule dans les veines du visage à chaque battement cardiaque. Il ne s’agit pour l’instant que d’un concept, mais le champ de développement potentiel de cette technologie est immense au vu de l’omniprésence des caméras sur les ordinateurs mais également en voiture, au travail ou dans les transports publics.
Vêtements connectés
Dernier-né des dispositifs connectés proposés pour la surveillance en continue du rythme cardiaque durant plusieurs semaines, le tee-shirt connecté dont plusieurs prototypes sont actuellement en cours d’évaluation, en particulier le CardioSkin® développé par la start-up Bioserenity en partenariat avec les laboratoires Servier, et le CardioNexion® par la startup française @-Health (Figure 8).
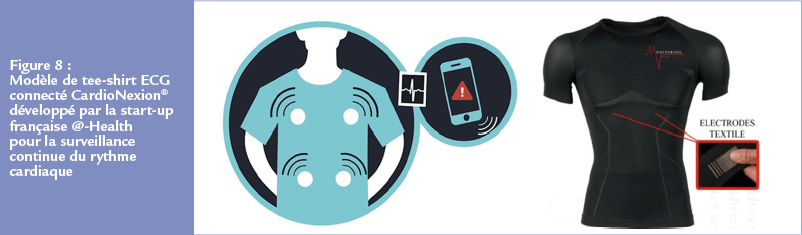
Des électrodes sont clipsées ou directement tissées sur unmentaire (Wearable Device) communique les ECG en bluetooth à un smartphone. Celui-ci sert de modem et transmet les ECG à un centre de surveillance. Grâce à une application mobile associée, le patient peut renseigner les symptômes associés. La durée de surveillance potentielle est illimitée. Les résultats préliminaires dans le bilan des AVC cryptogéniques sont très prometteurs.36
Conclusion
Le dépistage de la FA pour prévenir ses complications notamment thromboemboliques reste un véritable enjeu. Plusieurs études ont démontré que quel que soit l’outil utilisé, la rentabilité diagnostique est fonction de la durée d’enregistrement et de ce point de vue les dispositifs implantables sont aujourd’hui la référence. Grâce au développement de nouveaux outils diagnostiques validés scientifiquement et faciles d’accès, une amélioration très significative de la détection de la FA silencieuse se profile, dans l’optique d’une meilleure prise en charge thérapeutique.
Le rapport coût–efficacité du dépistage de masse, l’hétérogénéité des populations concernées par la FA silencieuse et les considérations légales restent encore une limite importante.
Claude Kouakam
Clinique de Cardiologie – Institut Coeur Poumon, CHRU Lille
L’auteur déclare ne pas avoir de lien d’intérêt avec le sujet traité.
RÉFÉRENCES
1. Einthoven W. Le télécardiogramme. Arch Int Physiol 1906; 4: 132-64
2. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994; 154: 2254
3. Stahrenberg R, Weber-Krüger M, Seegers J et al. Enhanced detection of paroxysmal atrial fibrillation by early and prolonged continuous Holter monitoring in patients with cerebral ischemia presenting in sinus rhythm. Stroke 2010; 41: 2884-8
4. Gladstone DJ, Spring M, Dorian P et al; EMBRACE Investigators and Coordinators. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370: 2467-77
5. Sanna T, Diener HC, Passman RS et al; CRYSTAL AF Investigators. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370: 2478-86
6. Kirchhoff P, Benussi S, Kotecha D et al. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC endorsed by the European Stroke Organization (ESO). Eur Heart J 2016; 37: 2893-2962
7. Fitzmaurice DA, Hobbs FD, Jowett S et al. Screening versus routine practice in detection of atrial fibrillation in patients aged 65 or over: cluster randomized controlled trial. BMJ 2007; 335: 383
8. Lowres N, Neubeck L, Redfern J, Freedman SB. Screening to identify unknown atrial fibrillation. A systematic review. Thromb Haemost 2013; 110: 213-22
9- Hobbs FD, Fitzmaurice DA, Mant J et al. A randomized controlled trial and cost-effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study. Health Technol Assess 2005; 9: [iii-iv, ix-x, 1-74]
10. Mant J, Fitzmaurice DA, Hobbs FDR et al. Accuracy of diagnosing atrial fibrillation on electrocardiogram by primary care practitioners and interpretative diagnostic software: analysis of data from screening for atrial fibrillation in the elderly (SAFE) trial. BMJ 2007; 335: 380-2
11. Steinberg JS, Varma N, Cygankiewicz I et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm 2017; 14: e55-e96
12. Arya A, Piorkowski C, Sommer P, Kottkamp H, Hindricks G. Clinical implication of various follow up strategies after catheter ablation of atrial fibrillation. Pacing Clin Electrophysiol 2007; 30: 458-62
13. Guenancia C, Binquet C, Laurent G et al. Incidence and predictors of new-onset atrial fibrillation in septic shock patients in a medical ICU: Data from 7-day Holter ECG monitoring. PLoS ONE 2015; 10: e0127168
14. Hindricks G, Pokushalov E, Urban L et al. Performance of a new leadless implantable cardiac monitor in detecting and quantifying atrial fibrillation: results of the XPECT trial. Circ Arrhythm Electrophysiol 2010; 3 : 141-7
15. Orlov MV, Ghali JK, Araghi-Niknam M et al. Asymptomatic atrial fibrillation in pacemaker recipients: incidence, progression, and determinants based on the atrial high rate trial. Pacing Clin Electrophysiol 2007; 30: 404-11
16. Boriani G, Glotzer TV, Santini M et al. Device-detected atrial fibrillation and risk for stroke: an analysis of > 10,000 patients from the SOS AF project (Stroke preventiOn Strategies based on Atrial Fibrillation information from implanted devices). Eur Heart J 2014; 35: 508-16
17. Glotzer TV, Hellkamp AS, Zimmerman J et al. Atrial high rate episodes detected by pacemaker diagnostics predict death and stroke: report of the Atrial Diagnostics Ancillary Study of the MOde Selection Trial (MOST). Circulation 2003; 107: 1614-9
18. Healey JS, Connolly SJ, Gold MR et al; ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012; 366: 120-9
19. Brambatti M, Connolly SJ, Gold MR et al. Temporal relationship between subclinical atrial fibrillation and embolic events Circulation 2014; 129: 2094-9
20. Martin DT, Bersohn MM, Waldo AL et al; IMPACT Investigators. Randomized trial of atrial arrhythmia monitoring to guide anticoagulation in patients with implanted defibrillator and cardiac resynchronization devices. Eur Heart J 2015; 36:1660-8
21. Lowres N, Neubeck L, Salkeld G et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014; 111: 1167-76
22. Freedman B, Camm J, Calkins H et al. Screening for atrial fibrillation: a report of the AF-SCREEN International Collaboration. Circulation 2017; 135: 1851-67
23. Turakhia MP, Hoang DD, Zimetbaum P, et al. Diagnostic utility of a novel leadless arrhythmia monitoring device. Am J Cardiol 2013; 112: 520-4
24.Turakhia MP, Ullal AJ, Hoang DD et al. Feasibility of extended ambulatory electrocardiogram monitoring to identify silent atrial fibrillation in high-risk patients: the Screening Study for Undiagnosed Atrial Fibrillation (STUDY-AF) Clin Cardiol
2015; 38: 285-92
25. Kaasenbrood F, Hollander M, Rutten FH, Gerhards LJ, Hoes AW, Tieleman RG. Yield of screening for atrial fibrillation in primary care with a hand-held, single-lead electrocardiogram device during influenza vaccination. Europace 2016; 18: 1514-20
26. Desteghe L, Raymaekers Z, Lutin M et al. Performance of handheld electrocardiogram devices to detect atrial fibrillation in a cardiology and geriatric ward setting. Europace 2017; 19: 29-39
27. Chan NY, Choy CC. Screening for atrial fibrillation in 13 122 Hong Kong citizens with smartphone electrocardiogram. Heart 2017; 103: 24-31
28- Halcox JPJ, Wareham K, Cardew A et al. Assessment of Remote Heart Rhythm Sampling Using the AliveCor Monitor to Screen for Atrial Fibrillation: The REHEARSE-AF Study. Circulation 2017; 136: 1784-94
29- Tarakji KG, Wazni OM, Callahan T et al. Using a novel wireless system for monitoring patients after the atrial fibrillation ablation procedure: the iTransmit study. Heart Rhythm 2015; 12: 554-9
30. Treskes RW, Gielen W, Wermer MJ et al. Mobile phones in cryptogenic strOke patients Bringing single lead ECGs for Atrial Fibrillation detection (MOBILE-AF): study protocol for a randomized controlled trial. Trials 2017; 18: 402. doi: 10.1186/s13063-017-2131-0
31. Lahdenoja O, Hurnanen T, Iftikhar Z et al. Atrial fibrillation detection via accelerometer and gyroscope of a smartphone. IEEE J Biomed Health Inform 2017; 10.1109/JBHI.2017.2688473 [Epub ahead of print]
32. McManus DD, Chong JW, Soni A et al. PULSE-SMART: Pulse-Based Arrhythmia Discrimination Using a Novel Smartphone Application. J Cardiovasc Electrophysiol 2016; 27: 51-7
33. Krivoshei L, Weber S, Burkard T et al. Smart detection of atrial fibrillation. Europace 2017; 19: 753-7
34. Chan PH, Wong CK, Poh YC et al. Diagnostic performance of a smartphone-based photoplethysmographic application for atrial fibrillation screening in a primary care setting J Am Heart Assoc 2016; 5:e0028 doi: 10.161/
35. Couderc JP, Kyal S, Mestha LK et al. Detection of atrial fibrillation using contactless facial video monitoring. Heart Rhythm 2015; 12: 195-201
36. Pagola J, Juega J, Francisco-Pascual J et al; CryptoAF investigators. Yield of atrial fibrillation detection with Textile Wearable Holter from the acute phase of stroke: Pilot study of Crypto-AF registry. Int J Cardiol 2018; 251: 45-50
