L’insuffisance cardiaque reste un problème de santé publique majeur, avec une prévalence estimée à 1-2% dans la population adulte des pays développés augmentant à 10% à partir de 70 ans 1. En 10 ans, cette prévalence a augmenté de 30%. Dans un système de santé observé et critiqué, l’enjeu n’en est pas moins économique puisque le coût annuel des hospitalisations représente 63 % des dépenses de santé remboursées pour les patients en affection de longue durée (ALD) pour insuffisance cardiaque, soit plus d’un milliard d’euros 2,3.
La dysfonction biventriculaire sévère, bien qu’elle ne concerne qu’un petit nombre de patients insuffisants cardiaques, est un challenge thérapeutique majeur de par son pronostic effroyable.
Introduction
En cas de dysfonction biventriculaire sévère et irréversible, le traitement de référence reste, à ce jour, la transplantation cardiaque. Cependant, les critères d’éligibilité à la greffe (sélection des candidats) et la pénurie de greffons rendent cette thérapeutique d’exception non accessible à tous. De plus, la transplantation cardiaque impose de fait des délais d’attente possibles qui ne sont pas toujours compatibles avec l’état de santé précaire de certains candidats potentiels.
L’intérêt d’une assistance biventriculaire de longue durée prend alors tout son sens, qu’il s’agisse d’attendre quelques semaines, mois, parfois années un greffon (en attente de transplantation) ou en alternative à la transplantation (implantation définitive ou « destination therapy » des anglo-saxons).
Référence actuelle en matière d’assistance mécanique biventriculaire
Actuellement, seuls deux dispositifs à énergie pneumatique sont commercialisés et remboursés en France. Ils sont utilisables en pratique clinique uniquement chez des patients candidats à la greffe.
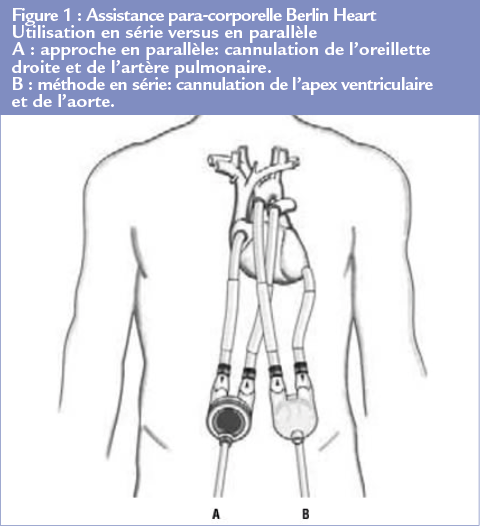
Le système d’assistance para-corporel Berlin Heart (Figure 1)
Il associe un LVAD et un RVAD. Cette assistance biventriculaire laisse donc en place le coeur natif défaillant et est constituée de 2 ventricules pulsatiles externes, posés sur l’abdomen du patient. Il est particulièrement apprécié pour les enfants, adolescents et adultes de petits gabarits grâce à un panel de ventricules externes de tailles différentes. Il reste cependant soumis à un risque de complications (infectieux, thrombo-embolique) majeur et la complexité de l’installation autorise rarement le retour à domicile (ergonomie limitée, bruit). Sa situation extra corporelle a néanmoins l’avantage d’éviter une réintervention en cas de complication sur les ventricules qui sont accessibles pour être remplacés. De plus, en cas d’arrêt de pompe, le patient ne décède pas instantanément, son coeur natif étant en place. Par contre, on laisse en place des cavités souvent dilatées et qui peuvent être siège de thrombose.
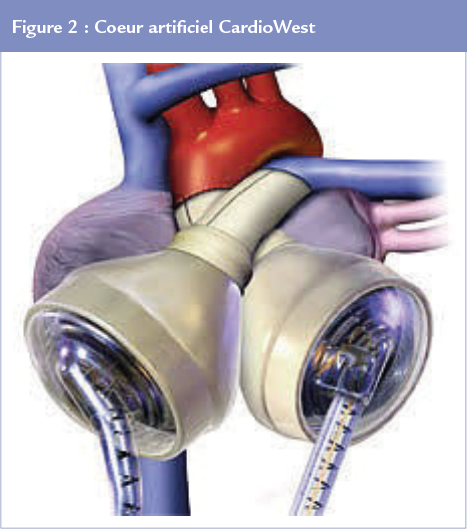
Le coeur artificiel total intra thoracique CardioWest (SynCardia, Tucson, Arizona, USA) (Figure 2)
Il existe depuis plus de 35 ans et a été implanté chez plusieurs centaines de patients dans le monde. Il est composé de 2 ventricules pneumatiques en polyuréthane de 70 mL, avec 4 valves mécaniques, implantés en position orthotopique et remplaçant le coeur natif. Le massif ventriculaire est emporté, ce qui peut notamment être utile en cas de thrombose du massif cardiaque ou de communication interventriculaire (assistance type Berlin Heart contre-indiquée). Ce dispositif pulsatile est relié à une console externe avec des lignes d’activation pneumatiques tunnelisées et passant au travers de la peau en regard de l’abdomen. Il peut atteindre un débit cardiaque supérieur à 9 L/min.
Copeland et al ont démontré son efficacité sur la survie à la transplantation ainsi qu’au long cours 4,5, rapportant en 2012, sur une cohorte de 101 patients implantés d’un Cardiowest, 68,3 % d’accès à la transplantation. La survie après la transplantation à 1, 5 et 10 ans était respectivement de 76,8%, 60,5% et 41,2%.
L’encombrement du dispositif dans le thorax et le bruit généré par le système restent des écueils importants pour cette machine. Un dispositif avec des ventricules de 50 mL existe depuis 2013 pour des patients de petit gabarit mais il n’est pas remboursé actuellement en France. Les complications infectieuses restent relativement fréquentes de même que les complications thrombotiques imposant un traitement anticoagulant, lui-même parfois responsable d’accidents hémorragiques. Copeland et al rapportent en 20125, sur une série de 101 patients implantés d’un Cardiowest, 8 AVC d’origine embolique (soit 7,9 %) et 43 événements hémorragiques (soit 42,5 %) dont 25 nécessitant une réintervention.
Dispositifs d’assistance ventriculaire gauche de longue durée (LVAD) implantés en position biventriculaire
Si les dispositifs d’assistance monoventriculaire gauche de longue durée (LVAD) sont aujourd’hui largement reconnus pour améliorer la survie, le statut fonctionnel, ainsi que la qualité de vie 6 en attente de transplantation ou en « destination therapy », il n’existe dans la littérature aucun dispositif d’assistance au long cours dédié au ventricule droit.
Les recommandations ESC de 2016 sur l’insuffisance cardiaque émettent une recommandation de classe IIa niveau C pour l’implantation d’un LVAD en attente de transplantation et classe IIa niveau B pour l’implantation d’un LVAD en « destination therapy, en cas de contre-indication à la transplantation 1. Il n’existe à ce jour aucune recommandation pour l’assistance ventriculaire droite au long cours.
Le ventricule droit présente en effet plusieurs contraintes limitantes 7
- Anatomique : Le ventricule droit est une structure tridimensionnelle complexe de forme triangulaire en coupe sagittale et en forme de croissant en coupe transversale. Le ventricule gauche est lui de forme circulaire en coupe sagittale et conique en coupe transversale. La quantité de trabéculations est beaucoup plus importante à droite qu’à gauche.
- Physiologique : Surtout, les régimes de pression ne sont pas les mêmes (basse pression des cavités droites) avec un ventricule droit peu musclé, fin, épais de quelques millimètres seulement.
Tous ces éléments vont avoir un impact sur le positionnement de la canule d’admission de l’assistance ventriculaire, davantage exposée à un risque de succion de paroi à l’aspiration que pour le côté gauche. De plus, l’assistance ventriculaire droite doit, idéalement, pouvoir maintenir dans l’artère pulmonaire un débit sanguin avec des pressions moindres que dans l’aorte.
Enfin, l’usage de ces dispositifs en dehors de leur indication officielle et autorisation de mise sur le marché pose un problème de prise en charge économique (pas de remboursement).
En dépit de ces difficultés anatomiques et d’ingénierie, certains auteurs ont décrit quelques cas cliniques et petites séries utilisant deux LVAD implantés pour des défaillances biventriculaires.
Le Jarvik® 2000 (Jarvikheart, New York, USA) a été le premier LVAD implanté en position ventriculaire droite en 2004 chez un patient de 21 ans porteur d’une cardiomyopathie dilatée à coronaires saines et présentant une dysfonction ventriculaire droite après implantation d’un LVAD avec défaillance multiviscérale dans un contexte de sepsis. Bien que le débit cardiaque ait été maintenu supérieur à 3 l/min avec une pression veineuse centrale autour 5-10 mm Hg, le patient est malheureusement décédé d’un sepsis avec insuffisance hépato cellulaire au 27ème jour. 8
Le Heartware® HVAD (Medtronic, Minnéapolis, USA) reste le dispositif le plus représenté dans la littérature en position bi ventriculaire 9,10,11,12. Krabatsch et al 13 ont rapporté en 2011 une série de 17 patients. La canule d’admission ventriculaire droite a bénéficié de l’adjonction d’un anneau en silicone permettant une réduction de la portion intra ventriculaire afin de limiter les lésions locales et le risque de succion. Le diamètre de la canule de sortie a été réduit de 10 à 5 mm grâce à une suture afin de limiter l’excédent de débit. La survie à 1 et 6 mois était respectivement de 82% et 50%. La moitié des patients ont pu regagner leur domicile.
Deuse et al. 14 ont rapporté en 2013 une stabilité hémodynamique de 10 semaines chez un patient de 68 ans présentant une défaillance ventriculaire droite après dissection de l’artère coronaire droite non revascularisée et implanté d’un Heartware® en position ventriculaire droite sans ajustement des canules.
Baldwin et al. 15 ont récemment présenté l’association d’un Heartmate® II (Abbott, Chicago, Illinois, États-Unis) en position gauche et d’un Heartware® HVAD en position droite.
Même si l’idée parait séduisante, l’association de ces dispositifs expose potentiellement à un risque double de complications. De plus, la notion primordiale de qualité de vie n’a pour l’instant jamais été étudiée (encombrement et poids des périphériques externes avec 2 contrôleurs, 4 batteries, 2 lignes percutanées etc…). Aucun dispositif spécifiquement adapté à la physiologie du ventricule droit et de ses régimes de pression n’est actuellement disponible. Les séries restent limitées, avec des effectifs réduits. La procédure chirurgicale n’est pas standardisée (à droite, admission du LVAD pour certains dans le ventricule, pour d’autres dans l’oreillette), les choix des LVAD implantés sont à la discrétion du chirurgien sans critère de sélection autre évident à ce jour. Des études complémentaires sont donc nécessaires avant un élargissement à la pratique clinique. Des dispositifs en développement tel le Heartware® MVAD 16, 17, 18, version miniaturisée du Heartware® HVAD actuel, pourrait amener dans le futur élargir les indications de par sa taille plus adaptée à l’anatomie ventriculaire droite. On peut aussi citer le système Circulite Synergy® 19, 20, une petite pompe axiale miniaturisée actuellement en cours d’étude dans des modèle pré-cliniques en position bi ventriculaire pour une utilisation au long cours.
Les coeurs artificiels totaux 21
Le coeur artificiel AbioCor® (Abiomed, Danvers, Massachusetts, USA) (Figure 3) 22,23,24
Premier coeur artificiel electro-hydraulique totalement implantable avec un contrôleur, un système de batterie interne, et une bobine sous cutanée en position sous claviculaire permettant de recharger la batterie interne par transmission énergétique transcutanée (Système TET), il a pour la première fois été implanté chez l’homme en 2001. Les deux ventricules en polyuréthane étaient séparés par un convertisseur d’énergie assurant le transfert d’un fluide (énergie hydraulique) d’un ventricule a un autre permettant de mimer la systole alternativement (flux pulsatile). L’énergie était transmise au convertisseur grâce à la bobine de transfert transformant des ondes radio en courant continu. La batterie interne permettait une autonomie de 60 minutes, libre de toute connexion externe. Un système de deux batteries externes permettait une autonomie de deux heures environ.
Ce système, initialement prometteur, présente des inconvénients majeurs ses dimensions de 13 x 8 cm pour un poids de près de 1 kilogramme, interdisent son implantation chez les femmes et est compatible avec seulement 50% des hommes. La bobine de transfert d’énergie devait également être correctement positionnée sur la peau au risque d’entraîner des brûlures cutanées. Le volume et le nombre de composants rendent l’implantation chirurgicale complexe, délabrante, associée à une mortalité non négligeable. Par ailleurs la biocompatibilité reste décevante avec une propension à la formation de thrombis responsables d’un nombre élevé d’accidents vasculaires cérébraux.
Dowling RD et al rapportaient en 2004 sur une petite série de 7 patients, un décès per opératoire sur choc hémorragique, un décès précoce sur réaction à l’aprotinine ou embolie pulmonaire compte tenu de la présence d’un thrombus intra atrial droit à l’autopsie. Des 5 patients restant, 3 sont décédés plus tardivement (Le premier d’une défaillance mutliviscérale, le second d’un AVC ischémique et le troisième d’une hémorragie rétro péritonéale) et l’autopsie réalisée retrouvait chez chacun un thrombus intra atrial mais pas de thrombose de pompe.
Un seul patient a pu rentrer à domicile à la fin de l’étude : deux patients étaient encore vivants respectivement à 181 et 234 jours de l’implantation.
Un rapport de la FDA de 2006 rapporte une série de 14 patients comprenant la série de Dowling précédemment citée avec finalement 12 patients ayant survécus a la chirurgie. Ce dernier confirme que les effets indésirables majeurs regroupaient les saignements (liés au niveau d’anticoagulation) les infections non liées au dispositif (soit respectivement : 10 patients et 11 patients), les AVC et AIT (respectivement 9 et 3 patients). La survie moyenne était de 4,5 mois pour une survie maximale de 512 jours.
Ce système n’a jamais été utilisé en France et a été abandonné de la pratique clinique aux Etats Unis compte tenu de ces nombreuses limites. La société Abiomed a développé le projet de l’AbioCor ®II, 35% plus petit que son prédécesseur, permettant une implantation chez l’homme et la femme et d’une durée de vie 2 à 3 fois plus longue. A ce jour, aucune expérimentation scientifique in vitro ou chez l’animal n’a été rapportée à notre connaissance avec ce dispositif.
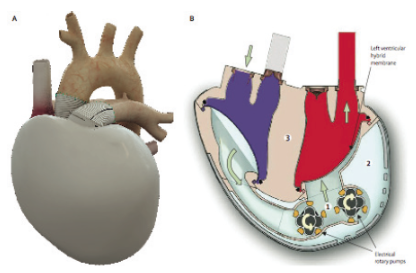
Le coeur artificiel Carmat (Carmat, Velizy, France) (Figure 4). En l’absence d’alternative pour la prise en charge de la dysfonction biventriculaire terminale chez les patients contre indiqués à la transplantation, le développement d‘un coeur artificiel « bio-compatible » a progressivement vu le jour, avec l’enjeu de permettre un retour à domicile sous couvert d’une bonne qualité de vie.
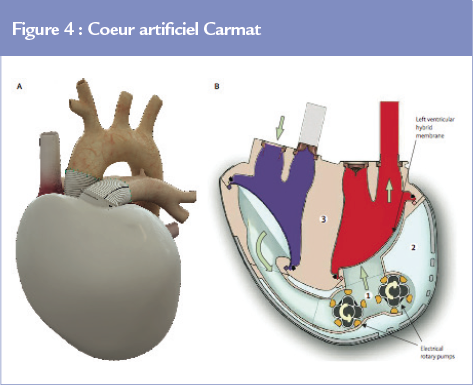
Le résultat est une prothèse cardiaque silencieuse, implantable en position orthotopique, de 900 grammes, volumineuse, préférentiellement compatible avec un thorax masculin. Ce dispositif est composé de 2 ventricules porteurs d’une membrane mixte : recouverte de péricarde bovin côté sang et recouverte de goretex côté liquide d’actionnement (énergie hydraulique). Quatre valves péricardiques Carpentier-Edwards assurent une biocompatibilité espérée optimale 25, avec une diminution théorique du risque thrombotique permettant d’envisager à l’avenir, après validation par des essais cliniques, une réduction de l’anticoagulation. Deux moteurs/pompes permettent un déplacement du fl uide d’actionnement et donc de la membrane mimant ainsi la systole et la diastole (flux pulsatile). Des capteurs de pression et de position, des algorithmes multiples et une électronique de contrôle totalement embarquée permettent une régulation automatique du débit et de la fréquence. Une adaptation continue aux besoins physiologiques est ainsi espérée.
Par ailleurs, la technique d’implantation est assez proche de celle d’un greffon cardiaque : un dispositif d’interface biocompatible est suturé aux oreillettes laissées en place, puis la prothèse est « encliquetée » sur ce dispositif. Le dispositif est relié à un contrôleur par un câble tunnelisé puis extériorisé à la peau. Le contrôleur est, lui-même relié à 4 batteries.
L’assurance d’une compatibilité anatomique nécessite au préalable la réalisation d’un scanner thoracique pour réalisation de mesures et reconstructions à l’aide d’un logiciel de simulation adapté.
Les premiers tests pratiqués sur les animaux de 2012 à 2013 rapportaient un débit ayant atteint 9l/min avec un faible niveau d’hémolyse, sans thrombose, embolie cérébrale ou infarctus rénaux. Cependant, seulement 4 veaux purent se tenir debout durant la période post opératoire et la survie maximale fut alors de 12 jours.26. L’étude FIM (First in Man) 27, réalisé sur 4 patients atteints d’insuffisance biventriculaire irréversible INTERMACS 1 ou 2 et non éligibles à la transplantation, rapportait que la prothèse a pu être implantée dans tous les cas, chez 2 avec une survie de 6 mois, et ayant la possibilité de regagner leur domicile avec cependant des hospitalisations répétées.
L’expérimentation a été suspendue en France actuellement mais se poursuit à l’étranger. Cette étude prospective, multicentrique, internationale, est destinée à obtenir le marquage CE. Les patients inclus seront âgés de 18 à 75 ans, atteints de dysfonction biventriculaire ou contre indiqués à un LVAD, dépendants aux inotropes ou avec un Index cardiaque <2,0 L/min/m2 malgré un traitement médical optimal. Le critère de jugement principal sera la survie à 6 mois ou la transplantation cardiaque avant ce délai. Les critères de jugement secondaires seront la qualité de vie selon divers questionnaires validés, les effets secondaires, le coût, les réinterventions et les réhospitalisations.
Le coeur artificiel SmartHeart® de la clinique de Cleveland (Figure 5)
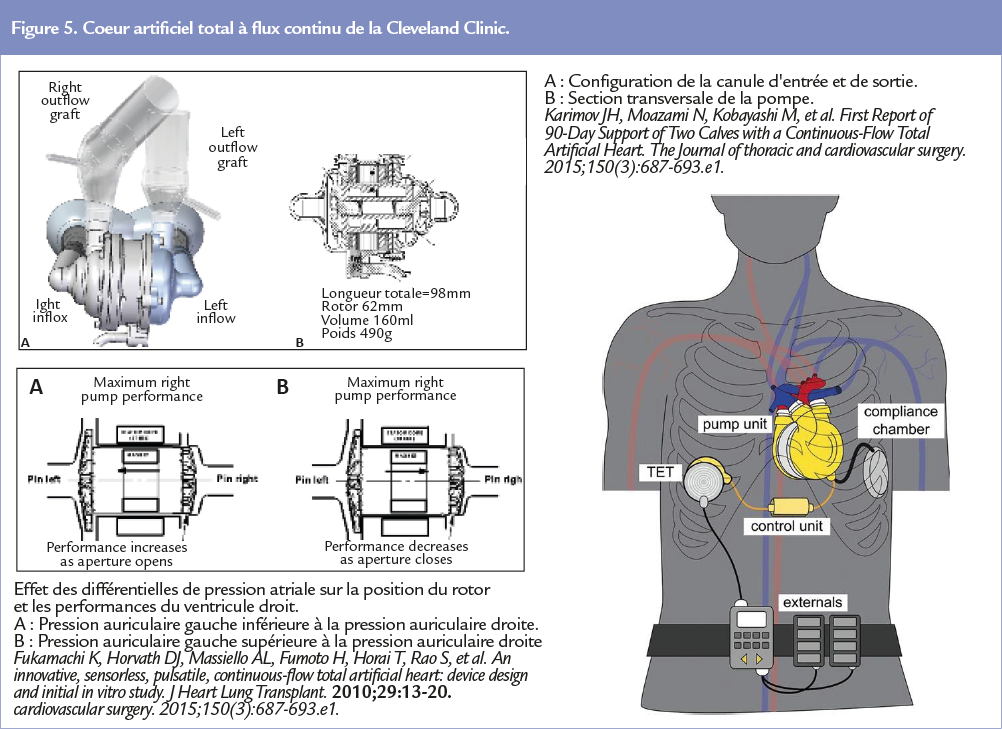
Le coeur artificiel total SmartHeart® développé par la clinique de Cleveland aux USA 28, 29, 30 est un système implantable, de dimensions beaucoup plus réduites : de 6 x 10 cm et 37 mL de volume. Ce dispositif à flux continu, sans valves, est composé de deux pompes rotatives avec un rotor commun relié à 2 turbines (gauche et droite) à chaque extrémité. Le rotor garde une liberté de mouvement dans le plan axial et est influencé par les pressions de remplissage atriales, permettant de faire varier l’ouverture de la canule d’admission et d’éjection pour assurer une autorégulation passive et sans capteur du débit de pompe. Ce système utilise la modulation sinusoïdale des vitesses afin de simuler un cycle cardiaque avec des fl ux pulsatiles plus physiologique. La vitesse de rotation de la pompe est automatiquement régulée.
Karimov et al, ont en 2015 présenté une série de 17 veaux implantés. Les résultats hémodynamiques étaient satisfaisants avec un débit de pompe moyen à 7,3 L/min, une pression atriale droit moyenne à 17 mm Hg, une pression atriale gauche moyenne à 16 mm Hg, une pression artérielle systémique moyenne à 103 mm Hg et une pression artérielle pulmonaire moyenne à 34 mm Hg. Les 3 derniers veaux on respectivement vécu 30, 90 et 90 jours sans anticoagulation, ni complication thromboembolique.
Ce système n’a actuellement jamais été implanté chez l’homme.
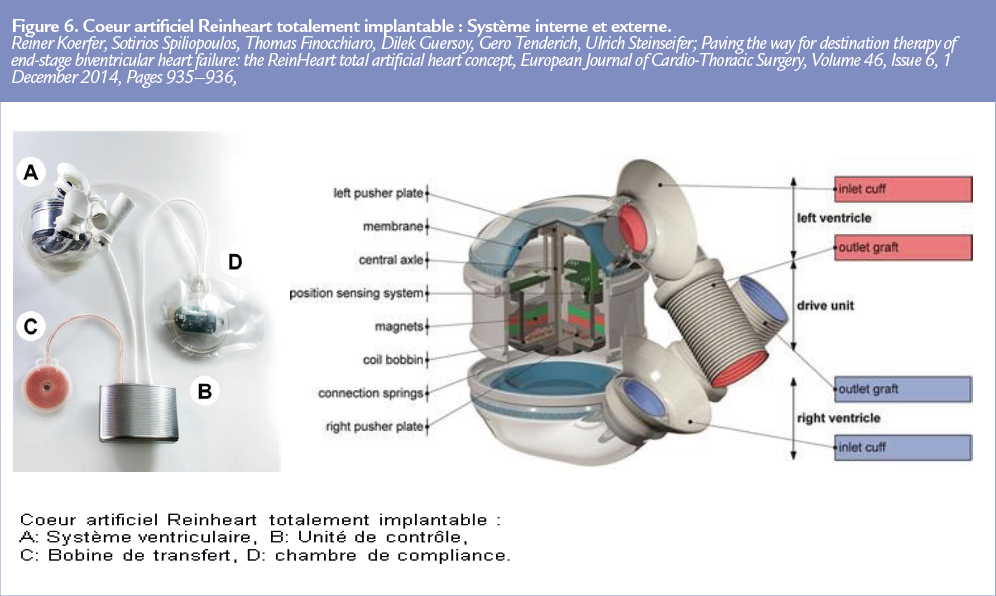
Le coeur artificiel ReinHeart (Figure 6)
Le Reinheart, développé à Aachen en Allemagne 31, 32, 33, 34, est un coeur artifi ciel pulsatile, totalement implantable, avec un une partie interne composée d’une pompe de 940 grammes mesurant 87×90 mm avec deux ventricules séparés par une unité d’entrainement. Cette dernière assure un mouvement axial sous contrôle électromagnétique permettant l’éjection alternative des ventricules par l’intermédiaire de plaques comprimant une membrane de polyuréthane. Chaque ventricule est composé de cette membrane ainsi que de deux valves mécaniques St Jude Médical assurant un flux unidirectionnel. La membrane n’est volontairement pas fixée aux plaques de poussées afin d’assurer un remplissage plus physiologique, sensible à la pré-charge, dans le cadre de la loi de Frank Starling. Une chambre de compliance permet un remplissage contrôlé des ventricules. Un contrôleur interne avec batterie intégrée est relié à une bobine en position sous cutanée assurant une recharge de la batterie par transmission énergétique transcutanée (système TET).
La partie externe se compose d’une interface de contrôle pour l’utilisateur ainsi que de deux batteries externes.
Les premiers tests chez l’animal rapportent un support hémodynamique satisfaisant jusqu’à deux jours avec un débit avoisinant 7L/min et une pression intra atriale gauche inférieure a 15 mmHg. Des études supplémentaires au long cours sont nécessaires avant d’envisager une implantation chez l’homme.
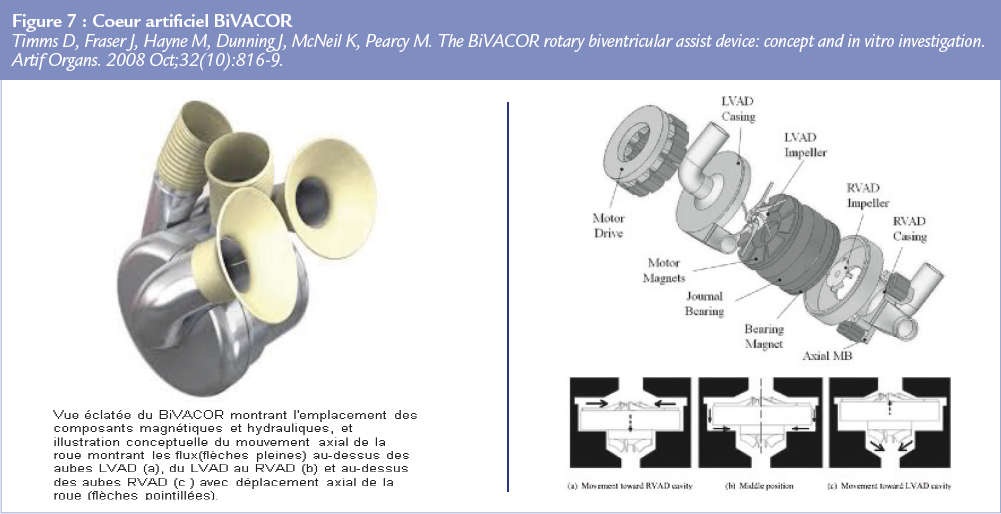
Le coeur artificiel BiVACOR® (Figure 7)
Le coeur artificiel Bivacor® (BiVACOR Inc, Houston, USA)35, 36, 37, 38 est composé de deux ventricules éjectant simultanément grâce à deux rotors centrifuges semi-ouverts montés sur un moyeu rotatif commun. L’équilibrage du fl ux est réalisé grâce au mouvement du rotor dans la direction axiale. Le rotor est maintenu en lévitation grâce à un système de suspension magnétique actif dans la direction axiale et un palier hydrodynamique passif dans la direction radiale. L’obtention d’un flux pulsé est obtenue par modulation de vitesse. Un câble d’alimentation est tunnelisé puis extériorisé à la peau en regard de l’abdomen pour être relié à un contrôleur et 2 batteries externes. L’avantage supposé de ce système en lévitation réside en l’absence de frottement responsable habituellement d’usure prématurée ainsi que d’hémolyse. De plus, sa petite taille laisse espérer une bonne compatibilité avec les thorax de petite taille principalement chez les femmes, les adolescents et enfants.
Les premiers tests in vitro mettent en évidence des performances hémodynamiques jugées satisfaisantes avec un débit de 5 L/min obtenu pour des post charges à 20 et 100 mmHg . L’équilibrage des flux entre la circulation droite et gauche était permis par le mouvement axial du rotor avec obtention d’un débit différentiel de 1,8 L/min. Le premier essai sur une série de 9 bovins rapporte une survie de plus de 30 jours chez 3 d’entre eux. Des essais à plus long terme sont encore en cours avant d’envisager une implantation chez l’homme.
Conclusion
A ce jour, le traitement de référence en cas de dysfonction biventriculaire irréversible reste la transplantation cardiaque. Le Coeur artificiel total CardioWest et le système d’assistance biventriculaire BerlinHeart sont les seuls systèmes d’assistance mécanique au long cours intégrés en pratique clinique malgré de nombreux inconvénients qui limitent leur développement.
Les perspectives d’évolution restent néanmoins nombreuses en matière d’assistance biventriculaire au long cours grâce aux avancées technologiques et à la miniaturisation, permettant l’apparition de pompes potentiellement implantables en position ventriculaire droite, d’un coeur artificiel entièrement biocompatible et totalement embarqué, ou bien de systèmes totalement implantables grâce à un système de transmission transcutanée d’énergie (TET).
Bien qu’il ne s’agisse que d’une population limitée aux patients les plus graves et sélectionnés, les enjeux tant médicaux, que socio-économiques et éthiques n’en restent pas moins importants, avec des bouleversements à prévoir dans les années à venir.
Yanis Bouali1, Erwan Donal1, Erwan Flécher2
1 : cardiologie – CHU Rennes – 2 : CTCV – CHU Rennes
RÉFÉRENCES
1. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2016. European Heart Journal, Volume 37, Issue 27, 14 July 2016, Pages 2129–2200,
2. Franzin-Garrec M. L’insuffi sance cardiaque. Une maladie chronique en augmentation alarmante. Soins 2013; 774:25.
3. CNAM Caisse Nationale d’Assurance Maladie, Caractéristiques et trajet de soins des insuffi sants cardiaques du Régime Général. Point de repère 2012 ; 38 : 1-14.
4. Copeland JG, Smith RG, Arabia FA, et al. Cardiac replacement with a total artifi cial heart as a bridge to transplantation. N Engl J Med 2004;351:859-67.
5. Copeland JG, Copeland H, Gustafson M, Mineburg N, Covington D, Smith RG et al. Experience with more than 100 total artifi cial heart implants. J Thorac Cardiovasc Surg 2012;143:727-34.
6. Eric A. Rose, Annetine C. Gelijns, Alan J. Moskowitz, et al . Long-Term Use of a Left Ventricular Assist Device for End-Stage Heart Failure. N Engl J Med 2001; 345:1435-1443
7. Karimov JH, Sunagawa G, Horvath D, Fukamachi K, Starling RC, Moazami N. Limitations to chronic right ventricular assist device support. Ann Thorac Surg. 2016;102:651–658.
8. Frazier OH, Myers TJ, Gregoric I. Biventricular assistance with the Jarvik FlowMaker: a case report. J Thorac Cardiovasc Surg. 2004;128:625–626.
9. Saito S, Sakaguchi T, Miyagawa S, Yoshikawa Y, Yamauchi T, Ueno T, Ku- ratani T, Sawa Y. Biventricular support using implantable continuous-fl ow ventricular assist devices. J Heart Lung Transplant. 2011;30:475–478. doi: 10.1016/ j.healun.2010.11.013.
10. Strueber M, Meyer AL, Malehsa D, Haverich A. Successful use of the HeartWare HVAD rotary blood pump for biventricular support. J Thorac Cardiovasc Surg. 2010;140:936–937. doi: 10.1016/j. jtcvs.2010.04.007.
11. Hetzer R, Krabatsch T, Stepanenko A, Hennig E, Potapov EV. Long- term biventricular support with the HeartWare implantable continuous fl ow pump. J Heart Lung Transplant. 2010;29:822–824. doi: 10.1016/j. healun.2010.02.012.
12. Tran HA1, Pollema TL, Silva Enciso J, Greenberg BH, Barnard DD, Adler ED, Pretorius VG. Durable Biventricular Support Using Right Atrial Placement of the HeartWare HVAD. Heart Lung Transplant. 2016 Apr;35(4):466-73.
13. Krabatsch, T., Potapov, E., Stepanenko, A. et al. Biventricular circulatory support with two miniaturized implantable assist devices. Circulation. 2011; 12411 Suppl: S179–S186.
14. Deuse, T., Schirmer, J., Kubik, M., and Reichenspurner, H. Isolated permanent right ventricular assistance using the HVAD continuous-fl ow pump. Ann Thorac Surg. 2013; 95: 1434–1436
15. Baldwin ACW, Sandoval E, Cohn WE, Mallidi HR, Morgan JA, Frazier OH. Nonidentical Continuous-Flow Devices For Biventricular Support. Texas Heart Institute Journal. 2017;44(2):141-143.
16. Connellan M, Iyer A, Robson D, Granger E, Dhital K, Spratt P. The HeartWare transvalvular miniature ventricular assist device used for right ventricular support. J Heart Lung Transplant . 2013;32(suppl):S149.
17. Anson Cheung, MD,* Katherine Chorpenning, MS,† Daniel Tamez, BS,† Charles Shambaugh, Jr, BS,† Anne E. Dierlam, BS,† M. Ertan Taskin, PhD,† Michael Ashenuga, MBA,† Carlos Reyes, MS,† and Jeffrey A. LaRose, MS† Design Concepts and Preclinical Results of a Miniaturized HeartWare Platform The MVAD System. Innovations (Phila). 2015 May; 10(3): 151–156.
18. Tamez D, LaRose JA, Shambaugh C, et al. Early Feasibility Testing and Engineering Development of the Transapical Approach for the HeartWare MVAD Ventricular Assist System. ASAIO journal (American Society for Artifi cial Internal Organs : 1992). 2014;60(2):170-177.
19. Schmitto JD, Burkhoff D, Avsar M, Fey O, Ziehme P, Buechler G, Hav- erich A, Strueber M. Two axial-fl ow Synergy Micro-Pumps as a biven- tricular assist device in an ovine animal model. J Heart Lung Transplant. 2012;31:1223–1229. doi: 10.1016/j.healun.2012.08.008.
20. Klotz S, Meyns B, Simon A, Wittwer T, Rahmanian P, Schlensak C, Tjan TT, Scheld HH, Burkhoff D. Partial mechanical long-term support with the CircuLite Synergy pump as bridge-to-transplant in congestive heart failure. Thorac Cardiovasc Surg. 2010;58(suppl 2):S173–S178. doi: 10.1055/s- 0029-1240687. PubMed PMID: 20101535.
21. Gino Gerosa, Silvia Scuri, Laura Iop, Gianluca Torregrossa. Present and future perspectives on total artifi cial hearts. Ann Cardiothorac Surg. 2014 Nov;3(6):595-602.
22. Dowling RD, Gray LA Jr, Etoch SW, et al. The AbioCor implantable replacement heart. Ann Thorac Surg 2003;75:S93-9.
23. Dowling RD, Gray LA Jr, Etoch SW, et al. Initial experience with the AbioCor implantable replacement heart system. J Thorac Cardiovasc Surg 2004;127:131-41.
24. FDA Summary of Safety and Probable Benefi t H040006 AbioCor Implantable Replacement Heart. Available online: http://www.accessdata.fda.gov/cdrh_docs/pdf4/ H040006b.pdf, accessed May 19, 2014.
25. Jansen P, van Oeveren W, Capel A, Carpentier A. In vitro haemocompatibility of a novel bioprosthetic total artifi cial heart. Eur J Cardiothorac Surg 2012; 41: e166–72.
26. Latrémouille C, Duveau D, Cholley B, et al. Animal studies with the Carmat bioprosthetic artifi cial heart. Eur J Cardiothorac Surg 2015; 47: e172–78.
27. Alain Carpentier, Christian Latrémouille, Bernard Cholley et al. First clinical use of a bioprosthetic total artifi cial heart: report of two cases The Lancet , 2015, Volume 386 , Issue 10003 , 1556 – 1563
28. Fukamachi K, Horvath DJ, Massiello AL, Fumoto H, Horai T, Rao S, et al. An innovative, sensorless, pulsatile, continuous-fl ow total artifi cial heart: device design and initial in vitro study. J Heart Lung Transplant. 2010;29:13-20.
29. Fumoto H, Horvath DJ, Rao S, et al. In vivo acute performance of the Cleveland Clinic self-regulating, continuous-fl ow total artifi cial heart. J Heart Lung Transplant 2010;29:21-6.
30. Karimov JH, Moazami N, Kobayashi M, et al. First Report of 90-Day Support of Two Calves with a Continuous-Flow Total Artifi cial Heart. The Journal of thoracic and cardiovascular surgery. 2015;150(3):687-693.e1.
31. Laumen M, Finocchiaro T, Cuenca E, et al. A Novel Total Artifi cial Heart for Destination Therapy: In-Vitro and In-Vivo Study. Biomed Tech (Berl) 2013.
32. Pohlmann A, Lessmann M, Finocchiaro T. Drive optimisation of a pulsatile Total Artifi cial Heart. Arch Elect Eng 2011;60:169-178.
33. Benedikt Pelletier, Sotirios Spiliopoulos, Thomas Finocchiaro, Felix Graef, Kristin Kuipers, Marco Laumen, Dilek Guersoy, Ulrich Steinseifer, Reiner Koerfer, Gero Tenderich; System overview of the fully implantable destination therapy—ReinHeart-total artifi cial heart, European Journal of Cardio-Thoracic Surgery, Volume 47, Issue 1, 1 January 2015, Pages 80–86,
34. Koerfer R, Spiliopoulos S, Finochiarro T, Guersoy D, Tenderich G, Steinseifer U. Paving the way for destination therapy of end-stage biventricular heart failure: the ReinHeart total artifi cial heart concept, Eur J Cardiothorac Surg , 2014, vol. 46 (pg. 935-6)
35. Timms D1, Fraser J, Hayne M, Dunning J, McNeil K, Pearcy M. The BiVACOR rotary biventricular assist device: concept and in vitro investigation. Artif Organs. 2008 Oct;32(10):816-9.
36. Timms D., Fraser J., Thompson B., McNeil K., Steinseifer U. (2009) In-vitro and In-vivo testing of the BiVACOR Rotary BiVAD/TAH. In: Dössel O., Schlegel W.C. (eds) World Congress on Medical Physics and Biomedical Engineering, September 7 – 12, 2009, Munich, Germany. IFMBE Proceedings, vol 25/7. Springer, Berlin, Heidelberg
37. B. Thomson, J. Choudhary, N. Greatrex et al. BiVACOR® – A Magnetically Levitated Rotary Total Artifi cial Heart. The Journal of Heart and Lung Transplantation , 2012, Volume 31 , Issue 4 , S89.
38. Kleinheyer M, Timms DL, Greatrex NA, et al. Pulsatile operation of the BiVACOR TAH – motor design, control and hemodynamics. Conf Proc IEEE Eng Med Biol Soc. 2014;2014:5659–5662.Les auteurs déclarent ne pas avoir de lien d’intérêt avec le sujet traité.
