
L’échographie cardiaque trans-thoracique joue un rôle primordial dans l’évaluation des patients ayant un rétrécissement aortique (RA). Selon les recommandations actuelles de la Société Européenne de Cardiologie, la sténose valvulaire aortique « classique » est définie par une vitesse maximale aortique ≥4 m/sec, un gradient aortique moyen ≥40 mmHg, une surface valvulaire aortique (SVAo) ≤1cm2 et une SVAo indexée ≤0.6 cm2/m2 (1).
En dépit de cette définition, jusqu’à 40% des patients ayant un RA ont des « données discordantes », c’est-à-dire qu’ils ont une SVAo ≤1 cm 2, mais un gradient aortique moyen (GMA) <40 mmHg (2). Le diagnostic et la prise en charge des patients ayant une sténose aortique « à bas gradient » est souvent difficile puisque :
– la présence d’un RA serré doit être confirmée à l’aide de l’imagerie multi-modalité ;
– l’approche thérapeutique la plus appropriée pour ces patients (remplacement valvulaire aortique vs traitement médical) n’est pas clairement établie dans les recommandations.
Classifications des sténoses aortiques à « bas gradient » (Figure 1)
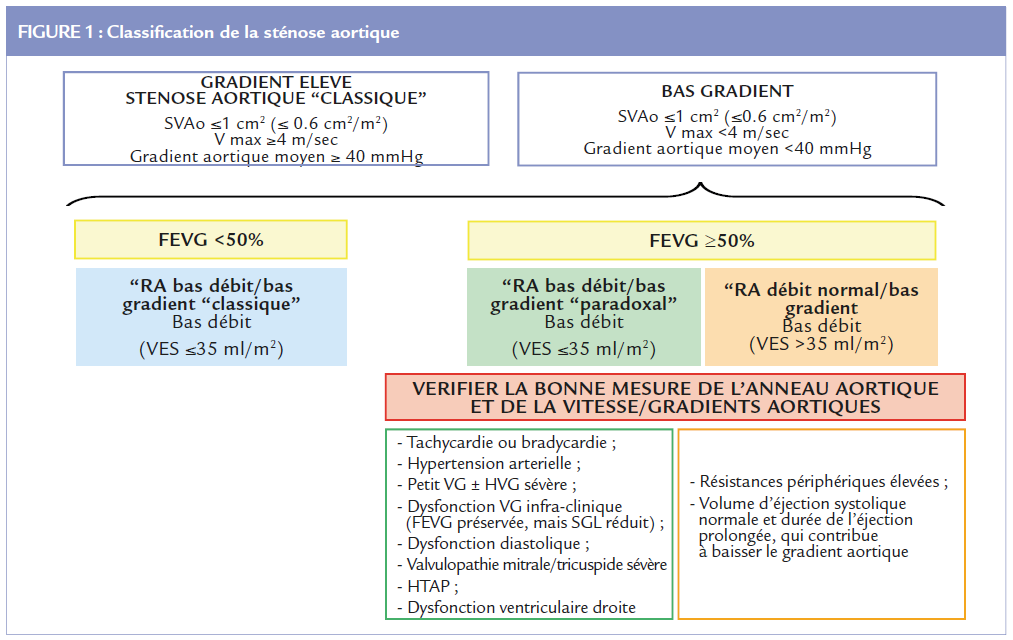
La sténose aortique à bas gradient peut être classifiée en trois sous-types en fonction du volume d’éjection systolique du ventricule gauche (VG) indexé par la surface corporelle (VES) et de la fraction d’éjection du ventricule gauche (FEVG) :
Le RA à bas gradient/bas débit « classique », caractérisé par une SVAo≤1cm2, un GMA <40mmHg, un VES ≤35 ml/m2, et une FEVG <50% ; Le RA à bas gradient/bas débit « paradoxal », caractérisé par une SVAo 1cm2, un GMA <40mmHg, un VES 35 ml/m2, et une FEVG 50% ;
Le RA à bas gradient/bas débit « paradoxal », caractérisé par une SVAo 1cm2, un GMA <40mmHg, un VES 35 ml/m2, et une FEVG 50% ;
Le RA à bas gradient et débit normal, caractérisée par un par une SVAo 1cm2, un GMA <40mmHg, un VES>35 ml/m2, et une FEVG 50%.
Comment estimer la sévérité du rétrécissement aortique
L’échographie trans-thoracique (ETT) est la méthode de référence pour l’évaluation initiale d’un rétrécissement aortique. Cette méthode permet d’estimer de façon simple, non invasive et peu coûteuse la vitesse et les gradients aortiques ainsi que la surface valvulaire aortique avec l’équation de continuité. Néanmoins, ces mesures peuvent être entachées par des erreurs qui doivent être corrigées afin de confirmer la sévérité de la sténose, et cela particulièrement chez les patients ayant un RA serré à bas gradient. Deux difficultés sont souvent rencontrées lors de l’estimation de la sévérité d’un RA :
Sous-estimation de la mesure de la chambre de chasse du ventricule gauche (VG)
Sous-estimation de la vitesse et des gradients aortiques.
Bien mesurer la chambre de chasse du ventricule gauche
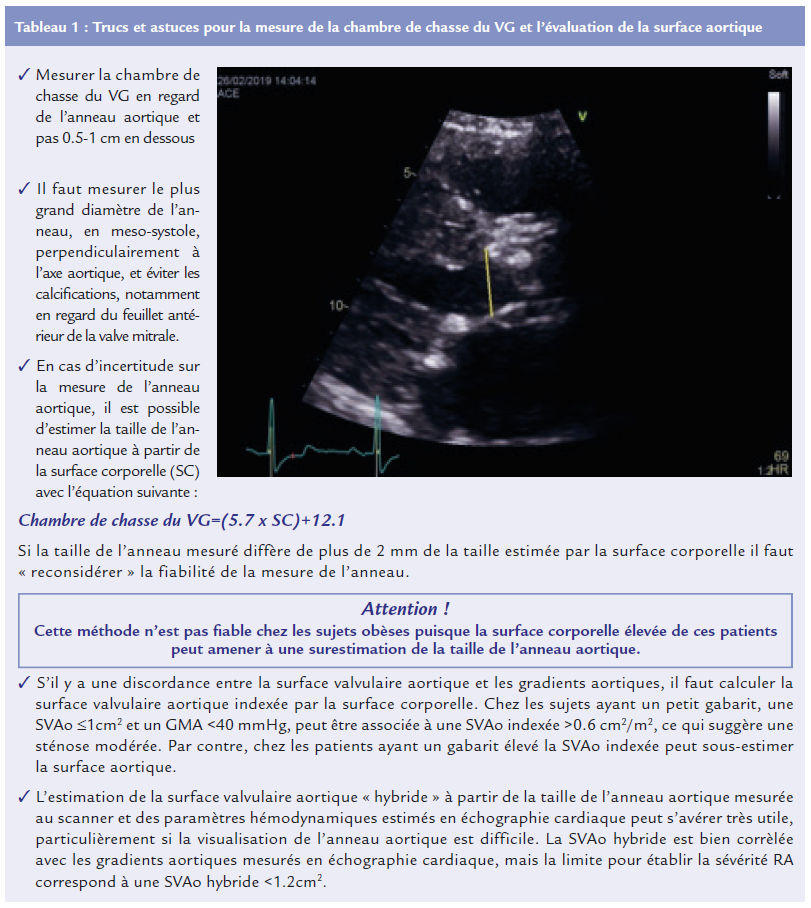
En ETT, l’estimation de la chambre de chasse du VG doit être faite en coupe parasternale longitudinale, privilégiant le « zoom » sur la valve aortique. Cette mesure correspond à l’estimation du diamètre de l’anneau aortique, du septum inter-ventriculaire au feuillet antérieur de la valve mitrale, et doit inclure les calcifications éventuelles, notamment sur le versant de la valve mitrale, afin de maximiser la taille de l’anneau (1). Plusieurs études ont montré que la mesure de la chambre de chasse du VG au niveau de l’anneau aortique en échographie 2D est bien reproductible, et est corrélée avec la mesure obtenue en échographie 3D (3). Si la visualisation de l’anneau aortique est difficile, une approche multimodale doit être mise en place par le recours à l’échographie cardiaque trans-œsophagienne ou tridimensionnelle. Une autre option est l’estimation de l’anneau aortique en scanner, ce qui permet une estimation « hybride » de la surface valvulaire aortique. Plusieurs études ont montré que l’ETT sous-estime souvent la taille de l’anneau aortique par rapport au scanner et qu’une approche multimodale peut améliorer cette mesure et amener à une reclassification de la sévérité du RA chez 25% des patients (4).
Compte tenu que la taille de l’anneau aortique mesuré au scanner est plus grande que la taille mesurée en ETT, une SVAo « hybride » 1.2 cm 2 correspond à une sténose aortique serrée (5) (Tableau 1).
Bien estimer les gradients aortiques
Le calcul de la vitesse maximale et des gradients aortiques est fait souvent en coupe apicale 5- ou 3-cavités. Néanmoins, la sous-estimation du gradient aortique par la coupe apicale est fréquente et peut être observée jusqu’a 50% des cas (6). Pour l’estimation du gradient aortique plusieurs coupes doivent être utilisées, y compris, la coupe parasternale droite et la coupe supra-sternale, et le gradient le plus élevé qu’on puisse mesurer doit être retenu.
Quoi faire en cas de discordance entre surface valvulaire et gradient aortique ?
La sténose aortique est une entité hétérogène sur le plan hémodynamique. Comme le montre la figure 1, une surface valvulaire aortique 1 cm 2 peut être associée à un gradient aortique moyen réduit et à un débit aortique normal ou réduit. Une fois établi qu’il n’y a pas d’erreurs dans la mesure des gradients aortiques et de la chambre de chasse du VG, différentes stratégies peuvent être mises en place pour confirmer la sévérité du RA. La figure 2 montre un algorithme pour le bon diagnostic du RA à bas gradient.
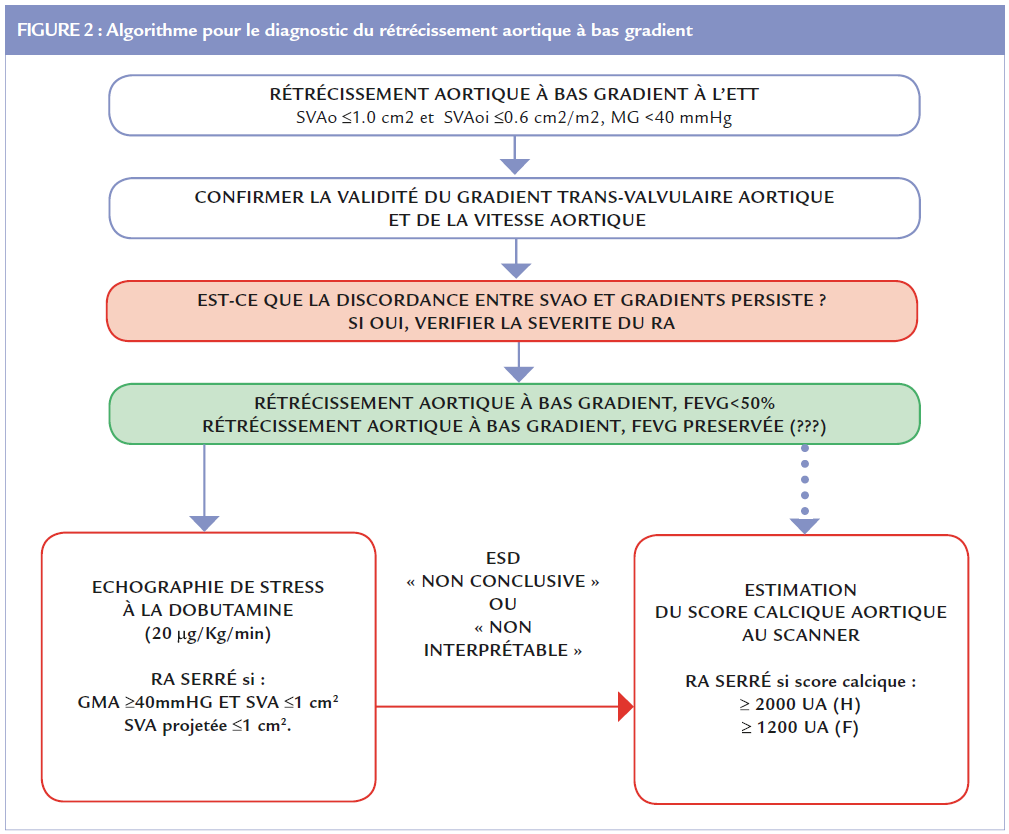
Chez les patients ayant un RA à bas gradient et une FEVG réduite, la réduction du débit aortique lié à la baisse de la FEVG peut être responsable d’une sous-estimation de la surface valvulaire.
L’échographie de stress à la dobutamine (ESD) à la faible dose (20 μg/Kg/min au pic de l’examen) permet chez un certain nombre de patients, d’augmenter le débit cardiaque et donc de différencier la sténose valvulaire aortique serrée d’une pseudo-sténose. Le rôle de l’ESD pour la confirmation de la sévérité du RA chez les patients ayant un bas gradient et une FEVG préservée est, par contre, objet de débat.
Certaines études ont montré le rôle pronostique de l’ESD dans le RA à bas gradient « paradoxal » (7). Néanmoins, les patients ayant un RA à bas gradient paradoxal ont souvent un VG très hypertrophié et des pressions de remplissage élevées, ce qui peut s’associer à des difficultés d’interprétation de l’ESD, liées soit à l’apparition d’un gradient sous-aortique, soit à une faible augmentation du débit cardiaque pendant l’examen.
Chez les patients ayant un RA à bas gradient et débit aortique normal, la présence d’un débit normal rend moins évident l’utilité de l’ESD. Néanmoins, certains patients ayant ce type de RA, peuvent avoir un « taux de flux » aortique basal (c’est-à-dire le rapport entre le débit aortique et la durée de l’éjection aortique) <200 ml/sec, et pourraient donc bénéficier d’une ESD afin d’augmenter le taux de flux et vérifier la sévérité du RA.
Le score calcique aortique au scanner thoracique non injecté représente une méthode reproductible et fi able pour estimer la sévérité du RA (8). Cette méthode permet une estimation « anatomique » de la sévérité du RA qui est indépendante du débit cardiaque et de l’hémodynamique du VG et est donc applicable à tous les patients ayant un RA à bas gradient, particulièrement si l’échographie de stress à la dobutamine n’est pas applicable ou ne permet pas d’établir la sévérité du RA. Les limites pour définir la sévérité du RA au score calcique aortique diffèrent en fonction du sexe : un score calcique aortique 1200 Unité d’Agatson (UA) correspond a une RA sévère chez la femme, alors que un score calcique aortique 2000 UA définit le RA serré chez l’homme (5).
La limite principale de l’application du score calcique aortique à l’évaluation de la sévérité du RA est due au fait que cette méthode ne prend pas en considération le rôle de la fibrose valvulaire dans l’hémodynamique du RA, ce qui explique pourquoi les patients atteints d’une bicuspidie aortique peuvent avoir un RA serré et un score calcique aortique bas (10).
Prise en charge du rétrécissement aortique à bas gradient
Selon les recommandations actuelles de la Société Européenne de Cardiologie (9), le remplacement valvulaire aortique (RVA) a une indication de classe I (niveau d’évidence B) chez les patients symptomatiques ayant un RA serré « classique ».
Chez les patients symptomatiques ayant un RA serré à bas gradient « classique » et une réserve contractile à l’ESD, l’indication au RVA est de classe I (niveau d’évidence C) (10). Le type d’intervention doit être attentivement évalué chez ces patients, qui ont souvent un très haut risque chirurgical, avec un recours au remplacement valvulaire percutanée (TAVR) dans la plus grande partie des cas. Néanmoins, le RVA ne devrait pas être refusé aux patients qui ont un RA à bas gradient « classique » et qui n’ont pas d’ augmentation du débit cardiaque à l’ESD (Classe IIA, niveau d’évidence C), puisque l’élimination de l’obstacle valvulaire peut améliorer significativement les symptômes et la survie (11).
La prise en charge des RA à bas gradient et FEVG préservée est plus controversée.
Chez les patients symptomatiques ayant un RA à bas gradient paradoxal, le recours au RVA a une indication de classe IIa (niveau d’évidence C), à condition que la sévérité du RA soit confirmée (12).
Par contre, les recommandations ne donnent pas d’informations spécifiques sur la prise en charge du RA à bas gradient, débit normal et FEVG préservée. Néanmoins, les données sur la prise en charge de ce type de RA sont discordantes avec certaines études qui montrent une survie similaire à celle des patients ayant un RA modéré (13) et d’autres qui montrent un pronostic péjoratif et une mortalité plus élevée en absence d’intervention (14).
Aujourd’hui, aucune étude randomisée n’a été réalisée afin d’établir la prise en charge la plus appropriée des patients ayant un RA serré à bas gradient et FEVG préservée.
L’étude ROTAS (Randomized study for the Optimal Treatment of symptomatic patients with low gradient severe Aortic valve Stenosis and preserved left ventricular ejection fraction ; est une étude multicentrique proposée par le CHU de Rennes dans le cadre du Programme Hospitalier de Recherche Clinique 2017, et a comme objectif d’établir la prise en charge optimale pour les patients ayant un RA à bas gradient et FEVG préservée et de montrer la supériorité du RVA sur le traitement médical.
Elena Galli, Erwan Donal
CHU Pontchaillou, Rennes
Elena.GALLI@chu-rennes.fr
RÉFÉRENCES
1. Baumgartner H, Hung J, Bermejo J, et al, Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging. 2017;18:254–275.
2. Clavel M-A, Magne J, Pibarot P. Low-gradient aortic stenosis. Eur Heart J. 2016;37:2645–2657.
3. LaBounty TM, Miyasaka R, Chetcuti S, Grossman PM, Deeb GM, Patel HJ, Booher A, Patel S, Bach DS. Annulus instead of LVOT diameter improves agreement between echocardiography effective orifice area and invasive aortic valve area. JACC Cardiovasc Imaging. 2014;7:1065–1066.
4. Clavel M-A, Pibarot P, Messika-Zeitoun D, et al Impact of Aortic Valve Calcifi cation, as Measured by MDCT, on Survival in Patients With Aortic Stenosis. J Am Coll Cardiol. 2014;64:1202–1213.
5. Clavel M-A, Messika-Zeitoun D, Pibarot P, et al The complex nature of discordant severe calcifi ed aortic valve disease grading: new insights from combined Doppler echocardiographic and computed tomographic study. J Am Coll Cardiol. 2013;62:2329–2338.
6. Thaden JJ, Nkomo VT, Lee KJ, Oh JK. Doppler Imaging in Aortic Stenosis: The Importance of the Nonapical Imaging Windows to Determine Severity in a Contemporary Cohort. J Am Soc Echocardiogr Off Publ Am Soc Echocardiogr. 2015;28:780–785.
7. Clavel M-A, Ennezat PV, Maréchaux S, et al. Stress Echocardiography to Assess Stenosis Severity and Predict Outcome in Patients With Paradoxical Low-Flow, Low-Gradient Aortic Stenosis and Preserved LVEF. JACC Cardiovasc Imaging. 2013;6:175–183.
8. Clavel M-A, Malouf J, Messika-Zeitoun D, Araoz PA, Michelena HI, Enriquez-Sarano M. Aortic valve area calculation in aortic stenosis by CT and Doppler echocardiography. JACC Cardiovasc Imaging. 2015;8:248–257.
9. Baumgartner H, Falk V, Bax JJ, , et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739–2791.
10. Monin J-L. Low-Gradient Aortic Stenosis: Operative Risk Stratifi cation and Predictors for Long-Term Outcome: A Multicenter Study Using Dobutamine Stress Hemodynamics. Circulation. 2003;108:319–324.
11. Levy F, Laurent M, Monin JL, et al Aortic valve replacement for low-fl ow/low-gradient aortic stenosis operative risk stratification and long-term outcome: a European multicenter study. J Am Coll Cardiol. 2008;51:1466–1472.
12. Clavel M-A, Dumesnil JG, Capoulade R, et al, Outcome of patients with aortic stenosis, small valve area, and low-fl ow, low-gradient despite preserved left ventricular ejection fraction. J Am Coll Cardiol. 2012;60:1259–1267.
13. Tribouilloy C, Rusinaru D, Maréchaux S, et al Low-gradient, low-fl ow severe aortic stenosis with preserved left ventricular ejection fraction: characteristics, outcome, and implications for surgery. J Am Coll Cardiol. 2015;65:55–66.
14. Taniguchi T, Morimoto T, Shiomi H, et al, CURRENT AS Registry Investigators. High- Versus Low-Gradient Severe Aortic Stenosis: Demographics, Clinical Outcomes, and Effects of the Initial Aortic Valve Replacement Strategy on Long-Term Prognosis. Circ Cardiovasc Interv. 2017;10.
