
ENTRUST-AF-PCI
Edoxaban versus antivitamines K (AVK) associé aux traitements antithrombotiques chez les patients en fibrillation atriale (FA) après angioplastie coronaire : un essai ouvert, randomisé, de phase 3b.
Auteurs : Pascal Vranckx et al
Contexte et hypothèse
Les anticoagulants oraux directs (AOD) ont largement remplacé les AVK dans le traitement préventif des AVC chez les patients atteints de FA non valvulaire.
Environ 15 % des patients en FA nécessitent une angioplastie coronaire, ainsi se pose le problème de gestion des traitements antithrombotiques. Les recommandations actuelles préconisent l’utilisation d’une trithérapie avec une bithérapie anti-agrégante (aspirine + anti P2Y12) qui est associée à un haut risque hémorragique.
Les trois grands essais randomisés (PIONEER-AF, AUGUSTUS et RE-DUAL-PCI) ont montré une réduction par bithérapie en comparaison de la trithérapie une réduction des évènements hémorragiques chez les patients traités uniquement par bithérapie. L’essai ENTRUST-AF-PCI a été conduit pour évaluer la sécurité et l’efficacité du traitement par edoxaban, associé à un inhibiteur du P2Y12 chez les patients atteints de FA ayant bénéficié d’une angioplastie coronaire.
Critères d’inclusion
Les patients éligibles étaient majeurs, nécessitaient un traitement anticoagulant pour de la FA non valvulaire depuis au moins 1 an et avaient bénéficié d’une angioplastie coronaire pour syndrome coronarien aigu ou maladie coronaire stable.
Les patients porteurs d’une prothèse valvulaire mécanique, d’une sténose mitrale modérée ou sévère, d’une insuffisance rénale terminale ou d’une autre comorbidité majeure étaient exclus.
Plan d’étude et traitements étudiés
ENTRUST-AF-PCI est un essai thérapeutique de noninfériorité, de phase 3b, multicentrique, randomisé, en ouvert avec un comité d’événement d’adjudication indépendant. Les patients étaient randomisés en ouvert de manière centralisée en deux bras parallèles en 1:1 entre 4 heures et 5 jours après la procédure. Un groupe recevait le traitement de référence par AVK et bithérapie antiagrégante et le second groupe edoxaban + inhibiteur de P2Y12.
Si la non-infériorité était atteinte, une analyse de supériorité serait réalisée.
La randomisation a été stratifiée sur le centre et la présentation clinique.
Critères de jugement
Le critère de jugement principal était un critère composite : saignement majeur ou cliniquement significatif, selon la définition ISTH à 12 mois. Le critère principal d’efficacité était le composite de mort cardiovasculaire, AVC, embolie systémique, infarctus du myocarde et thrombose de stent.
Les critères de jugement secondaires étaient : le bénéfice clinique, saignement majeur, cliniquement pertinent et mineur selon la classification ISTH, thrombose de stent. Les critères secondaires d’efficacité étaient : AVC ischémique ou hémorragique, embolie systémique, infarctus du myocarde, thrombose de stent confirmée ou probable, mortalité toutes causes, mortalité cardiovasculaire ou décès inexpliqué.
Taille de l’échantillon et hypothèses statistiques
Un échantillon de 750 patients par groupe est estimé pour une puissance de 80 % afi n de montrer une non-infériorité avec une marge de 1,20 et un risque alpha de 2,5 %. Cet essai a été construit pour montrer la non-infériorité de l’Edoxaban sur le critère de jugement principal de sécurité, comparativement aux antivitamines K.
Population
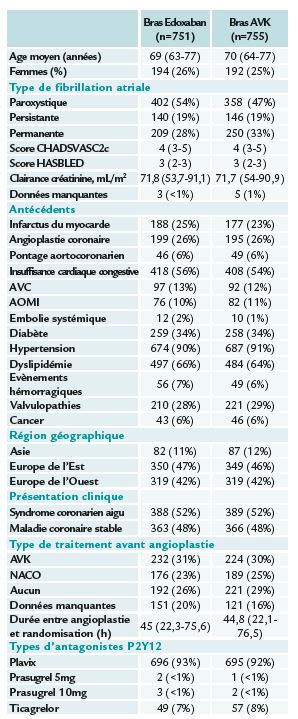
1 506 patients ont été inclus entre le 24 février 2017 et le 7 mai 2018, dans 186 sites et 18 pays : 751 dans le bras Edoxaban et 755 dans le bras AVK. Les patients assignés au bras edoxaban ont reçu 60 mg/ jour et ceux dans le bras AVK recevaient la dose nécessaire au maintien, d’un INR entre 2-3 associée avec du clopidogrel 75 mg/jour pendant 12 mois. Du prasugrel ou du ticagrelor pouvait remplacer le clopidogrel à la discrétion du clinicien. La dose d’edoxaban pouvait être réduite à 30 mg pour les patients nécessitant une demidose (20 % des patients).
Chez les patients dans le bras AVK, la trithérapie a été poursuivie pour une durée médiane de 66 jours. Le suivi clinique avait lieu à 1, 3, 6, 9 et 12 mois et le suivi téléphonique à 2, 4, 5, 7, 8, 10 et 11 mois après la randomisation. La médiane de suivi dans cet essai était de 364 jours (361-368).
Les analyses ont été réalisées sur la population en intention de traiter et la tolérance a été évaluée chez tous les patients ayant reçu au moins une dose du médicament attribué par la randomisation (edoxaban 99 % et AVK 98 %).
Résultats
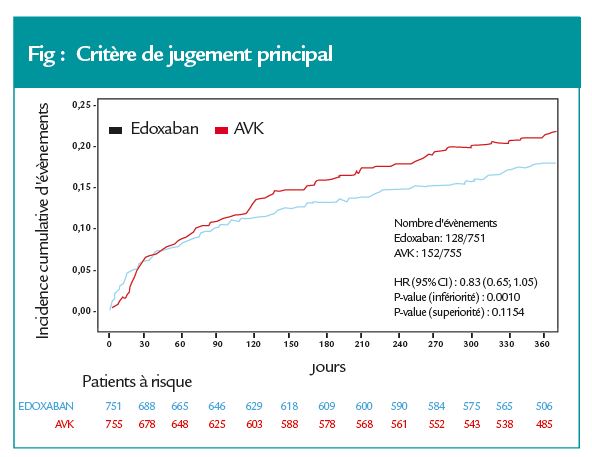
Critères de jugement principal
Le groupe double thérapie edoxaban a atteint la noninfériorité par rapport au groupe triple thérapie : 20,7 versus 25,6 % (HR = 0,83 ; IC95 : 0,65-1,05 ; p = 0,001 pour la non-infériorité), mais sans supériorité par rapport à la triple thérapie dans l’analyse de supériorité HR = 1,20 p = 0,115.
Il n’y avait pas de différence entre les deux groupes sur le critère primaire d’efficacité (critère composite : décès CV, AVC, embole systémique, IDM ou thrombose de stent) : 49 (7 %) des 751 patients du groupe edoxaban (taux annualisé d’événements à 7,3 %) et 46 (6 %) des 755 patients sous trithérapie (taux annualisé d’événements à 6,9 %), HR = 1,06 [95% CI 0,71-1,69]. Les saignements étaient homogènes, quelles que soient les définitions utilisées (ISTH, TIMI, BARC). Il y a eu quatre hémorragies intracrâniennes dans le groupe edoxaban et neuf dans le groupe AVK. Des saignements fatals sont intervenus chez un patient sous edoxaban et sept sous AVK.
Critère de jugement secondaire
Les taux de chaque composant du critère de jugement secondaire était similaire entre les traitements.
Conclusion
Chez les patients en fibrillation auriculaire avec angioplastie coronaire, la bithérapie antithrombotique avec edoxaban était non inférieure concernant les saignements, comparativement à la trithérapie avec AVK, sans différence significative sur les évènements ischémiques.
Emilie Mertens
