
CARAVAGGIO
Apixaban for the treatment of venous thromboembolism associated with cancer
Contexte et hypothèse
Les maladies thromboemboliques sont une cause fréquente de décès des patients atteints de cancer. Ces patients posent le problème d’une difficulté à obtenir une anticoagulation stable (inefficacité des AVK) et d’un risque hémorragique important. Jusqu’à récemment, seules les héparines de bas poids moléculaires étaient indiquées chez ces patients, avec la contrainte des injections quotidiennes et l’inconfort et complications liés à cela.
Les anticoagulants oraux directs prennent progressivement leur place dans le traitement des phlébites et embolie pulmonaires des patients atteints d’un cancer. En 2018, les investigateurs de Hokusai VTE cancer montraient la non-infériorité de l’édoxaban (60 mg par jour) comparé à la daltéparine en sous cutané, sans élévation des évènements hémorragiques.
Critères d’inclusion
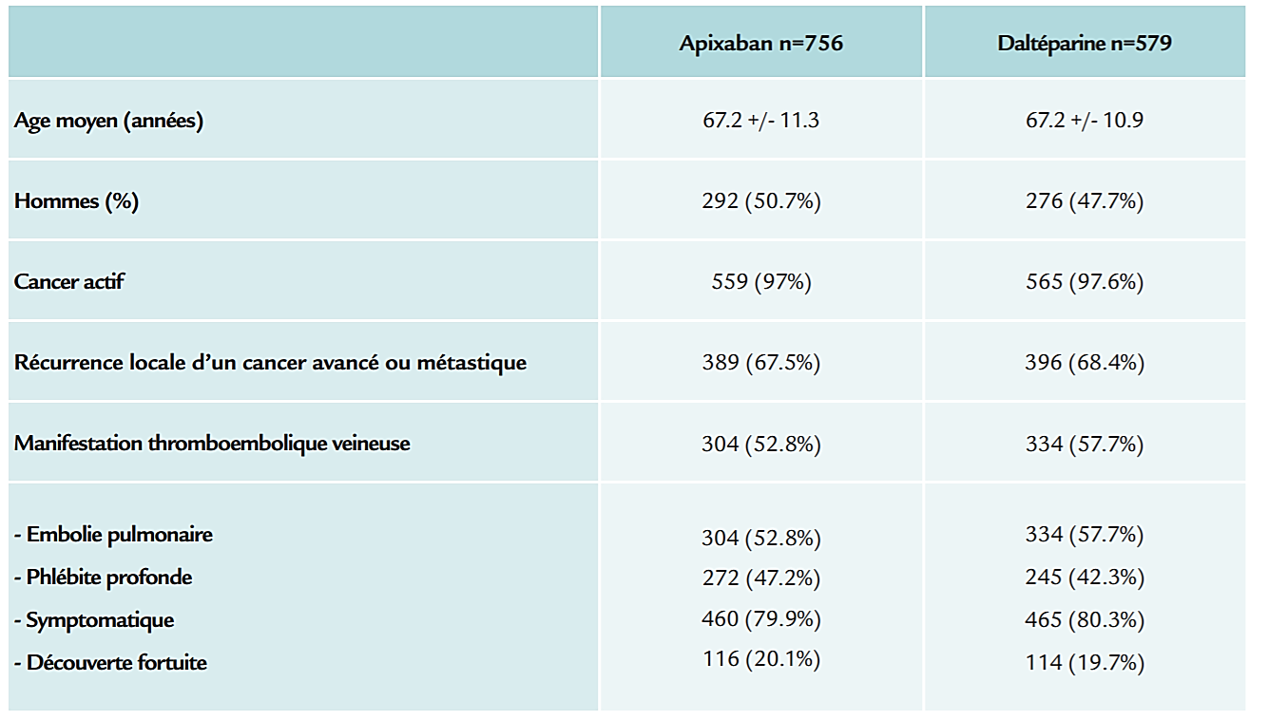
L’essai CARAVAGGIO a inclus les patients consécutifs atteints d’un cancer actif compliqué d’une maladie veineuse thrombo-embolique profonde symptomatique ou dépistée de manière fortuite. Les cas suivants étaient considérés : phlébite de la veine poplitée, fémorale, iliaque, veine cave, et embolie pulmonaire.
Les patients devaient avoir un cancer actif, ou un antécédent de cancer dans les deux ans.
Le cancer actif était défi ni par :
- diagnostic dans les 6 mois
- une récurrence
- envahissement régional, ou métastase.
Les patients avec des cancers cérébraux primitifs, des métastases cérébrales, des leucémies aiguës et des cancers cutanés baso cellulaire ou squameux étaient exclus.
Plan d’étude et traitements étudiés
Il s’agit d’un essai clinique sponsorisé par la FADOI (Federazione delle Associazioni dei Dirigenti Ospedalieri Internisti) et financé entièrement par l’alliance BristolMyers Squibb–Pfizer. Le dessin est celui d’un essai clinique multinational, randomisé en ouvert, testant la non-infériorité de l’apixaban contre la daltéparine sur les thromboses veineuses. Un comité d’adjudication a évalué les évènements en aveugle. La randomisation était stratifiée par la présence d’un cancer actif ou l’antécédent de cancer.
Les patients avec un cancer actif et une maladie thromboembolique étaient randomisés en 1 pour 1 entre deux stratégies :
- Bras contrôle : Daltéparine 200 UI par kilogramme par jour en sous cutané pendant 1 mois, puis 150 UI / kg / j pendant 5 mois.
- Apixaban 10 mg deux fois par jour pendant 7 jours, puis 5 mg x 2 / j pendant 6 mois au total.
Critères de jugement
- Critère principal : récidive de maladie thromboembolique symptomatique ou de découverte fortuite pendant les 6 mois de traitement.
- Critère de sécurité : survenue d’un saignement majeur défi ni par un des critères suivants :
- une baisse d’hémoglobine de 2 g/dL ou la nécessité d’une transfusion de 2 culots globulaires ;
- saignement dans une localisation critique (intracrânien, médullaire, oculaire, péricardique, interarticulaire, musculaire avec syndrome des loges ou retro péritonéal) ;
- saignement nécessitant un geste chirurgical d’hémostase ;
- saignement entraînant le décès.
Taille de l’échantillon et hypothèses statistiques
L’analyse a été effectuée en intention de traiter.
La taille de l’échantillon a été évaluée selon une hypothèse de non infériorité de l’apixaban face à la daltéparine sur le critère de jugement principal, avec une marge de 2.00 % pour une limite supérieure bilatérale comprenant un intervalle de confiance de 95%. En estimant un taux de 7 % d’évènements du taux primaire, l’inclusion de 934 patients permettait de montrer une non-infériorité de l’apixaban avec une puissance de 80 % et un alpha unilatéral de 0.025. En estimant 20 % de perdu de vue en patient-année, les investigateurs ont prévu d’inclure 1168 patients.
Population
Résultats
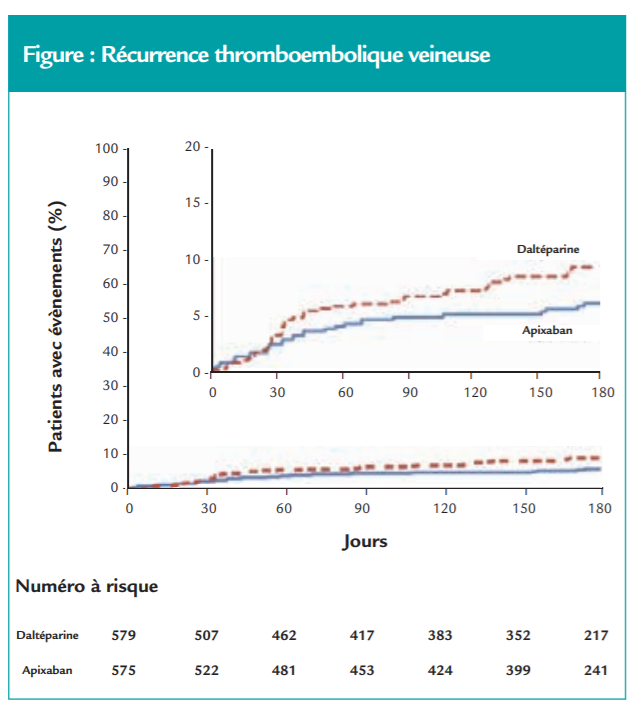
- Critère de jugement principal : le taux de récidive thromboembolique veineuse était de 5.6 % dans le bras apixaban versus 7.9 % dans le bras daltéparine, avec un HR de 0.63 (0.37 – 1.07), p<0.001 pour la non-infériorité et p=0.09 de supériorité (figure).
- Critères secondaires : le taux d’hémorragie majeure dans le groupe apixaban était de 3.8 %, contre 4 % dans le groupe daltéparine, avec un HR de 0.82 (0.40 – 1.69), p=0.60. Cela comprenait un taux de 1.9 % d’hémorragie gastro-intestinale avec apixaban contre 1.7 % avec daltéparine.
- Mortalité totale : le taux de mortalité était de 23.4 % dans le groupe apixaban contre 26.4 %, HR = 0.82 (0.62 – 1.09) dans le groupe daltéparine.
Conclusion
Cet essai clinique a démontré que l’apixaban peut être utilisé dans le traitement des phlébites et de l’embolie pulmonaire des patients avec un cancer actif. L’apixaban a montré un profil d’efficacité et sécurité favorable et en accord avec les données connues sur cette molécule dans le traitement des phlébites et embolie pulmonaire chez le tout-venant. Quelques limitations sont à noter : le design était ouvert, même si ce biais potentiel est jugulé par un comité d’adjudication aveugle ; enfin ces données ne sont pas applicables aux patients avec des tumeurs ou métastases cérébrales.
Michel Zeitouni, CCA Pitié Salpêtrière et Action Cœur
L’auteur déclare ne pas avoir de liens d’intérêts relatifs à cet article.
