
La pathologie anévrysmale de l’aorte abdominale est une affection chronique dégénérative qui représente une cause importante de décès évitables chez le sujet âgé. La mortalité associée à la rupture d’anévrysme de l’aorte abdominale (AAA) varie entre 65 et 85 % selon les séries.
L’affection reste généralement silencieuse jusqu’à la survenue de sa principale complication, à savoir la rupture. On comprend dès lors l’intérêt de détecter l’AAA avant la survenue de cette complication létale afin de pouvoir traiter cette pathologie de manière élective. Il est reconnu que les programmes de dépistage des AAA ciblant des populations à risque (habituellement les hommes âgés > 65 ans) sont associés à une réduction de la mortalité à moyen et long terme au sein de la population détectée. Malgré ces évidences, peu de programmes de dépistage de l’AAA sont implémentés à grande échelle dans les pays occidentaux. Plusieurs études ont démontré que la prévalence des AAA était élevée dans la population de patients coronariens et particulièrement chez les patients atteints d’une maladie tritronculaire1,2. Cette population de patients représente dès lors une population cible idéale pour un dépistage efficace des AAA. L’efficacité d’une stratégie de dépistage est cependant conditionnée par plusieurs paramètres dont l’adhésion du patient au programme de dépistage, le coût engendré par le dépistage et la possibilité de proposer un traitement curatif. Dans ce contexte, le dépistage opportuniste de l’AAA chez le patient coronarien par le cardiologue lors de la consultation d’échocardiographie de routine pourrait s’avérer être une stratégie de dépistage idéale permettant à la fois d’augmenter le taux de participation des patients et de réduire les coûts.
Utilisation de la sonde d’échocardiographie pour le dépistage des AAA
La méthode de dépistage préférentielle de l’AAA est l’échographie-doppler abdominale avec l’utilisation d’une sonde convexe de basse fréquence (2-5 MHz). Des mesures sont prises sur l’aorte abdominale à différents niveaux en allant d’un bord externe à l’autre, tout en étant le plus perpendiculaire à l’axe étudié. Cet examen est caractérisé par une haute sensibilité et une haute spécificité dans la détection des AAA et présente l’avantage de ne pas exposer le patient aux radiations ionisantes. Le CT-scanner abdominal est certainement l’examen de diagnostic le plus précis pour la détection des AAA mais expose le patient aux effets délétères des rayons X et n’est dès lors pas utilisé de manière routinière pour le screening des AAA. Son coût est par ailleurs plus élevé. L’examen clinique a une certaine utilité en pratique médicale routinière, permettant de diagnostiquer quelques cas d’AAA mais sa sensibilité et sa spécificité sont trop faibles pour permettre son usage dans des programmes de dépistage de masse. Les sondes utilisées en cardiologie pour les échocardiographies transthoraciques (ETT) de routine sont différentes des sondes utilisées en angiologie pour l’échographie de l’aorte abdominale. Les études ultrasoniques cardiaques par voie transthoracique sont réalisées à l’aide de sondes sectorielles, dites « phased array », de basses fréquences (1-3,5 MHz) tandis que l’étude ultrasonique de l’aorte abdominale nécessite habituellement une sonde convexe de fréquence un peu plus élevée (2-5 MHz) (Figure 1).
Bien qu’il ne soit pas initialement dédié à l’étude de l’aorte abdominale, l’appareillage échocardiographique actuel permet une mesure correcte du diamètre de l’aorte abdominale chez plus de 90% des patients bénéficiant d’un examen échocardiographique3–5. Plusieurs études ont par ailleurs démontré que le temps complémentaire nécessaire pour étudier l’aorte abdominale en complément de l’examen échocardiographique était faible, de moins de 3 minutes dans la majorité des cas. Enfin, les mesures de l’aorte abdominale obtenues par le dépistage opportuniste réalisé par des praticiens sans expérience en échographie vasculaire montrent une bonne corrélation avec celles obtenues par un technicien vasculaire utilisant un appareil dédié à l’étude de l’aorte abdominale3,6

Population cible
De nombreuses données permettent d’affirmer que la prévalence des AAA est élevée dans la population de patients porteurs d’une cardiopathie ischémique1,2,7. Il semble dès lors licite de promouvoir le dépistage des AAA dans ce groupe de malades. Le diamètre de l’aorte ascendante au sens large (racine et aorte tubulaire) est un facteur prédictif indépendant du risque de développement d’un AAA4 , 5 . Dans l’autre sens, les patients porteurs d’un AAA présentent également un risque accru de présenter une dilatation ou un anévrysme de l’aorte ascendante et de la crosse aortique à l’ETT. Le dépistage opportuniste de l’AAA lors de l’ETT réalisée chez les patients porteurs d’une ectasie de la racine aortique ou de l’aorte ascendante semble dès lors justifié.
L’âge avancé, le tabagisme, une histoire familiale d’AAA et la maladie artérielle périphérique sont fréquemment associés à la présence d’un anévrysme dans les études de dépistage opportunistes. La présence d’un de ces facteurs chez un patient par ailleurs coronarien potentialise le risque d’être porteur d’un AAA et par conséquence le bénéfice d’un dépistage opportuniste dans ce sous-groupe de patients.
Concernant l’âge à partir duquel le dépistage opportuniste est préconisé, la Société Européenne de Cardiologie recommande (classe IIa) de proposer ce dépistage à la population masculine âgée de plus de 65 ans (Tableau 1). Une étude de dépistage systématique de l’AAA avant coronarographie a cependant démontré que la prévalence globale des AAA chez les patients masculins coronariens était de 6,8%, tout âge confondu et restait élevé, de l’ordre de 4,5%, si on considérait uniquement les hommes âgés < 65 ans (groupe de patients habituellement exclus des programmes de dépistage)1 . Sur cette base, le screening opportuniste de l’AAA durant l’ETT pourrait être proposé chez tous les patients masculins coronariens quel que soit leur âge. Le bien-fondé du dépistage des patients très âgés (85 ans et plus) est discutable, en raison d’un plus grand risque de mortalité lié au traitement préventif de l’AAA à cet âge.

Concernant la population féminine, les évidences supportant un dépistage opportuniste durant l’ETT sont faibles en raison de la faible prévalence de la maladie chez ces dernières. D’une manière générale, la « US prevention Task Force » ne recommande pas le screening classique de l’AAA dans la population féminine8 alors que l’ESC recommande le dépistage opportuniste de l’AAA durant l’ETT chez la femme âgée > 65 ans avec antécédents de tabagisme mais la force de cette recommandation est faible (classe IIb) (Tableau 1).
Intervalle de dépistage
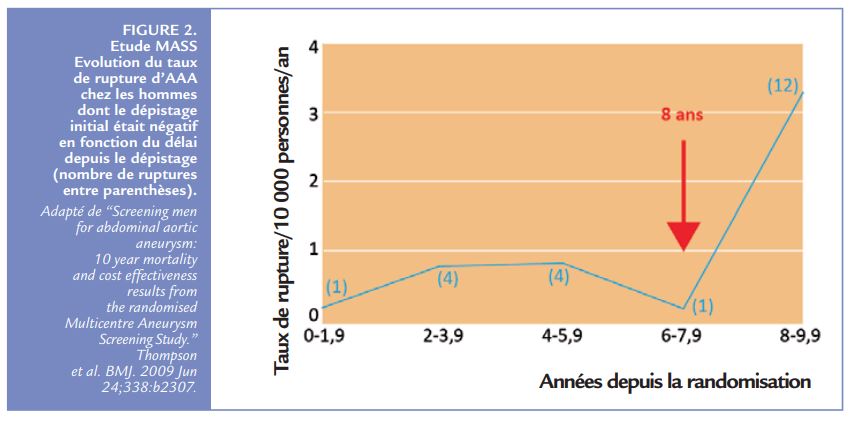
La plupart des études de dépistage des AAA recommandent un seul examen échographique de dépistage sans répétition. Les programmes de dépistage habituellement mis en place ciblent les hommes âgés > 65 ans et, dans ce contexte, il n’y a pas d’évidence, sur un suivi à 10 ans, d’un bénéfice lié à la répétition du dépistage durant cette période chez les patients dont l’échographie initiale était normale. Il est cependant intéressant de noter que, dans une étude britannique de dépistage de l’AAA menée à la fi n des années 90 et incluant près de 30 000 patients âgés entre 65 et 74 ans (étude MASS), certains hommes dont le dépistage initial était négatif vont présenter une rupture d’AAA durant les dix années de suivi et que le taux de rupture augmente de manière spectaculaire entre la huitième et la dixième année (Figure 2). Bien que la plupart des patients ayant présenté une rupture soient décédés, cela ne se traduit pas par une réduction significative du bénéfice de survie à long terme conféré par le dépistage et c’est la raison pour laquelle un rescreening n’est pas préconisé dans ce groupe de patients. L’élargissement du dépistage à des patients plus jeunes en raison de leur appartenance à des groupes à risque soulève la question d’un potentiel bénéfice lié à la répétition du dépistage dans cette population afin d’éviter une recrudescence tardive des ruptures dans le groupe des patients dépistés. Il n’y a pas de données à l’heure actuelle supportant cette hypothèse et notamment parce que l’espérance de vie chez ces patients certes plus jeunes mais à plus haut risque cardiovasculaire n’est pas forcément meilleure.
Bénéfice sur la survie
Le dépistage de l’AAA chez les hommes âgés > 65 ans réduit la mortalité globale et/ou la mortalité liée à l’AAA de la population dépistée à court et long terme. Il n’y a cependant aucune donnée dans la littérature qui adresse spécifiquement le bénéficie de survie dans le cadre du dépistage opportuniste des AAA. Le dépistage dans une sous-population de patients à risque (patients coronariens) devrait théoriquement améliorer le rendement du screening. De plus, les anévrysmes détectés par le dépistage opportuniste sont globalement de plus grande taille que ceux détectés par le dépistage conventionnel, probablement en raison du plus grand nombre de facteurs de risque de ces patients.
Il serait cependant simpliste de déduire que le haut rendement attendu s’accompagnera de facto d’une baisse de la mortalité. En effet les patients appartenant à cette sous-population présentent un risque accru de décès en lien avec la procédure interventionnelle de correction de l’AAA (ouverte ou endovasculaire) et le dépistage chez ces patients pourrait ne pas être associé à un bénéfice de survie. Il faut cependant souligner le fait que plus de la moitié des patients chez qui un AAA grande taille est découvert par le screening opportuniste ne bénéficieront pas d’un traitement correctif, parce qu’ils refuseront l’intervention chirurgicale ou endovasculaire, qu’ils ne seront pas orientés vers un geste interventionnel en raison de comorbidités ou bien qu’ils seront récusés par l’équipe chirurgicale9. Enfin, plusieurs études récentes ont montré une chute de la prévalence des AAA dans la population générale et ce paramètre pourrait diluer le bénéfice de survie associé au dépistage dans la population générale et valoriser le dépistage dans des populations ciblées à plus haut risque et notamment dans le groupe des patients coronariens où la prévalence de l’affection reste élevée.
Coût du dépistage opportuniste
Les coûts engendrés par le dépistage peuvent être directs (facturation de l’examen de dépistage au système national de soins de santé, à l’organisme assureur ou au patient lui-même) ou indirects (absentéisme professionnel du patient ou de son entourage qui l’accompagne à l’examen, frais de déplacement). Le dépistage opportuniste de l’AAA durant l’échocardiographie est une extension de l’examen échocardiographique de routine et n’est dès lors pas un examen facturable en soi. Le faible allongement de la durée de l’examen cardiologique (moins de 3 minutes en moyenne) a peu d’impact sur la rentabilité de l’examen cardiologique. Il n’y a dès lors pas de surcoût direct, ni pour le patient, ni pour la société. Les coûts indirects liés au déplacement du patient sont nuls, celui-ci étant déjà sur place.
Les autres coûts à prendre en considération sont ceux liés aux examens de suivi et aux éventuels interventions correctrices proposés aux patients chez qui le dépistage a mis en évidence la présence d’un AAA. Plusieurs études ont prouvé que le dépistage échographique conventionnel des AAA dans des populations ciblées était rentable, y compris dans des régions où la prévalence des AAA est en diminution et à l’ère des traitements endovasculaires. La rentabilité du dépistage opportuniste de l’AAA a été démontrée dans le cadre de l’échographie vasculaire réalisée pour artériopathie périphérique mais n’a jamais été étudiée spécifiquement lorsque celui-ci est associé à l’échocardiographie. Au vu des divers arguments avancés ci-dessus, une rentabilité supérieure à celle du dépistage conventionnel est attendue pour le dépistage opportuniste durant l’échocardiographie.
Effets indésirables liés au dépistage
À côté des bénéfices escomptés, il existe cependant des désagréments et des risques potentiellement associés au dépistage opportuniste. Un de ceux-ci est représenté par le stress psychologique engendré par la découverte d’une affection potentiellement létale, requérant un suivi dans le temps ou une intervention à court terme. Ceci est vrai pour tous les programmes de dépistage des AAA qu’ils soient opportunistes ou non.
Le risque principal lié au dépistage de l’AAA reste cependant l’exposition du patient à une intervention inutile, présentant elle-même un risque létal. Une intervention correctrice inutile est défi nie par une cure d’AAA chez un patient qui serait mort d’une autre cause avant la survenue de la rupture. Cette notion est particulièrement importante lorsqu’on diagnostique un AAA chez un patient âgé ou un patient porteur d’une comorbidité signifi cative, telle qu’une cardiopathie ischémique. Les complications cardiaques sont en effet responsables de près de 40% des décès secondaires à la cure chirurgicale de l’AAA. Cette mortalité est essentiellement consécutive à des cardiopathies méconnues au moment de la chirurgie. Si la coronaropathie est connue et correctement traitée avant la correction chirurgicale d’un AAA, le risque opératoire est faible de l’ordre de 1% et ne semble pas supérieur au risque opératoire de la population générale des patients porteurs d’un AAA.
Par définition, si le dépistage est ciblé sur le groupe des patients coronariens et réalisé par le cardiologue, on peut estimer dans ce cas que la cardiopathie est, d’une part, connue et, d’autre part, correctement suivie. Enfin l’avènement depuis plusieurs années des techniques endovasculaires est associé à une diminution de la mortalité péri-procédurale, particulièrement chez les patients âgés et les patients à risque. Cette technique devrait dès lors être privilégiée chez le patient coronarien âgé dont l’anatomie est favorable à un traitement endovasculaire.
Conclusions
Le dépistage opportuniste de l’AAA durant l’échographie transthoracique de routine est réalisable à faible coût chez la majorité des patients. Il apparait que la sensibilité et la spécificité de l’examen dans la détection de l’AAA sont satisfaisantes et que sa réalisation durant l’échocardiographie n’engendre qu’une perte de temps marginale (de l’ordre de 2 minutes en moyenne) et ne requiert pas d’expérience préalable en échographie vasculaire. Il existe un certain nombre d’évidences dans la littérature pour proposer le dépistage opportuniste de l’AAA durant l’échocardiographie chez tous les hommes âgés de plus de 65 ans, particulièrement en présence de facteurs de risque (antécédent de tabagisme, histoire familiale d’AAA, présence d’un anévrysme de l’aorte ascendante ou de la racine aortique). En raison de la prévalence élevée de l’AAA chez le patient coronarien, la population cible chez qui ce dépistage est réalisé pourrait être élargie à l’ensemble des patients de sexe masculin porteurs d’une maladie coronarienne avérée indépendamment de leur âge. Des études supplémentaires et notamment des études prospectives randomisées ou de cohorte incluant des échantillons de grande taille avec un suivi à court et long terme sont cependant requises afin de valider le bénéfice clinique du dépistage opportuniste réalisé dans cette configuration.
L’auteur déclare ne pas avoir de liens d’intérêts avec cet article
Rodolphe Durieux, Chirurgie cardio-vasculaire et thoracique, CHU de Liège
RÉFÉRENCES
1. Durieux R, Van Damme H, Labropoulos N, Yazici A, Legrand V, Albert A, et al. High prevalence of abdominal aortic aneurysm in patients with three-vessel coronary artery disease. Eur J Vasc Endovasc Surg Off J Eur Soc Vasc Surg 2014;47:273–8. https://doi.org/10.1016/j.ejvs.2013.12.011.
2. Hernesniemi JA, Vänni V, Hakala T. The prevalence of abdominal aortic aneurysm is consistently high among patients with coronary artery disease. J Vasc Surg 2015;62:232-240.e3. https://doi.
org/10.1016/j.jvs.2015.02.037.
3. Cueff C, Keenan NG, Krapf L, Steg PG, Cimadevilla C, Ducrocq G, et al. Screening for abdominal aortic aneurysm in coronary care unit patients with acute myocardial infarction using portable transthoracic echocardiography. Eur J Echocardiogr 2012;13:574–8. https://doi.org/10.1093/ejechocard/jer260.
4. Matsumura Y, Wada M, Hirakawa D, Yasuoka Y, Morimoto N, Takeuchi H, et al. Clinical utility of transthoracic echocardiography for screening abdominal aortic aneurysm: a prospective study in a Japanese population. Cardiovasc Ultrasound 2016;14:8. https://doi.org/10.1186/s12947-016-0051-x.
5. Aboyans V, Bataille V, Bliscaux P, Ederhy S, Filliol D, Honton B, et al. Effectiveness of Screening for Abdominal Aortic Aneurysm During Echocardiography. Am J Cardiol 2014;114:1100–4. https:// doi.org/10.1016/j.amjcard.2014.07.024.
6. Kato T, Ishida S, Miyamoto S, Iura T, Ban Y, Fujikawa J, et al. A Propensity Score-Matching Analysis of Transthoracic Echocardiography and Abdominal Ultrasonography for the Detection of Abdominal Aortic Aneurysms. Clin Med Insights Cardiol 2015;9:11–5. https://doi.org/10.4137/CMC.S23166.
7. Dupont A, Elkalioubie A, Juthier F, Tagzirt M, Vincentelli A, Le Tourneau T, et al. Frequency of Abdominal Aortic Aneurysm in Patients Undergoing Coronary Artery Bypass Grafting. Am J Cardiol 2010;105:1545–8. https://doi.org/10.1016/j.amjcard.2010.01.011.
8. Guirguis-Blake JM, Beil TL, Senger CA, Coppola EL. Primary Care Screening for Abdominal Aortic Aneurysm: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA 2019;322:2219–38. https://doi.org/10.1001/jama.2019.17021.
9. Majeed K, Hamer AW, White SC, Pegg TJ, Wilkins GT, Williams SM, et al. Prevalence of abdominal aortic aneurysm in patients referred for transthoracic echocardiography. Intern Med J 2015;45:32–9. https://doi.org/10.1111/imj.12592.
