
Peut-on vraiment attendre des médicaments pour traiter l’obésité ?
Le titre de cet article suggéré par mes collègues cardiologues laisse planer le doute sur une question déjà résolue chez les médecins nutritionnistes. Une revue systématique avec méta analyse en réseau vient de paraître dans le Lancet et elle confirme cette assertion1 ; les auteurs ont conclu que l’association phentermine-topiramate (non disponible en France) et les analogues du GLP-1 semblent être les molécules les plus intéressantes pour traiter l’excès de poids après avoir identifié 143 essais randomisés contrôlés soit plus de 49 000 patients en surpoids ou en situation d’obésité au total.
La plupart des cibles des médicaments anti-obésité sont situées au niveau du système nerveux central et en particulier au niveau de l’hypothalamus qui est la région clef de la régulation de la prise alimentaire et du signal de satiété. Leur intérêt est évident tant les bénéfices des mesures hygiéno diététiques est difficiles à obtenir, à maintenir dans le temps et insuffisants pour modifier drastiquement la trajectoire des personnes présentant une obésité sévère (IMC > 40 kg/m2 ) 2 . Dans cette situation, il n’y a eu longtemps, comme seule proposition thérapeutique, que la chirurgie bariatrique dont le rapport bénéfice/risque est très favorable.
Les médicaments anti-obésité existent depuis longtemps mais ils ont été largement décriés à juste titre en raison d’un rapport bénéfice/risque très nettement défavorable. Le scandale du benfluorex n’a rien fait pour améliorer la mauvaise réputation de ces traitements3,4. La seule molécule longtemps disponible en France a été l’orlistat (commercialisé sous les deux noms de Xenical et Ally). Il s’agit d’un inhibiteur de la lipase intestinale entraînant une malabsorption des graisses. Il est assez mal toléré sur le plan digestif et responsable dans les grands essais cliniques d’une perte de poids d’environ 3-4 kg ce qui est apparu un bénéfice pondéral insuffisant pour la HAS qui ne recommande pas son utilisation5 .
L’association phentermine-topiramate commercialisée sous le nom de Qsymia depuis 2012 aux USA a été longtemps le médicament le plus efficace dans l’obésité. Dans l’étude CONQUER, cette association montrait une perte de poids de 7 à 9 kg de plus que le placebo (-1 kg)6 . Une contraception est nécessaire car ce médicament est responsable d’une augmentation des fentes labio palatines et il ne faut pas l’utiliser en cas de glaucome à angle fermé. Les autres effets secondaires moins graves mais fréquents sont des paresthésies, des vertiges, une sécheresse buccale voire une dysgueusie, une insomnie et une constipation. Il n’est pas prévu, à ma connaissance, de commercialisation de cette association en Europe et encore moins en France.
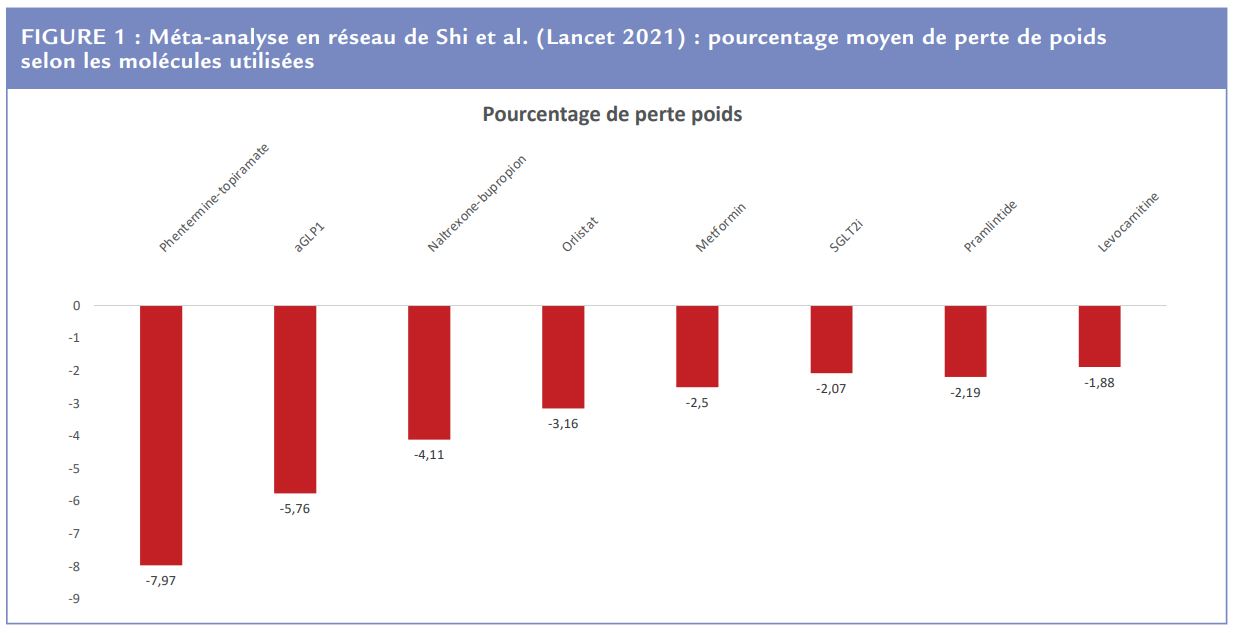
Depuis l’étude LEADER dans le diabète de type 2, les analogues du GLP-1 retiennent l’attention en raison de leur effet antidiabétique mais surtout de leurs bénéfices cardiovasculaire7 et rénal8 . Une perte de poids associée aux effets bénéfiques du liraglutide avait été observée et a conduit à des essais dans l’obésité (hors diabète, programme SCALE) avec une dose plus importante de 3 mg par jour (versus 1,8 mg dans le diabète de type 2)9 . Le bénéfice pondéral dans ces essais est de l’ordre de 7 kg de plus que le placebo avec des effets indésirables attendus quand on connaît le mode d’action des analogues du GLP-1 : nausées, vomissements, constipation ou diarrhée, asthénie. Il faut signaler un risque accru de lithiase biliaire, voire de pancréatite aigüe et, par ailleurs, de cancer médullaire de la thyroïde contre-indiquant cette classe en cas d’antécédent de NEM2. Les progrès de pharmacocinétique ont conduit à développer de nouveaux analogues du GLP1 dont le plus prometteur actuellement est le semaglutide (programme STEP)10. Il est de longue durée d’action et ne nécessite qu’une seule injection sous-cutanée hebdomadaire. Il a d’abord été développé dans le traitement du diabète de type 2 (Ozempic, 1mg par semaine) puis il a été étendu au traitement de l’obésité à des doses plus élevées (Wegovy, 2,4 mg par semaine) avec un bénéfice pondéral majeur de l’ordre de 10 à 15 % de perte de poids. Les bénéfices pondéraux du liraglutide ont conduit à une autorisation de mise sur le marché Européenne dès mars 2015 sous le nom commercial SAXENDA dans l’indication obésité (IMC > 30 kg/m2 ) et même surpoids (IMC > 27 kg/m2) à condition que celui-ci soit compliqué de comorbidités
(https://www.ema.europa.eu/en/medicines/human/EPAR/saxenda#authorisation-details-section).
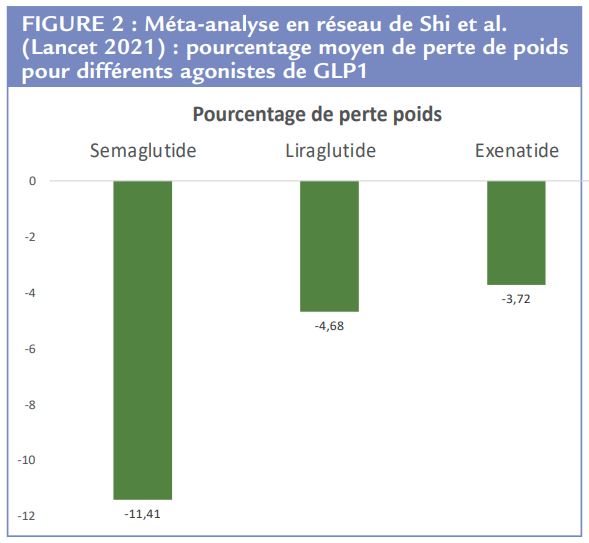
Le Saxenda est commercialisé en France dans ces indications depuis mars 2021 mais sans remboursement par l’Assurance Maladie ce qui complique considérablement la prescription de ce traitement. La posologie de Saxenda est progressive. La dose d’entretien ne doit pas dépasser 3 mg de liraglutide par jour et le traitement doit être interrompu après 12 semaines si les patients n’ont pas perdu au moins 5 % de leur poids initial. Concernant le semaglutide à 2,4 mg hebdomadaire (Wegovy), l’agence européenne a rendu une « opinion positive » sur le traitement dans les mêmes indications que le liraglutide 3 mg quotidien mais l’autorisation de mise sur le marché n’est pas encore validée (https://www.ema.europa.eu/en/medicines/human/summaries-opinion/wegovy).
En France, un remboursement sera possible dans le cadre d’une autorisation temporaire d’utilisation (ATU) de cohorte en cours de négociation avec l’assurance maladie et le laboratoire NovoNordisk. L’indication sera vraisemblablement celle des obésités sévères (IMC > 40 kg/m2 ) et avec prescription initiale émanant de médecins exerçant dans les Centres Spécialisés Obésité du territoire (37 CSO en France).
Ainsi, la balance bénéfice/risque s’est largement inversée avec l’avènement de la classe thérapeutique des analogues du GLP-1 et même des bi- ou tri-analogues qui devraient être disponibles dans les prochaines années. L’étude SURPASS-1 a montré un bénéfice pondéral majeur avec les doubles agonistes GLP-1/GIP (tirzepatide) chez des patients diabétiques de type 211 ; le programme de développement dans l’obésité s’appelle SURMOUNT et les premiers résultats devraient être disponibles en 2022.
Les questions qui restent sans réponse sont plutôt celles de la question du financement de ces médicaments, de la durée nécessaire de traitement et des populations cibles qui devraient en priorité bénéficier de ces traitements.
Claire Carette déclare les liens d’intérêts suivants : Travaux d’expertise, conférences rémunérées et invitations à des congrès par les laboratoires Novo Nordisk, Astra Zeneca, Lilly, Pfi zer, Novartis, MSD, IPSEN
Claire Carette, Service de Nutrition, Centre Spécialisé Obésité, Hôpital Européen Georges Pompidou, APHP. Centre-Université de Paris
RÉFÉRENCES
- Shi Q, Wang Y, Hao Q, Vandvik PO, Guyatt G, Li J, et al. Pharmacotherapy for adults with overweight and obesity: a systematic review and network meta-analysis of randomised controlled trials. The Lancet [Internet]. 2021 Dec 8 [cited 2021 Dec 13];0(0). Available from: https://www.thelancet.com/journals/lancet/article/PIIS0140- 6736(21)01640-8/fulltext
- Bray GA, Heisel WE, Afshin A, Jensen MD, Dietz WH, Long M, et al. The Science of Obesity Management: An Endocrine Society Scientific Statement. Endocr Rev. 2018 Apr 1;39(2):79–132.
- Weill A, Païta M, Tuppin P, Fagot J-P, Neumann A, Simon D, et al. Benfluorex and valvular heart disease: a cohort study of a million people with diabetes mellitus. Pharmacoepidemiol Drug Saf. 2010 Dec;19(12):1256–62.
- Frachon I, Etienne Y, Jobic Y, Le Gal G, Humbert M, Leroyer C. Benfluorex and unexplained valvular heart disease: a case-control study. PLoS ONE. 2010;5(4):e10128.
- Obesite_adulte_argumentaire – 2011_09_30_obesite_adulte_argumentaire.pdf [Internet]. [cited 2013 Feb 22]. Available from: http://www.has-sante.fr/portail/upload/docs/application/pdf/2011-09/2011_09_30_ obesite_adulte_argumentaire.pdf
- Gadde KM, Allison DB, Ryan DH, Peterson CA, Troupin B, Schwiers ML, et al. Effects of low-dose, controlledrelease, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo-controlled, phase 3 trial. Lancet. 2011 Apr 16;377(9774):1341–52.
- Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JFE, Nauck MA, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016 28;375(4):311–22.
- Mann JFE, Ørsted DD, Brown-Frandsen K, Marso SP, Poulter NR, Rasmussen S, et al. Liraglutide and Renal Outcomes in Type 2 Diabetes. N Engl J Med. 2017 31;377(9):839–48.
- Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2;373(1):11–22.
CORDIAM N°43 DÉCEMBRE 2021
