
Sclérodermie systémique – Ce que le cardiologue doit savoir
La sclérodermie, ou sclérose systémique est une maladie auto-immune caractérisée par la fibrose de la peau, des organes et une atteinte vasculaire. Son étiologie n’est pas connue. 1
Il existe différentes présentations cliniques de la maladie :
– La sclérodermie systémique limitée (CREST syndrome) marquée par une calcinose sous-cutanée, syndrome de Raynaud, atteinte œsophagienne, sclérodactylie, télangiectasie. Dans cette forme, les atteintes viscérales sont rares.
– La sclérodermie systémique diffuse dans les organes : sont atteints la peau, les poumons, le système digestif, les reins et le système cardiovasculaire. Le diagnostic de la sclérodermie répond à certains des critères de la classification EULAR (2013)2 , bien que celle-ci soit surtout utilisée pour la classification et non le diagnostic de la maladie.
La prévalence de la maladie est estimée à 1/10 000 personnes.3 Heine4 , en 1926, est le premier à décrire l’atteinte cardiaque sur l’examen autopsique d’un patient atteint de sclérodermie.
Les trois tuniques cardiaques peuvent être touchées, mais l’atteinte myocardique est prépondérante. L’hypertension pulmonaire marque également un tournant évolutif de cette pathologie.
Le pronostic du patient avec atteinte cardiaque est fortement grevé, selon les séries, la mortalité cardiovasculaire est d’environ 30% chez ces patients.
Dans l’évaluation initiale de cette maladie, les sociétés savantes de rhumatologie recommandent l’évaluation des possibles atteintes des organes cibles.5
Le cardiologue est donc impliqué dans la recherche d’une maladie cardiaque et le dépistage de l’hypertension pulmonaire.
Au cours du suivi, il est recommandé de réaliser une échocardiographie annuelle avec ECG et marqueurs biologiques cardiaques (troponine, BNP), de même une exploration fonctionnelle respiratoire annuelle avec mesure de la diffusion et si besoin cathétérisme cardiaque pour évaluer les pressions pulmonaires.
Atteinte myocardique
L’atteinte myocardique dans la sclérodermie est estimée à 15-38 %6 des patients.
L’analyse tissulaire retrouve de la fibrose en mosaïque secondaire à la fois aux dommages immunologiques et inflammatoires et à de l’ischémie répétée par trouble de la microcirculation coronaire.7
En échocardiographie, on pourra retrouver :
- Une dysfonction systolique ventriculaire gauche, plutôt rare.8 La FEVG peut également être normale et on pourra alors s’aider du strain global longitudinal qui peut être altéré.9 Pour mémoire, le strain global longitudinal de l’adulte chez la personne indemne de cardiopathie est autour de – 20%.
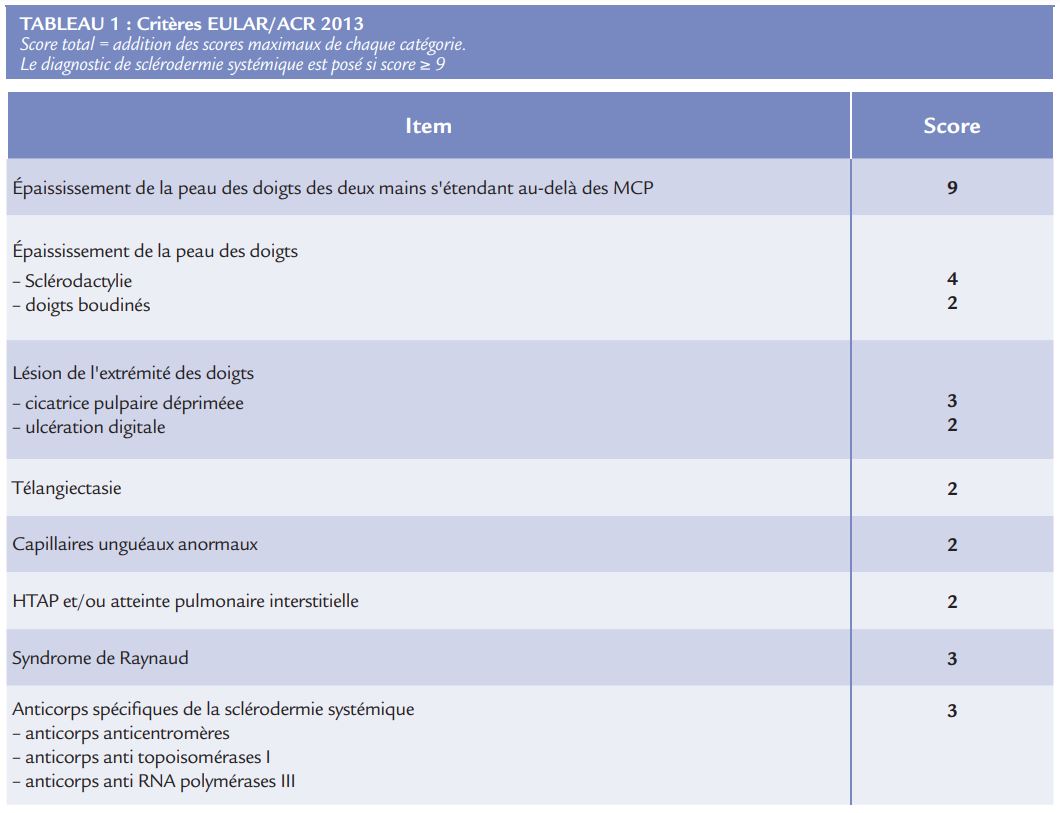
- Une dysfonction diastolique ventriculaire gauche avec une prévalence plus importante (17% d’une étude française)10 avec un pronostic marqué par une plus forte mortalité. Le profi l transmitral montre une diminution de l’onde E, une augmentation du temps de décélération de l’onde E avec une augmentation de l’onde A et une augmentation du temps de relaxation isovolumique (profil type anomalie de la relaxation) (Figure A)
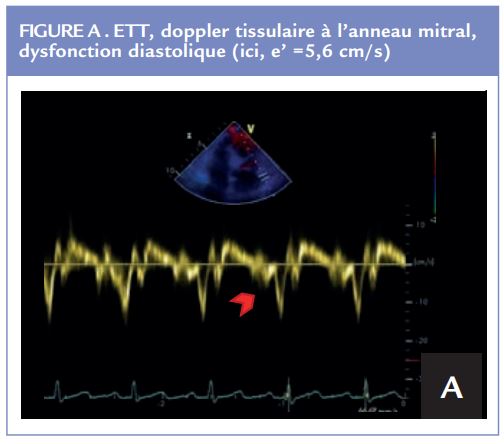
- Une dysfonction ventriculaire droite, systolique et/ou diastolique qu’il conviendra d’évaluer par résonance magnétique. L’ETT aura également un rôle dans l’évaluation du cœur droit : mesure du TAPSE (course systolique de l’anneau tricuspide en mode TM), normal si > 17mm, doppler tissulaire à l’anneau tricuspide (S’ normal > 9cm/s). La fraction de raccourcissement en surface (N > 35%). Le strain du cœur droit fait également partie de l’évaluation du cœur droit mais son utilisation est encore peu pratiquée en routine. (Figure B)
Cette atteinte du cœur droit est habituellement décrite comme conséquence d’une maladie vasculaire pulmonaire avec hypertension pulmonaire. L’utilisation de biomarqueurs peut également être utile dans le dépistage de l’insuffisance cardiaque droite (N pro BNP, cystatine C).11
Le myocarde peut aussi être épaissi (HVG)12 sans aspect spécifique particulier.
Atteinte péricardique
L’atteinte péricardique est décrite dans les séries autopsiques jusqu’à 70% des patients, et jusqu’à 40% des patients dans les séries échocardiographiques13 mais les péricardites cliniques (symptomatiques) sont rapportées dans seulement 7 à 20% des cas chez les patients.14
On notera également une entité, apparaissant en fin d’évolution de la maladie correspondant à une atteinte péricardique secondaire à l’hyperurémie.15 Il est essentiel de dépister l’épanchement péricardique, puisqu’il s’agit d’un des marqueurs de mortalité dans l’évolution de l’hypertension pulmonaire.16
Atteinte endocardique et valvulaire
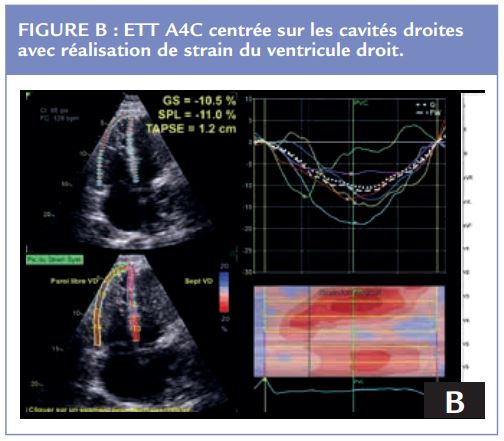
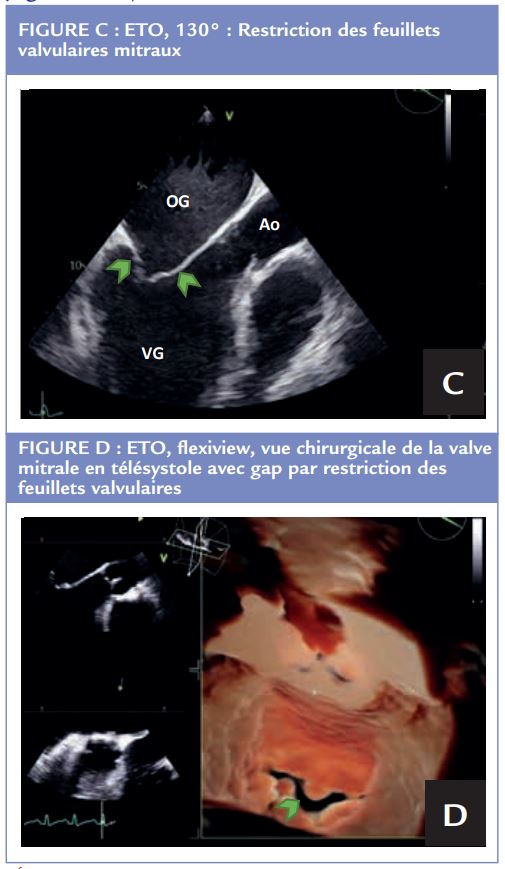
L’atteinte de l’endocarde est rare dans la sclérodermie. Les atteintes valvulaires rares peuvent concerner les valves du cœur gauche avec notamment le prolapsus de la valve mitrale ou encore un rétrécissement aortique dégénératif.17 (Figures C et D)
Des altérations valvulaires avec un épaississement nodulaire ont aussi été rapportées, de même que des atteintes de l’appareil sous valvulaire avec une restriction et un épaississement des cordages tendineux.
Pressions pulmonaires
L’hypertension pulmonaire est un tournant évolutif majeur de la sclérodermie systémique qui grève de manière très péjorative le pronostic des patients.18
L’HTP touche plus fréquemment les patients atteints par la forme cutanée limitée. Une dyspnée, une élévation des peptides natriurétiques et l’élévation des pressions droites en ETT doivent y faire penser.
L’hypertension pulmonaire est suspectée dès lors que la PAPS est > 35mmHg en ETT, estimée selon la formule PAPS = 4(Vmax IT)2 + POD en mmHg. Elle devra être confirmée par mesure invasive par cathétérisme cardiaque, avec un seuil de PAPm > 25mmHg. Ce dernier examen permet aussi de faire la part entre l’origine précapillaire ou post capillaire par la PAPO ou Pcap avec un cut-off a 15mmHg.19 (Figure E)
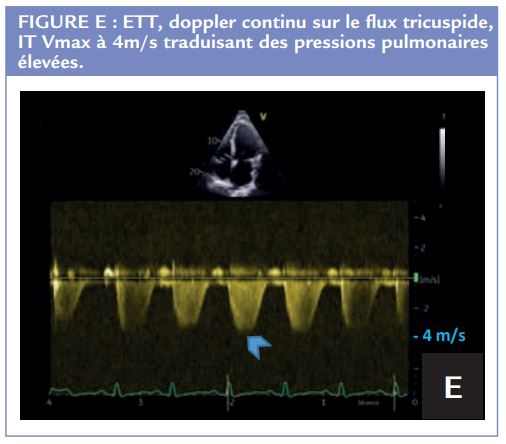
On s’attachera à analyser finement les cavités droites avec des coupes dédiées. Les critères de cœur pulmonaire chronique qui pourront être retrouvées sont : une dilatation du VD (VD/VG > 1), une dilatation du tronc de l’artère pulmonaire et de l’OD, mesure du temps d’accélération sous pulmonaire raccourcie < 90ms, septum paradoxal.
Les critères de mauvais pronostic du cœur pulmonaire chronique sont la présence d’un épanchement péricardique, une surface (indexée) de l’OD augmentée, index d’excentricité VG, altération de la fonction systolique du VD (indices doppler +/- strain VD).
Certaines séries décrivent une absence de fuite tricuspide en ETT ne permettant pas de chiffrer l’HTP jusqu’à 20% des patients.20
On peut essayer d’optimiser le flux de régurgitation tricuspide par l’utilisation de sérum salé ou colloïde agité. Les consensus de recommandations actuels plaident donc en la multiplication des examens de dépistage de cette complication majeure : ETT, EFR, biologie.21
Un algorithme, nommé DETECT a été proposé pour le dépistage de l’HTP chez ces patients.22 Il permet de guider la décision d’aller à l’évaluation invasive des pressions pulmonaires selon 2 étapes incluant des paramètres non échographiques (ECG, biologie, EFR) puis échocardiographiques (Vmax de l’IT, volume cardiaque droit).
L’objectif est de proposer une détection plus précoce de l’HTP et optimiser le recours au cathétérisme. Une évaluation pratique de ce score en centre de compétence23 retrouve une bonne corrélation de l’algorithme à la décision d’une réunion de concertation pluridisciplinaire. En revanche, on note une moindre utilisation de l’ETT et une majoration du nombre de cathétérismes.
Le traitement de l’HTP dans la sclérodermie est non spécifique de cette étiologie et les classes médicamenteuses sont représentées par les antagonistes des récepteurs à l’endothéline, analogues de la prostacycline, IPDE5 et stimulateurs de la guanylate cyclase soluble en monothérapie ou en combinaison.24
Troubles du rythme
Les arythmies sont une des complications cardiaques les plus prévalentes dans la sclérodermie systémique, responsables d’environ 6% des décès attribués à l’atteinte cardiaque.25
Leur développement est dû à l’altération du réseau de conduction et des dommages myocardiques par fibrose.
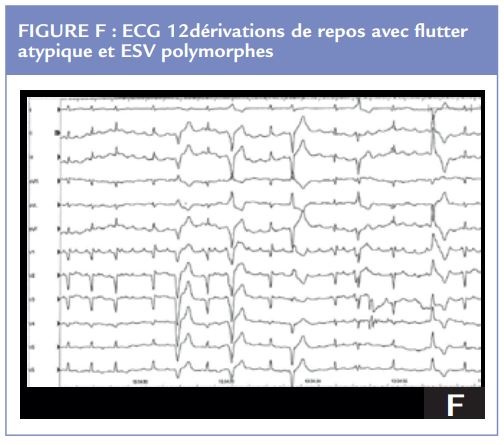
Les types d’arythmie sont variés. D’après l’étude de Ferri26, on retrouve dans cette série : 66% d’arythmie supraventriculaire, 40% d’extrasystoles ventriculaires polymorphes et 90% d’arythmie ventriculaire. (Figure F)
Les troubles de la conduction sont plus rares, et toujours selon cette même série : une prévalence de 16% pour le bloc de branche gauche et 8% pour le bloc auriculo-ventriculaire de premier degré. Le bloc de conduction complet est peu fréquent et seulement quelques cas cliniques sont rapportés dans la littérature.
Points clés
La sclérodermie systémique est une maladie auto-immune, d’étiologie inconnue qui affecte tous les organes.
La tunique myocardique est la plus fréquemment atteinte. Les fonctions systoliques et diastoliques du cœur gauche mais aussi du cœur droit seront systématiquement évaluées lors de l’ETT.
L’hypertension pulmonaire est une complication fréquente et très sévère de la maladie. Le cardiologue est au cœur de son dépistage et son diagnostic par ETT et cathétérisme cardiaque droit.
Les troubles du rythme sont une cause fréquente de mortalité cardiovasculaire dans la sclérodermie et ne devront pas être négligés.
Corentin Bourg, Erwan Donal, Rennes
Les auteurs n’ont pas de liens d’intérêts liés à cet article
RÉFÉRENCES
- Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017 Oct 7;390(10103):1685-1699. doi: 10.1016/S0140-6736(17)30933-9. Epub 2017 Apr 13. PMID: 28413064.
- Van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, Matucci-Cerinic M, Naden RP, Medsger TA Jr, Carreira PE, Riemekasten G, Clements PJ, Denton CP, Distler O, Allanore Y, Furst DE, Gabrielli A, Mayes MD, van Laar JM, Seibold JR, Czirjak L, Steen VD, Inanc M, Kowal-Bielecka O, Müller-Ladner U, Valentini G, Veale DJ, Vonk MC, Walker UA, Chung L, Collier DH, Csuka ME, Fessler BJ, Guiducci S, Herrick A, Hsu VM, Jimenez S, Kahaleh B, Merkel PA, Sierakowski S, Silver RM, Simms RW, Varga J, Pope JE. 2013 classifi cation criteria for systemic sclerosis: an American College of Rheumatology/ European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013 Nov;65(11):2737-47. doi: 10.1002/art.38098. Epub 2013 Oct
- PMID: 24122180; PMCID: PMC3930146. 3. Bossini-Castillo L, López-Isac E, Mayes MD, Martín J. Genetics of systemic sclerosis. Semin Immunopathol. 2015 Sep;37(5):443-51. doi: 10.1007/s00281-015-0499-z. Epub 2015 Jun 2. PMID: 26032405.
- Heine J. Über ein eigenartiges Krankheitsbild von diffuser Skelerosis der Haut und innerer Organe. Virchows Arch Pathol Anat Physiol Klin Med 1926; 262:351–382. doi: 10.1007/BF01892189.
- Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017 Oct 7;390(10103):1685-1699. doi: 10.1016/S0140-6736(17)30933-9. Epub 2017 Apr 13. PMID: 28413064.
- Kahan A, Coghlan G, McLaughlin V. Cardiac complications of systemic sclerosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii45-8. doi: 10.1093/rheumatology/kep110. PMID: 19487224.
- Follansbee WP, Miller TR, Curtiss EI, Orie JE, Bernstein RL, Kiernan JM, Medsger TA Jr. A controlled clinicopathologic study of myocardial fi brosis in systemic sclerosis (scleroderma). J Rheumatol. 1990 May;17(5):656-62. PMID: 2359076.
- De Groote P, Gressin V, Hachulla E, Carpentier P, Guillevin L, Kahan A, Cabane J, Francès C, Lamblin N, Diot E, Patat F, Sibilia J, Petit H, Cracowski JL, Clerson P, Humbert M; ItinerAIR-Scleroderma Investigators. Evaluation of cardiac abnormalities by Doppler echocardiography in a large nationwide multicentric cohort of patients with systemic sclerosis. Ann Rheum Dis. 2008 Jan;67(1):31-6. doi: 10.1136/ ard.2006.057760. Epub 2007 Jan 31. PMID: 17267515.
- Sade LE, Akdogan A. Imaging for screening cardiovascular involvement in patients with systemic rheumatologic diseases: more questions than answers. Eur Heart J Cardiovasc Imaging. 2019 Sep 1;20(9):967-978. doi: 10.1093/ehjci/jez171. PMID: 31230066.
- De Groote P, Gressin V, Hachulla E, Carpentier P, Guillevin L, Kahan A, Cabane J, Francès C, Lamblin N, Diot E, Patat F, Sibilia J, Petit H, Cracowski JL, Clerson P, Humbert M; ItinerAIR-Scleroderma Investigators. Evaluation of cardiac abnormalities by Doppler echocardiography in a large nationwide multicentric cohort of patients with systemic sclerosis. Ann Rheum Dis. 2008 Jan;67(1):31-6. doi: 10.1136/ ard.2006.057760. Epub 2007 Jan 31. PMID: 17267515.
- Nie LY, Wang XD, Zhang T, Xue J. Cardiac complications in systemic sclerosis: early diagnosis and treatment. Chin Med J (Engl). 2019 Dec 5;132(23):2865-2871. doi: 10.1097/CM9.0000000000000535. PMID: 31856059; PMCID: PMC6940066.
- Hegedüs I, Czirják L. Left ventricular wall thickness and disease duration in systemic sclerosis. Postgrad Med J. 1993 Apr;69(810):285-90. doi: 10.1136/pgmj.69.810.285. PMID: 8321792; PMCID: PMC2399657.
- Byers RJ, Marshall DA, Freemont AJ. Pericardial involvement in systemic sclerosis. Ann Rheum Dis 1997;56:393–394. doi: 10.1136/ ard.56.6.393.
- Champion HC. The heart in scleroderma. Rheum Dis Clin North Am. 2008 Feb;34(1):181-90; viii. doi: 10.1016/j.rdc.2007.12.002. PMID: 18329539; PMCID: PMC2361099.
- Buleu F, Sirbu E, Caraba A, Dragan S. Heart Involvement in Infl ammatory Rheumatic Diseases: A Systematic Literature Review. Medicina (Kaunas). 2019 Jun 6;55(6):249. doi: 10.3390/medicina55060249. PMID: 31174287; PMCID: PMC6632037.
- Dunne JV, Chou JP, Viswanathan M, Wilcox P, Huang SH. Cardiac tamponade and large pericardial effusions in systemic sclerosis: a report of four cases and a review of the literature. Clin Rheumatol 2011;30:433–438. doi: 10.1007/s10067-010-1667-0.
- Nie LY, Wang XD, Zhang T, Xue J. Cardiac complications in systemic sclerosis: early diagnosis and treatment. Chin Med J (Engl). 2019 Dec 5;132(23):2865-2871. doi: 10.1097/CM9.0000000000000535. PMID: 31856059; PMCID: PMC6940066.
- Sobanski V, Giovannelli J, Lynch BM, et al. Characteristics and survival of anti-U1 RNP antibody-positive patients with connective tissue disease-associated pulmonary arterial hypertension. Arthritis Rheumatol 2016; 68: 484–93.
- Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, Simonneau G, Peacock A, Vonk Noordegraaf A, Beghetti M, Ghofrani A, Gomez Sanchez MA, Hansmann G, Klepetko W, Lancellotti P, Matucci M, McDonagh T, Pierard LA, Trindade PT, Zompatori M, Hoeper M; ESC Scientifi c Document Group. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016 Jan 1;37(1):67-119. doi: 10.1093/eurheartj/ehv317. Epub 2015 Aug 29. PMID: 26320113.
- Fisher MR, Forfi a PR, Chamera E, Housten-Harris T, Champion HC, Girgis RE, Corretti MC, Hassoun PM. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Respir Crit Care Med. 2009 Apr 1;179(7):615-21. doi: 10.1164/rccm.200811-1691OC. Epub 2009 Jan 22. PMID: 19164700; PMCID: PMC2720125.
- Khanna D, Gladue H, Channick R, Chung L, Distler O, Furst DE, Hachulla E, Humbert M, Langleben D, Mathai SC, Saggar R, Visovatti S, Altorok N, Townsend W, FitzGerald J, McLaughlin VV; Scleroderma Foundation and Pulmonary Hypertension Association. Recommendations for screening and detection of connective tissue disease-associated pulmonary arterial hypertension. Arthritis Rheum. 2013 Dec;65(12):3194- 201. doi: 10.1002/art.38172. PMID: 24022584; PMCID: PMC3883571.
- Coghlan JG, Denton CP, Grünig E, Bonderman D, Distler O, Khanna D, Müller-Ladner U, Pope JE, Vonk MC, Doelberg M, Chadha-Boreham H, Heinzl H, Rosenberg DM, McLaughlin VV, Seibold JR; DETECT study group. Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Ann Rheum Dis. 2014 Jul;73(7):1340-9. doi: 10.1136/annrheumdis-2013-203301. Epub 2013 May 18. PMID: 23687283; PMCID: PMC4078756.
- Coirier, V., Lescoat, A., Cazalets, C., Coiffi er, G., Jouneau, S., Chabanne, C., … & Jego, P. (2016). Impact de l’utilisation de l’algorithme DETECT au cours de la sclérodermie systémique: étude transversale sur 117 patients comparant les pratiques actuelles d’un centre de compétence français à celles bientôt recommandées par ce nouvel outil de dépistage. La Revue De Médecine Interne, 37, A76.
- Kowal-Bielecka O, Fransen J, Avouac J, Becker M, Kulak A, Allanore Y, Distler O, Clements P, Cutolo M, Czirjak L, Damjanov N, Del Galdo F, Denton CP, Distler JHW, Foeldvari I, Figelstone K, Frerix M, Furst DE, Guiducci S, Hunzelmann N, Khanna D, Matucci-Cerinic M, Herrick AL, van den Hoogen F, van Laar JM, Riemekasten G, Silver R, Smith V, Sulli A, Tarner I, Tyndall A, Welling J, Wigley F, Valentini G, Walker UA, Zulian F, Müller-Ladner U; EUSTAR Coauthors. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017 Aug;76(8):1327-1339. doi: 10.1136/ annrheumdis-2016-209909. Epub 2016 Nov 9. PMID: 27941129.
- Tyndall AJ, Bannert B, Vonk M, Airò P, Cozzi F, Carreira PE, Bancel DF, Allanore Y, Müller-Ladner U, Distler O, Iannone F, Pellerito R, Pileckyte M, Miniati I, Ananieva L, Gurman AB, Damjanov N, Mueller A, Valentini G, Riemekasten G, Tikly M, Hummers L, Henriques MJ, Caramaschi P, Scheja A, Rozman B, Ton E, Kumánovics G, Coleiro B, Feierl E, Szucs G, Von Mühlen CA, Riccieri V, Novak S, Chizzolini C, Kotulska A, Denton C, Coelho PC, Kötter I, Simsek I, de la Pena Lefebvre PG, Hachulla E, Seibold JR, Rednic S, Stork J, Morovic-Vergles J, Walker UA. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010 Oct;69(10):1809-15. doi: 10.1136/ard.2009.114264. Epub 2010 Jun 15. PMID: 20551155.
- Ferri C, Bernini L, Bongiorni MG, Levorato D, Viegi G, Bravi P, Contini C, Pasero G, Bombardieri S. Noninvasive evaluation of cardiac dysrhythmias, and their relationship with multisystemic symptoms, in progressive systemic sclerosis patients. Arthritis Rheum. 1985 Nov;28(11):1259-66. doi: 10.1002/art.1780281110. PMID: 4063000.
CORDIAM N°43 DÉCEMBRE 2021
