
CONGRÈS JESFC 2022 – Maladie Coronaire : Au-delà de l’athérosclérose
Session du Vendredi 14 janvier 2022, modérée par le G. Lemesle (Lille) et T. Levasseur (Fréjus).
L’infarctus du myocarde a pris, depuis plusieurs années, une nouvelle dimension avec la reconnaissance de formes « non athérosclérotiques ». Appelés pendant un temps « infarctus à coronaires saines », ces infarctus du myocarde à coronarographie macroscopiquement normale ont ensuite pris l’acronyme moins tendancieux de MINOCA (Myocardial Infarction with Non Obstructive Coronary Arteries).1 En effet, on sait maintenant grâce à l’apport de l’imagerie endocoronaire que les artères coronaires dans ces MINOCA ne sont pas « saines » : dysfonction microcirculatoire, spasme, dissection,…2 Voilà autant de mécanismes impliqués dans les atteintes coronaires du MINOCA, qui sont détaillés dans cette session.
Dissection coronaire spontanée
La dissection coronaire spontanée (SCAD) est un des mécanismes décrit de MINOCA. Alors qu’elle est relativement rare en population générale (<1% des infarctus), elle représente une proportion non négligeable des infarctus de la femme jeune (environ 30% avant 50 ans) et de la femme enceinte. Dans la plupart des cas, un stress physique, émotionnel, médicamenteux est décrit immédiatement avant l’infarctus. L’anomalie structurelle de l’artère est souvent retrouvée dans d’autres localisations extra-coronaires (plus de la moitié des cas selon le registre DISCO : dysplasie rénale ?) et parfois associée à une cause génétique.3,4 Le mécanisme physiopathologique de la SCAD implique une séparation de l’intima et de la média avec déchirure intimale (c’est le « fl ap ») ou sans déchirure (c’est l’hématome de paroi en lien avec une hémorragie du vasa vasorum).
Le diagnostic repose en tout premier lieu sur la coronarographie. Cinq signes angiographiques permettent d’orienter le diagnostic : l’absence d’athérome, la visualisation d’un fl ap intraluminal, une lésion longue avec réduction linéaire du calibre (aspect de « phasme » ou occlusion en « queue de radis »), une stagnation du produit de contraste et enfin un début/une fin au niveau d’une bifurcation. En cas de doute, et seulement dans ce cas, l’imagerie intra-coronaire (OCT de préférence) peut être proposée sans être dénuée de risques : en particulier l’extension iatrogène de la dissection…
Le traitement doit à tout prix et en l’absence d’état de choc rester conservateur (i.e : mono antiagrégation plaquettaire ou double antiagrégation < 2-4 semaines, pas d’anticoagulants). Si le flux reste TIMI 2-3, il convient de s’abstenir de toute angioplastie du fait du risque d’extension de la dissection en aval ou en amont puis d’occlusion de la lumière par le faux chenal.
L’évolution est le plus souvent simple à la phase aiguë avec une mortalité faible. Pourtant, les récidives d’angor ou d’infarctus sont fréquentes (entre 20 et 40% à 4 ans selon les registres). Ces récidives sont favorisées par une hypertension artérielle importante associée, une fibrodyplasie authentique ou un stress physique. L’association avec les migraines et la tortuosité coronaire est également décrite. Assez peu de ressources thérapeutiques sont disponibles pour réduire ce taux de récidive, en dehors d’un contrôle tensionnel strict, éventuellement basé sur un traitement bêta-bloquants et une période de repos sportif post infarctus.
Spasme coronaire
L’existence d’un spasme coronaire épicardique est décrit dans 50% des cas chez les patients présentant un MINOCA (dans les séries japonaises possiblement surévaluées par rapport à notre population). La physiopathologie implique de multiples mécanismes (hypercontractilité vasculaire, dysfonction endothéliale, carence en magnésium et anomalie du métabolisme de la rho-kinase, inflammation à bas bruit et stress oxydatif, dysfonction du système nerveux autonome ou polymorphisme génétique). Le facteur le plus décrit est indiscutablement l’association avec le tabac.
Souvent, le spasme survient sur une artère déjà porteuse d’une plaque d’athérome non significative. Le diagnostic repose sur trois facteurs :
– Clinique : angor trinitrosensible la nuit ou le matin avec fluctuation des performances sportives (difficiles le matin) et excellente réponse au traitement par inhibiteurs calciques.
– Electrique : modifications ECG dynamiques pendant l’épisode (sus ou sous ST de plus de 1 mm ou ondes U négatives de novo)
– Angiographique : occlusion totale ou subtotale d’une artère coronaire reproduisant les douleurs avec modifications ECG associées.
Le test de provocation (injection d’Ergonovine intra coronaire pendant 2-5 minutes dans l’IVA puis la coronaire droite puis injection de dérivés nitrés pour tester la régression du spasme) est indiqué chez les patients présentant un angor nocturne, un MINOCA, une mort subite ou syncope inexpliquée ou un angor persistant post angioplastie (grade I).
Le traitement comprend un sevrage tabagique (impératif !) associé à des inhibiteurs calciques (bithérapie associant un inhibiteur calcique bradycardisant et non bradycardisant), des nitrés si besoin ou en patch et en cas d’athérôme : une bithérapie statines et aspirine. Chez les patients ayant présenté une mort subite attribuée à un spasme coronaire (et ce point est souvent difficile à prouver), l’implantation d’un défibrillateur est nécessaire.
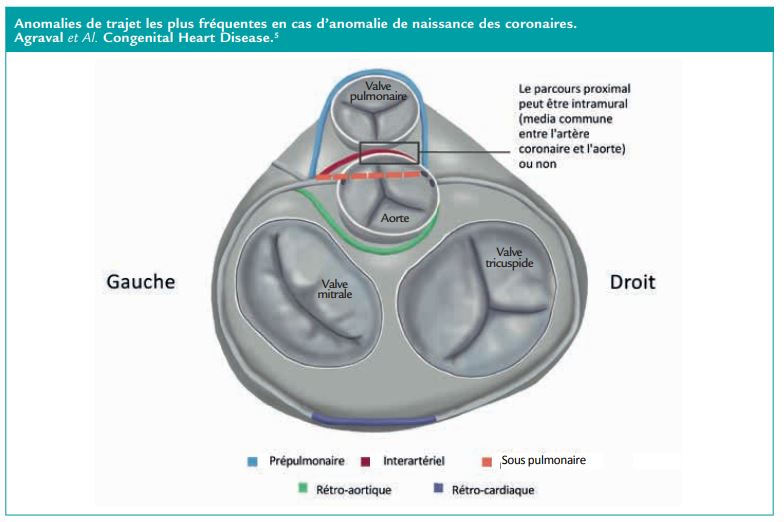
Anomalie de naissance des coronaires congénitales (ANOCOR)
La prévalence des ANOCOR est estimée à 0,5% par la coronarographie et 1% par le coroscanner, touchant dans la majorité des cas l’artère circonflexe, puis l’artère coronaire droite et enfin plus rarement l’IVA. Les anomalies les plus fréquentes chez l’adulte sont les anomalies de connexion de l’artère coronaire à l’aorte (par exemple coronaire droite naissant du sinus gauche). Les anomalies de départ de l’artère pulmonaire et non de l’aorte sont diagnostiquées dans l’enfance du fait de leur gravité.
Certaines ANOCOR sont associées à un risque ischémique du fait de leur trajet pathologique, en particulier le trajet inter-artériel (pré-aortique ou inter-aortico-pulmonaire) et le trajet sous pulmonaire. Le trajet inter-artériel est porteur de risque particulièrement du fait de la grande probabilité de trajet intra mural de l’artère (c’est-à-dire que la coronaire et l’aorte partagent la même média sans être séparées par l’adventice). Cette forme d’ANOCOR avec trajet intra-mural est particulièrement à risque d’évènements cardiovasculaires.
Le diagnostic repose sur le coroscanner principalement avec un intérêt notable de l’IVUS pour détecter les trajets intra-muraux. Le traitement est peu consensuel et repose d’abord sur une stratification du risque d’évènements incluant l’âge, le niveau de sport, la présentation clinique, les critères scanographiques de gravité et les résultats d’un test d’ischémie couplé à une imagerie. La chirurgie est nécessaire chez les patients porteurs d’une anomalie de naissance concernant l’IVA avec angor typique et test d’ischémie positif dans le même territoire ou anatomie à haut risque. L’angioplastie n’est pas recommandée dans ce cadre. Plusieurs techniques chirurgicales sont possibles mais le pontage doit être évité du fait de l’absence d’obstacle en amont et donc du haut risque d’obstruction progressive du pontage ! La décision thérapeutique doit de toute façon reposer sur l’analyse du dossier par la Heart-Team d’un centre expert.
Comment pousser les explorations dans le MINOCA ?
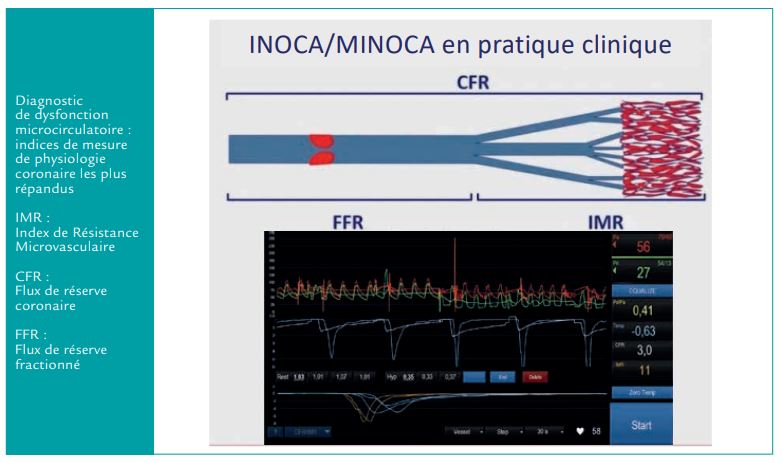
Dans l’angor stable (et non le MINOCA) sans lésion coronaire épicardique (aussi appelé INOCA), une nouvelle stratégie diagnostique est proposée pour un bilan étiologique angiographique complet.
Ce bilan comprend : une angiographie coronaire simple, en l’absence d’anomalie, on propose la réalisation d’un test de provocation du spasme puis d’une analyse fonctionnelle par guide de FFR et thermodilution (MR : Index de Résistance Microvasculaire – CFR : Flux de réserve coronaire – FFR : Flux de réserve fractionné). Ces 3 étapes doivent permettre de conduire au diagnostic d’angor microvasculaire, angor vasospastique, angor mixte ou absence d’anomalie. Le diagnostic précis permet la mise en place d’un traitement adapté qui améliore les symptômes et la qualité de vie du patient.
En conclusion
Le MINOCA comprend un grand nombre d’entités diagnostiques différentes, chacune pouvant aboutir à un traitement spécifique. L’étiologie du MINOCA doit donc absolument être traquée, au minimum grâce à la réalisation d’une IRM cardiaque et d’une analyse angiographie approfondie (spasme ? dissection coronaire ?). De nouveaux outils fonctionnels plus perfectionnés (CFR, IMR) devraient permettre une amélioration significative du diagnostic d’angor microcirculatoire, jusque-là difficile à prouver dans les MINOCA.
Orianne Weizman, CHRU Nancy
RÉFÉRENCES
- Collet J-P, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. European Heart Journal 2020:ehaa575. https://doi.org/10.1093/eurheartj/ehaa575.
- Reynolds HR, Maehara A, Kwong RY, Sedlak T, Saw J, Smilowitz NR, et al. Coronary Optical Coherence Tomography and Cardiac Magnetic Resonance Imaging to Determine Underlying Causes of MINOCA in Women. Circulation 2020:CIRCULATIONAHA.120.052008. https://doi.org/10.1161/CIRCULATIONAHA.120.052008.
- Motreff P, Malcles G, Combaret N, Barber-Chamoux N, Bouajila S, Pereira B, et al. How and when to suspect spontaneous coronary artery dissection: novel insights from a single-centre series on prevalence and angiographic appearance. EuroIntervention 2017;12:e2236–43. https://doi.org/10.4244/EIJ-D-16-00187.
- Combaret N, Gerbaud E, Dérimay F, Souteyrand G, Cassagnes L, Bouajila S, et al. National French registry of spontaneous coronary artery dissections: prevalence of fi bromuscular dysplasia and genetic analyses. EuroIntervention 2021;17:508–15. https://doi.org/10.4244/EIJ-D-20-01046.
- Agrawal H, Mery CM, Krishnamurthy R, Molossi S. Anatomic types of anomalous aortic origin of a coronary artery: A pictorial summary. Congenital Heart Disease 2017;12:603–6. https://doi. org/10.1111/chd.12518.
