
En direct des JESFC 2022 : Insuffisance cardiaque : toujours penser au ventricule droit !
Dans cette session des JESFC 2022, on s’intéresse au ventricule droit dans l’insuffisance cardiaque. Nous allons traiter successivement, physiopathologie, évaluation échographique et par IRM et enfin prise en charge.
Anatomie et physiopathologie
(d’après la présentation de J. Dreyfus, Saint Denis)
Le ventricule droit (VD) s’intègre dans un circuit à basse pression, couplé avec le retour veineux systémique et la circulation pulmonaire. Sa masse musculaire est très faible, 5 à 6 fois moins importante que celle du ventricule gauche (VG). Sa paroi est composée de 2 types de fibres musculaires dont l’orientation explique le mouvement systolique complexe du VD :
– Superficielles, circonférentielles, en continuité avec le VG et responsables de la contraction radiale du VD.
– Internes, longitudinales, à l’origine de la contraction longitudinale du VD. La cavité peut être séparée en 3 parties :
– La zone d’entrée ou chambre d’admission composée des feuillets tricuspides et de l’appareil sous valvulaire.
– L’apex, zone trabéculée.
– La chambre d’éjection ou conus ou infundibulum pulmonaire, proche de la valve pulmonaire.
Au-delà de la contractilité intrinsèque du VD, il faudra toujours intégrer au raisonnement physiopathologique et donc clinique, la pré- et post-charge VD ainsi que l’interdépendance VD/VG.
La pré-charge, approchée par la pression télédiastolique VD, représente pour faire simple, l’état d’étirement des fibres avant la systole. Comme énoncé par la loi de Franck Starling, plus cet étirement est important et plus le volume d’éjection systolique augmente, jusqu’à une certaine limite. La pré-charge est influencée par la fonction atriale, le retour veineux, la compliance du VD, la contrainte pariétale et la fréquence cardiaque. Contrairement au VG, le VD est très compliant et s’adapte volontiers à une augmentation de pré-charge. Cela revient à dire que pour une même augmentation de volume, l’élévation de la pression intracavitaire sera moins importante que pour le VG.
La post-charge représente la contrainte à l’éjection ou résistances vasculaires pulmonaires. Du fait de sa compliance importante, le VD est très sensible à une augmentation de la post-charge et se laissera ainsi facilement distendre. Néanmoins, contrairement au VG qui tolère seulement une augmentation de pression artérielle moyenne d’environ deux fois la normale, le VD est capable de combattre des niveaux de pression pulmonaire jusqu’à 5-6 fois son régime de base, comme dans l’hypertension pulmonaire. L’objectif des cavités droite est de, quelles que soient les conditions de charge, maintenir un débit cardiaque et donc un volume d’éjection systolique (VES) suffisant. Initialement, face à une augmentation de post-charge, le VD se dilate et s’hypertrophie afin d’augmenter sa contractilité. On parle de remodelage adaptatif où VES et couplage ventriculo-artériel sont conservés. En cas de pérennisation de ce phénomène, ces mécanismes adaptatifs sont dépassés. Le VD continue de se dilater plus qu’il ne s’hypertrophie : la contractilité et la compliance diminuent faisant diminuer le VES en conséquence. On parle alors de remodelage délétère et découplage ventriculo-artériel. Puisque VD et VG se retrouvent dans la même enveloppe fibreuse péricardique, l’interdépendance VD/VG doit aussi être intégrée. Une surcharge en volume et/ou en pression du VD aura donc forcément un retentissement sur le VG en termes de compliance et de fonction diastolique, et donc in fine, sur la fonction systolique.
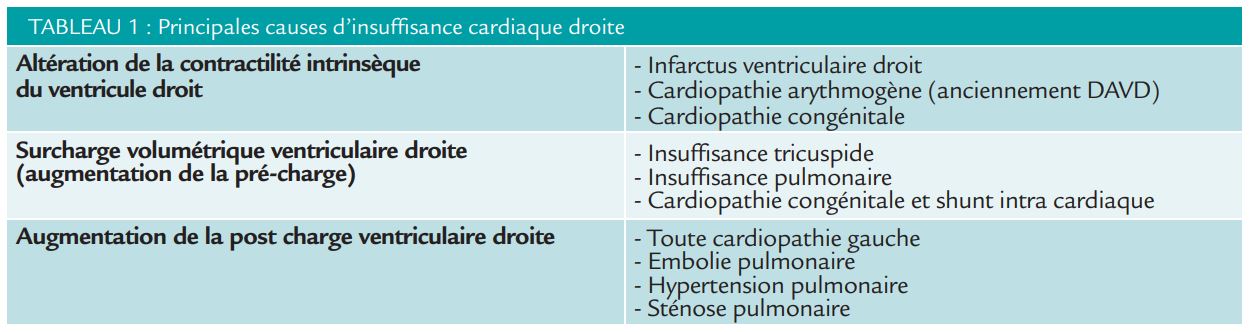
Les principaux mécanismes pouvant entraîner une altération de la fonction cardiaque droite sont résumés dans le tableau 1.
Évaluation échocardiographique du ventricule droit
(d’après la présentation C. Selton-Sutty, Nancy)
Le VD possède un rôle central dans l’insuffisance cardiaque. Il est responsable de la capacité fonctionnelle des patients mais c’est aussi un marqueur pronostique important. L’échographie est le seul outil permettant d’évaluer l’intime relation qui existe entre le VD et l’OD, le VD et la circulation pulmonaire, le VD et le VG. De très nombreux indices échocardiographiques ont été proposés pour cette évaluation. Ils ont tous été évalués et sont pronostiques chez des patients insuffisants cardiaques, même additionnés à un modèle clinique.1
Le tableau 2, résume les différents paramètres de fonction utilisables et leur valeur seuil.2
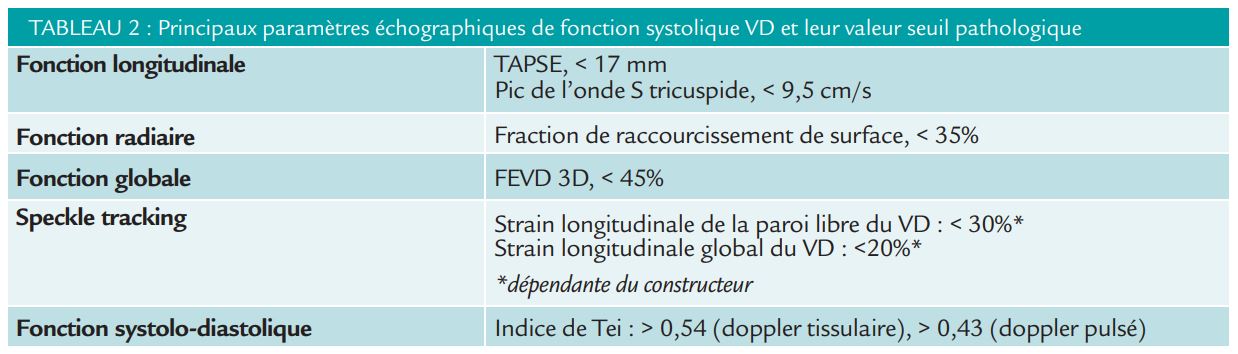
Il faudra toujours garder en tête que tous ces paramètres sont plus ou moins dépendants de la charge. L’idéal serait de pouvoir mesurer l’élastance (télé-systolique et télédiastolique) ventriculaire droite pour approcher au mieux la fonction du VD, non réalisable en pratique clinique courante.3,4
Néanmoins, il est possible d’apprécier le couplage VD – artère pulmonaire en combinant des paramètres de fonction et de charge. Une façon simple est d’analyser la valeur TAPSE et l’aspect du flux sous pulmonaire. Si le TAPSE est altérée alors que le flux sous pulmonaire est normal, c’est plutôt en faveur d’une atteinte primitive droite. Au contraire, si les deux sont altérés, c’est que le VD est désadapté à l’augmentation de post charge.
Ces dernières années, de nombreuses études ont combiné plusieurs paramètres, que ce soit les ratios combinant paramètre de fonction et post charge (ex : TAPSE/ PAPm, TAPSE/ITV IT) ou combinant des paramètres morphologiques avec des paramètres de post charge (ex : PAPs/surface télé-systolique VD).
On pourra retenir le paramètre TAPSE/PAPs, probablement un des plus simples et qui a montré son intérêt pronostique dans l’insuffi sance cardiaque (mortalité toute cause, seuil de 0,35 mm/mmHg) et dans l’hypertension pulmonaire pré- et post-capillaire (seuil de 0,31 mm/mmHg).5-7 Plus récemment, le rapport strain VD/PAPs a été utilisé dans l’insuffisance cardiaque mais aussi dans une sous analyse de l’étude COAPT où ce rapport était pronostique même après correction de la fuite mitrale par clip.8,9
A l’avenir, il faudra donc s’astreindre à intégrer ces paramètres dans l’évaluation échocardiographique de routine. Ceux-ci pouvant être automatisés lors de la réalisation de l’échocardiographie.
La place de l’IRM cardiaque ?
(d’après la présentation du Dr M.Canu, Grenoble)
L’IRM est un outil complémentaire à l’évaluation échocardiographique. Dans le cadre de l’évaluation des cavités droites, il permettra une évaluation plus fine :
– Des volumes ventriculaires droits grâce aux séquences ciné
– De la fonction ventriculaire droite grâce à la mesure de la fraction d’éjection ventriculaire (FEVD dont le seuil de 45% est pronostique dans l’insuffisance cardiaque)
– De la contraction segmentaire des parois du VD, utile en cas de suspicion de cardiopathie arythmogène (anciennement DAVD).
– Du tissu et de la paroi myocardique en recherchant viabilité et fibrose myocardique. Même si la paroi du VD semble plus fine, de nouvelles techniques avec une résolution spatiale plus importante (utilisant de plus petit voxels), permettront probablement d’améliorer les performances de cet outil.
– De la quantification d’une fuite tricuspide (par méthode volumétrique et/ou direct alignée sur le flux).
Les dernières recommandations ESC sur l’insuffisance cardiaque insistent sur la réalisation d’une IRM en cas d’échogénicité limitée, dans la DAVD, dans les cardiopathies congénitales et maladies du péricarde.10
Quand et comment intervenir sur le ventricule droit ?
(d’après la présentation de S. Ribeyrolles, Paris)
Intervenir face à une dysfonction droite, c’est en premier lieu éliminer une cause « évidente » de cette dysfonction. Il faudra donc s’assurer en premier lieu de l’absence d’infarctus du myocarde du VD, d’une embolie pulmonaire et/ou d’une tamponnade.
En l’absence de cause évidente, il faut repenser à l’approche physiopathologique décrite précédemment permettant à la fois d’initier le bon traitement et de repenser la cause de la dysfonction droite. Ainsi, il faudra :
– Lutter contre l’élévation de la post charge en cas d’hypertension pulmonaire pré- ou post- capillaire et optimiser le traitement en conséquence (traitement de l’insuffisance cardiaque gauche ou mise en place de vasodilatateurs pulmonaires).
– Lutter contre l’élévation de la pré charge (surcharge en volume) par l’utilisation de diurétiques et/ou épuration extra rénale essentiellement.
– Optimiser la contractilité VD par l’utilisation d’inotropes (dobutamine et noradrénaline)
– Optimiser le rythme cardiaque en essayant de maintenir un rythme sinusal et un bon couplage atrio-ventriculaire.
En l’absence de thérapeutique spécifique excepté les diurétiques (classe I), il est essentiel de ne pas traiter trop tard la dysfonction droite, notamment si l’insuffisance tricuspide (IT) en est responsable. En l’absence de traitement précoce, il existe un cercle vicieux où l’IT aggrave la dysfonction et dilatation droite, ce qui aggrave l’IT.
En pratique, les patients avec une IT significative, symptomatiques, sont adressés dans < 10% des cas en chirurgie et dans <2% des cas pour IT isolée.11 Ces chiffres sont secondaires à l’absence d’étude randomisée sur le sujet et un taux de mortalité opératoire élevé (environ 16%).
Le TRI-SCORE, développé récemment par l’équipe de J. Dreyfus et al permet de stratifier le risque de mortalité intra-hospitalière après chirurgie tricuspide, faisant mieux que l’EURO-SCORE I et II. Celui-ci se base sur des données cliniques, biologiques, et échographiques (Tableau 3).
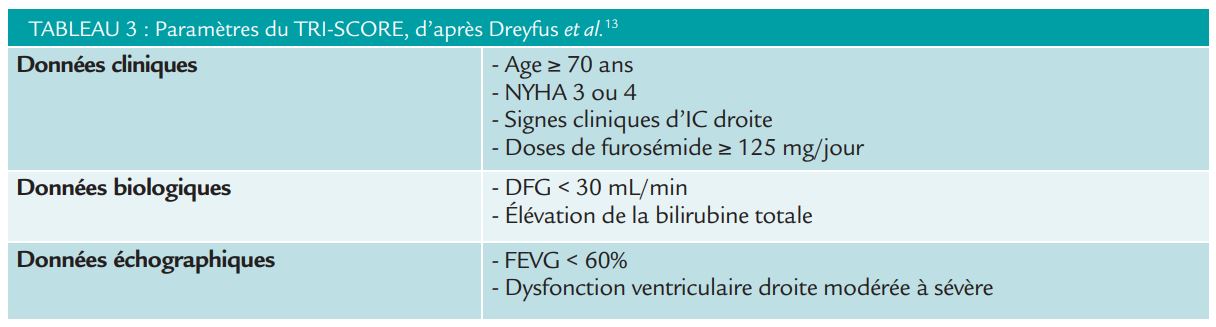
Récusé pour la chirurgie, il faudra se poser la question de la possibilité d’une réparation percutanée, en réalisant au préalable une échocardiographie transthoracique, transoesophagienne, une IRM et un cathétérisme cardiaque droit en centre expert. Les indications pour la prise en charge d’une insuffisance tricuspide sont résumées dans le tableau 4. 12

Charles Fauvel, CHU Rouen
RÉFÉRENCES
- Houard L, Benaets M-B, de Meester de Ravenstein C, Rousseau MF, Ahn SA, Amzulescu M-S, et al. Additional Prognostic Value of 2D Right Ventricular Speckle-Tracking Strain for Prediction of Survival in Heart Failure and Reduced Ejection Fraction: A Comparative Study With Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2019 Dec;12(12):2373–85.
- Lang RM, Badano LP, Mor-Avi V, Afi lalo J, Armstrong A, Ernande L, et al. Recommendations for cardiac chamber quantifi cation by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015 Mar;16(3):233–70.
- Vonk Noordegraaf A, Chin KM, Haddad F, Hassoun PM, Hemnes AR, Hopkins SR, et al. Pathophysiology of the right ventricle and of the pulmonary circulation in pulmonary hypertension: an update. Eur Respir J. 2019;53(1).
- Vonk Noordegraaf A, Westerhof BE, Westerhof N. The Relationship Between the Right Ventricle and its Load in Pulmonary Hypertension. J Am Coll Cardiol. 2017 Jan 17;69(2):236–43.
- Guazzi M, Bandera F, Pelissero G, Castelvecchio S, Menicanti L, Ghio S, et al. Tricuspid annular plane systolic excursion and pulmonary arterial systolic pressure relationship in heart failure: an index of right ventricular contractile function and prognosis. Am J Physiol Heart Circ Physiol. 2013 Nov 1;305(9):H1373-1381.
- Guazzi M, Dixon D, Labate V, Beussink-Nelson L, Bandera F, Cuttica MJ, et al. RV Contractile Function and its Coupling to Pulmonary Circulation in Heart Failure With Preserved Ejection Fraction: Stratifi cation of Clinical Phenotypes and Outcomes. JACC Cardiovasc Imaging. 2017 Oct;10(10 Pt B):1211–21.
- Guazzi M, Naeije R, Arena R, Corrà U, Ghio S, Forfi a P, et al. Echocardiography of Right Ventriculoarterial Coupling Combined With Cardiopulmonary Exercise Testing to Predict Outcome in Heart Failure. Chest. 2015 Jul;148(1):226–34.
- Brener MI, Grayburn P, Lindenfeld J, Burkhoff D, Liu M, Zhou Z, et al. Right Ventricular-Pulmonary Arterial Coupling in Patients With HF Secondary MR: Analysis From the COAPT Trial. JACC Cardiovasc Interv. 2021 Oct 25;14(20):2231–42.
- Bosch L, Lam CSP, Gong L, Chan SP, Sim D, Yeo D, et al. Right ventricular dysfunction in left-sided heart failure with preserved versus reduced ejection fraction. Eur J Heart Fail. 2017 Dec;19(12):1664–71.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Aug 27;ehab368.
- Messika-Zeitoun D, Candolfi P, Dreyfus J, Burwash IG, Iung B, Philippon J-F, et al. Management and Outcome of Patients Admitted With Tricuspid Regurgitation in France. Can J Cardiol. 2021 Jul;37(7):1078–85.
- Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2021 Aug 28;ehab395.
- Dreyfus J, Audureau E, Bohbot Y, Coisne A, Lavie-Badie Y, Bouchery M, et al. TRI-SCORE: a new risk score for in-hospital mortality prediction after isolated tricuspid valve surgery. Eur Heart J. 2021 Sep 29;ehab679.
