
Le rôle des dommages extra-valvulaires dans l’évaluation des valvulopathies
Dans cette session issue des JESFC 2022, on s’intéresse aux dommages « extra-valvulaires » (cardiaques et non cardiaques) dans l’évaluation des valvulopathies en termes d’impact pronostique mais aussi de prise en charge.
Amylose cardiaque et sténose aortique
(d’après la présentation du Dr D. Bodez, St Denis)
Selon les études et registres utilisés, la prévalence de l’amylose cardiaque chez les patients porteurs de sténose aortique serrée est de 6 à 16%, essentiellement dans l’amylose cardiaque à transthyrétine.1 Même si les mécanismes ne sont pas parfaitement élucidés, il est très probable que le stress oxydatif engendré par le processus amyloïde favorise les dépôts intravalvulaires et que ces derniers favorisent la progression de la sténose aortique.
La première question qui se pose souvent est : comment faire le diagnostic d’amylose lorsque l’on est face à un patient adressé pour rétrécissement aortique serré ? L’étude de Castano et al en 2017 a montré que le seul paramètre échocardiographique indépendamment associé au diagnostic d’amylose dans ce cas était un pic de l’onde S mitrale < 6 cm/s.2 L’apical sparing (strain en cocarde), n’était quant à lui pas associé au diagnostic car aussi bien retrouvé chez les patients avec une sténose aortique ou une amylose ou les deux.2
Le scanner pré-TAVI, en plus d’être indispensable avant procédure, a aussi montré son intérêt. Le volume extra cellulaire, avec un cut-off de 33,7% permet avec une excellente sensibilité et spécificité (100% et 93,8% respectivement), d’identifier une amylose cardiaque en cas de RA serré.3, 4 Sur le plan clinique, il faudra combiner les signes retrouvés à l’interrogatoire et à l’examen physique,1,2 la discordance entre l’hypertrophie ventriculaire gauche échographique et électrique, ainsi que le phénotype de sténose aortique « bas débit – bas gradient ». Le RAISE score publié par l’équipe de Nitsche et al. peut être une aide au moment de l’examen (Tableau 1). 5
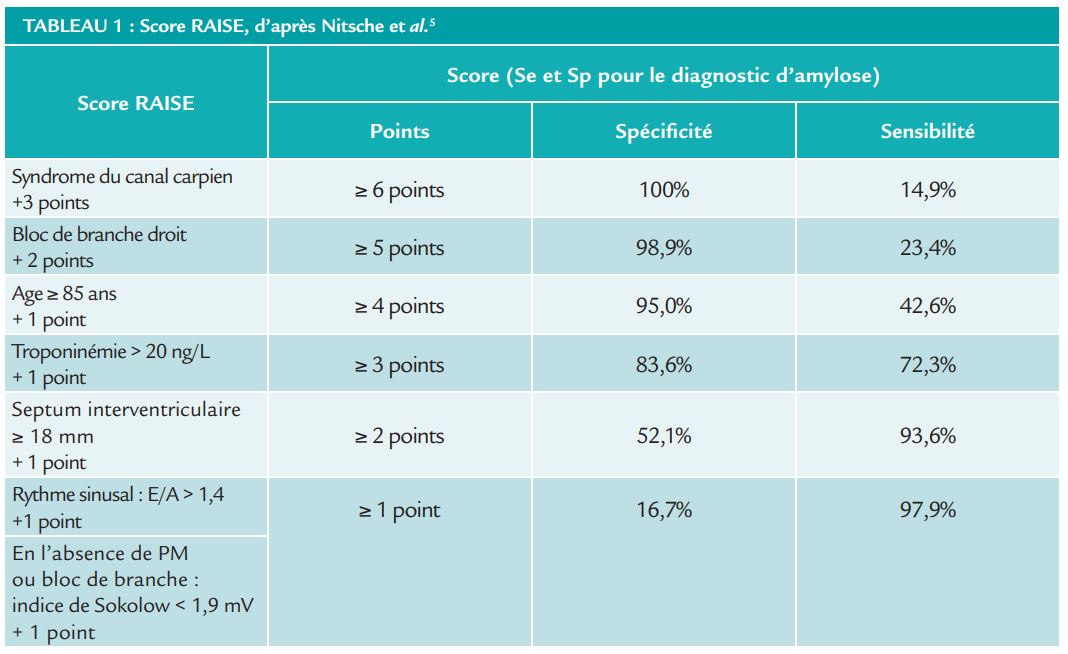
La seconde question qui doit être posée est : quel est l’impact sur le pronostic et que faut-il proposer comme traitement ? Il a été montré qu’en cas d’amylose cardiaque, la présence d’une sténose aortique aggravait le pronostic mais qu’en cas de correction de celle-ci, notamment par TAVI, on améliore considérablement le pronostic des patients.5-7 Au contraire de la chirurgie qui ne semble pas être une bonne option dans ce cas.
Plus qu’un « simple » rétrécissement aortique serré
(d’après la présentation du Dr P.-V. Ennezat, Créteil)
Proposer un traitement du rétrécissement aortique (RA) lorsqu’il est indiqué de prendre en compte l’atteinte « extra-valvulaire » cardiaque mais aussi le terrain et les comorbidités des patients. En effet, le RA touche bien sûr la valve en elle-même, mais aussi l’ensemble des cavités cardiaques en commençant par le ventricule gauche. Cette notion de « cardiac damage staging » introduite par l’équipe de Généreux en 2017 montre l’évolution naturelle du RA. Plus le stade est avancé et plus la mortalité toute cause augmente, incitant à une prise en charge la plus précoce possible.8
En dehors de la valve en elle-même, il est important de rappeler l’importance de l’atteinte coronaire, présente dans 50% des cas. L’essai clinique ACTIVATION a randomisé les patients en deux groupes : revascularisation par angioplastie pré-TAVI versus absence de revascularisation. Il n’existait pas de différence significative entre les deux groupes sur la mortalité toute cause ou hospitalisation dans l’année, et même une augmentation significative du saignement dans le groupe revascularisation.9 Un autre élément à considérer est l’accès pour la réalisation du TAVI. En l’absence d‘accès fémoral lié à la maladie artérielle périphérique, la mortalité toute cause à 1 an est augmentée. De façon plus générale, un examen clinique complet permet de faire le point sur les comorbidités du patient afin d’identifier les patients chez qui le TAVI semble ne pas apporter un intérêt en terme de morbi-mortalité (Tableau 2). 10
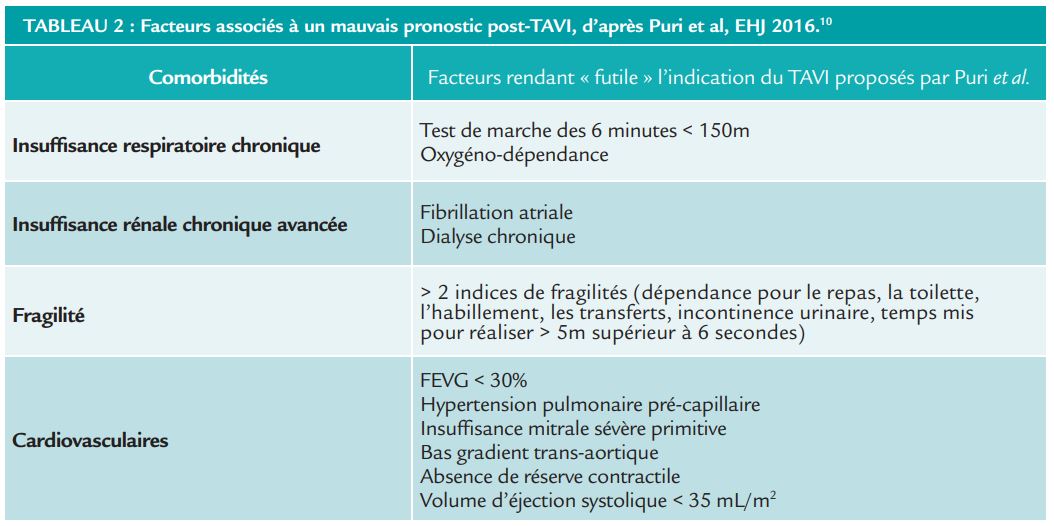
La présence d’une bicuspidie doit aussi être appréciée. En effet, elle est associée à significativement plus de pacemakers en post TAVI (sans augmentation de mortalité à 1 an) dans ce cas. La question du traitement d’un anévrisme de l’aorte ascendante doit également se poser lorsqu’il existe.11 Enfin, comme déjà évoqué précédemment, la présence d’un remodelage ventriculaire inapproprié doit faire rechercher une amylose cardiaque.
Est-il temps d’établir un score de dommage extra valvulaire pour les insuffisances mitrales dégénératives ?
(d’après la présentation du Pr J. Magne, Limoges)
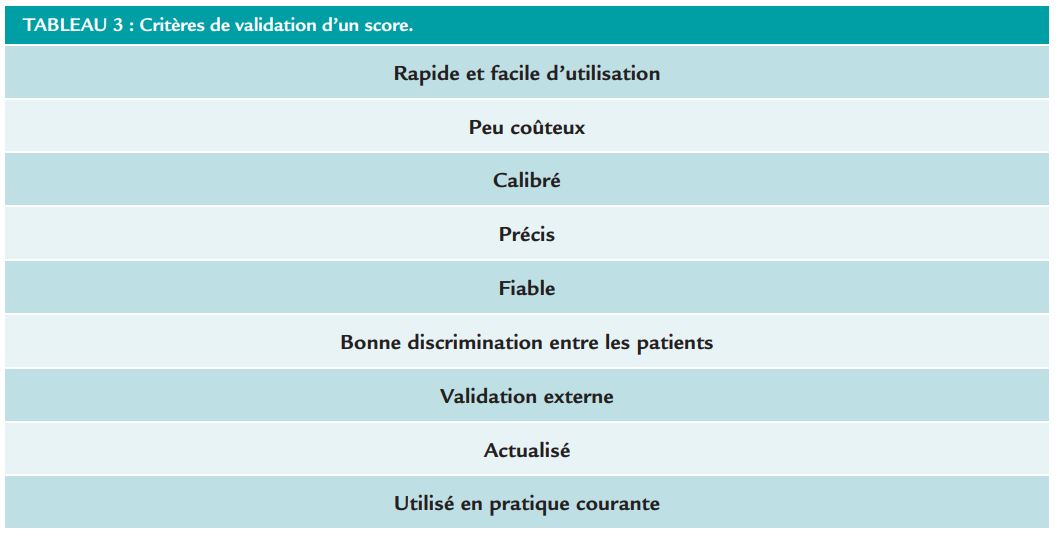
En cardiologie et comme dans d’autres domaines, beaucoup de scores ont été proposés pour l’aide au diagnostic, la stratification du risque et/ou à la prise en CORDIAM MARS – AVRIL 2022 31 charge des patients. Néanmoins, comme rappelé lors de cette session par le Pr Magne, il est difficile de prédire parfaitement l’avenir. Ainsi, il faudra toujours se souvenir qu’un score doit répondre à plusieurs critères pour être valide (Tableau 3).
Pour ce qui est de l’insuffisance mitrale (IM) dégénérative, le score MIDA existe déjà.12 Celui-ci est un score basé sur une base de données internationales dont la cohorte de dérivation a inclus des patients entre 1980 et 2005 et la cohorte de validation entre 2000 et 2013 sans overlap entre les patients, avec une AUC à 0,78 (Tableau 4).
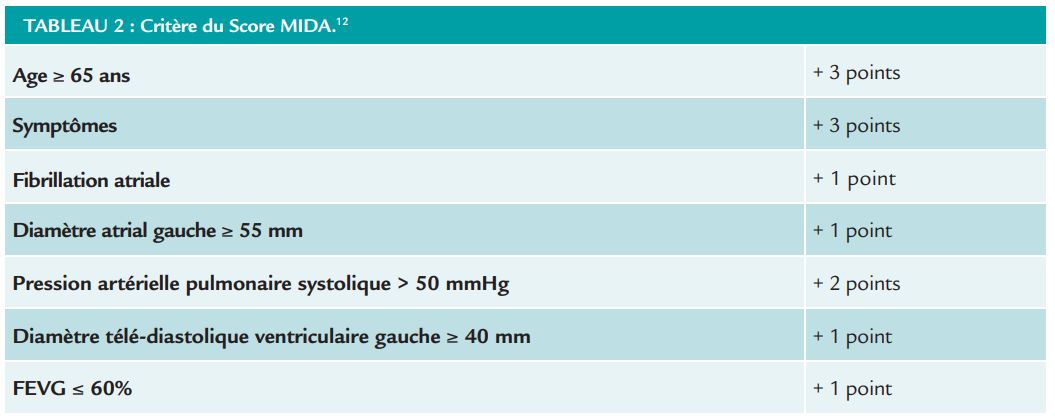
Ce score a une bonne validité externe et une bonne calibration. Ses paramètres sont même utilisés dans les recommandations de l’ESC.13 À l’avenir, une réactualisation sur des patients plus récents et avec d’autres paramètres d’imagerie multimodale sera peut-être nécessaire.
Au contraire, la disjonction mitro-annulaire présente un sur-risque d’évènement rythmique et donc de mort subite.14 L’IRM à la recherche de rehaussement tardif au niveau de la base du ventricule gauche ainsi que la quantification du volume extracellulaire sont deux paramètres qui prédisent le risque d’arythmie maligne et qui pourraient être utilisés dans ce sens à l’avenir. Il faudra probablement à l’avenir proposer un score différent pour ce phénotype d’insuffisance mitrale afin de stratifier le pronostic des patients et orienter au mieux la prise en charge.
Charles Fauvel, Rouen
RÉFÉRENCES
- Ternacle J, Krapf L, Mohty D, Magne J, Nguyen A, Galat A, et al. Aortic Stenosis and Cardiac Amyloidosis: JACC Review Topic of the Week. J Am Coll Cardiol. 2019 Nov 26;74(21):2638–51.
- Castaño A, Narotsky DL, Hamid N, Khalique OK, Morgenstern R, DeLuca A, et al. Unveiling transthyretin cardiac amyloidosis and its predictors among elderly patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. Eur Heart J. 2017 Oct 7;38(38):2879–87.
- Oda S, Kidoh M, Takashio S, Inoue T, Nagayama Y, Nakaura T, et al. Quantifi cation of Myocardial Extracellular Volume With Planning Computed Tomography for Transcatheter Aortic Valve Replacement to Identify Occult Cardiac Amyloidosis in Patients With Severe Aortic Stenosis. Circ Cardiovasc Imaging. 2020 May;13(5):e010358.
- Scully PR, Patel KP, Saberwal B, Klotz E, Augusto JB, Thornton GD, et al. Identifying Cardiac Amyloid in Aortic Stenosis: ECV Quantifi cation by CT in TAVR Patients. JACC Cardiovasc Imaging. 2020 Oct;13(10):2177–89.
- Nitsche C, Scully PR, Patel KP, Kammerlander AA, Koschutnik M, Dona C, et al. Prevalence and Outcomes of Concomitant Aortic Stenosis and Cardiac Amyloidosis. J Am Coll Cardiol. 2021 Jan 19;77(2):128–39.
- Chacko L, Martone R, Bandera F, Lane T, Martinez-Naharro A, Boldrini M, et al. Echocardiographic phenotype and prognosis in transthyretin cardiac amyloidosis. Eur Heart J. 2020 Jan 17;
- Scully PR, Patel KP, Treibel TA, Thornton GD, Hughes RK, Chadalavada S, et al. Prevalence and outcome of dual aortic stenosis and cardiac amyloid pathology in patients referred for transcatheter aortic valve implantation. Eur Heart J. 2020 Aug 1;41(29):2759–67.
- Généreux P, Pibarot P, Redfors B, Mack MJ, Makkar RR, Jaber WA, et al. Staging classifi cation of aortic stenosis based on the extent of cardiac damage. Eur Heart J. 2017 Dec 1;38(45):3351–8.
- Patterson T, Clayton T, Dodd M, Khawaja Z, Morice MC, Wilson K, et al. ACTIVATION (PercutAneous Coronary inTervention prIor to transcatheter aortic VAlve implantaTION): A Randomized Clinical Trial. JACC Cardiovasc Interv. 2021 Sep 27;14(18):1965–74.
- Puri R, Iung B, Cohen DJ, Rodés-Cabau J. TAVI or No TAVI: identifying patients unlikely to benefi t from transcatheter aortic valve implantation. Eur Heart J. 2016 Jul 21;37(28):2217–25.
- Makkar RR, Yoon S-H, Chakravarty T, Kapadia SR, Krishnaswamy A, Shah PB, et al. Association Between Transcatheter Aortic Valve Replacement for Bicuspid vs Tricuspid Aortic Stenosis and Mortality or Stroke Among Patients at Low Surgical Risk. JAMA. 2021 Sep 21;326(11):1034–44.
- Grigioni F, Clavel M-A, Vanoverschelde J-L, Tribouilloy C, Pizarro R, Huebner M, et al. The MIDA Mortality Risk Score: development and external validation of a prognostic model for early and late death in degenerative mitral regurgitation. Eur Heart J. 2018 Apr 14;39(15):1281–91.
- Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2021 Aug 28;ehab395.
- Essayagh B, Sabbag A, Antoine C, Benfari G, Batista R, Yang L-T, et al. The Mitral Annular Disjunction of Mitral Valve Prolapse: Presentation and Outcome. JACC Cardiovasc Imaging . 2021
