
Essai BIOGUARD-MI : un traitement précoce des arythmies détectées par dispositif cardiaque implantable permettrait une amélioration du pronostic après un NSTEMI
Christian Jons et Al, Department of Cardiology, Righospitalet, Cophenagen, Danemark
Late Breaking Science Session du 04/04/2022 – “Biomonitoring in Patients with Preserved Left Ventricular Function after Diagnosed Myocardial Infarction: the BIOGUARD-MI study”
Contexte
Les troubles du rythme (supraventriculaire ou ventriculaire) sont associés à un mauvais pronostic chez les patients ayant présenté un infarctus du myocarde.(1–3) Les dispositifs de monitoring cardiaque implantable (type Reveal©) permettent de documenter un grand nombre d’arythmies asymptomatiques. L’essai BIOGUARD-MI est le premier essai à évaluer si le traitement guidé par la mise en évidence d’arythmies asymptomatiques grâce à un dispositif de monitoring implantable améliore le pronostic des patients à haut risque rythmique après un infarctus du myocarde.
Méthodologie
L’essai BIOGUARD-MI est un essai randomisé, multicentrique, en conduit ouvert dans 60 centres de 14 pays en Europe, Australie et aux Etats-Unis. Les patients ayant présenté un infarctus du myocarde avec un score de CHADS-VASC ≥ 4 chez les hommes et 5 chez les femmes ont été randomisés en 1 pour 1 entre implantation d’un dispositif de monitoring avec télé-suivi ou prise en charge standard. La randomisation était stratifiée sur le statut NSTEMI ou STEMI de l’infarctus. Les patients ne pouvaient être inclus s’ils avaient déjà une indication de défibrillateur, resynchronisation ou stimulateur cardiaque, s’ils avaient une fibrillation atriale connue, un syndrome hémorragique, une insuffisance rénale dialysée ou une maladie de Parkinson. Les patients du groupe monitoring cardiaque implantable étaient contactés en cas d’arythmies détectées sur le télé-suivi, en l’absence d’arythmies détectées, le patient était contacté par téléphone pour rapporter les évènements cliniques tous les 6 mois. Le critère de jugement principal était la mortalité cardiovasculaire ou l’hospitalisation (pour arythmie, syndrome coronaire aigu, aggravation d’une insuffisance cardiaque, AVC, embolie systémique ou saignement majeur). Le critère secondaire était la survenue d’une arythmie avec nécessité d’un traitement.
La fibrillation atriale était défi nie comme nécessitant un traitement si d’une durée de plus de 6 minutes, le BAV du 2e ou 3e degré ou la pause sinusale si > 3 secondes, la bradycardie sinusale si > 10 secondes à moins de 40bpm et la tachycardie ventriculaire si > 180bpm ou > 8 battements consécutifs.
Résultats
Au total, 790 patients ont été inclus dont 398 dans le groupe monitoring cardiaque implantable (âge 72+/- 8 ans, 73% d’hommes, 79% d’angioplastie au moment de l’épisode, 52% de NSTEMI) et 392 dans le groupe standard (âge 71+/-9 ans, 71% d’hommes, 82% d’angioplastie
au moment de l’épisode, 51% de NSTEMI). La FEVG moyenne était de 53% dans les deux groupes avec un score CHADS moyen de 5. Dans le groupe monitoring cardiaque implantable, le taux d’arythmies ayant conduit à un traitement était de 39% à 2 ans versus 6% dans le
groupe contrôle (HR 5,0, p<0,0001). (Figure 1)
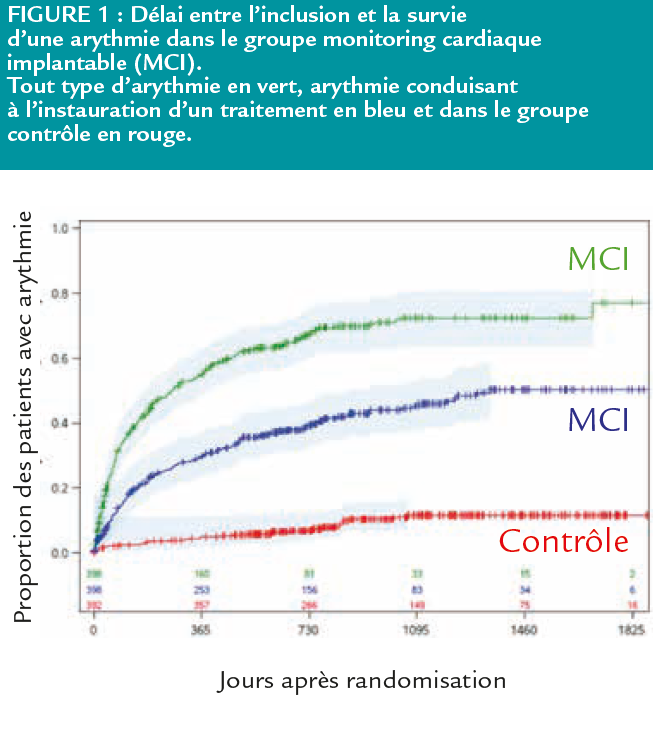

Le traitement débuté était dans 40% des cas une anticoagulation, l’implantation d’un stimulateur cardiaque dans 20% des cas, d’un défibrillateur dans 6% des cas.
Le critère de jugement principal (composite de la mortalité ou des hospitalisations) est survenu chez 218 patients au total, à 2 ans, sans différence entre les 2 groupes (HR 0,84 [IC 95% 0,64-1,10], p=0,21). L’implantation d’un dispositif cardiaque implantable et la détection d’arythmies conduisant à un traitement semblait aboutir à une amélioration du pronostic dans le groupe des NSTEMI (HR 0,69 [IC95% 0,49-0,98]). Cette amélioration n’était pas retrouvée dans le sous-groupe des STEMI. (Figure 2)
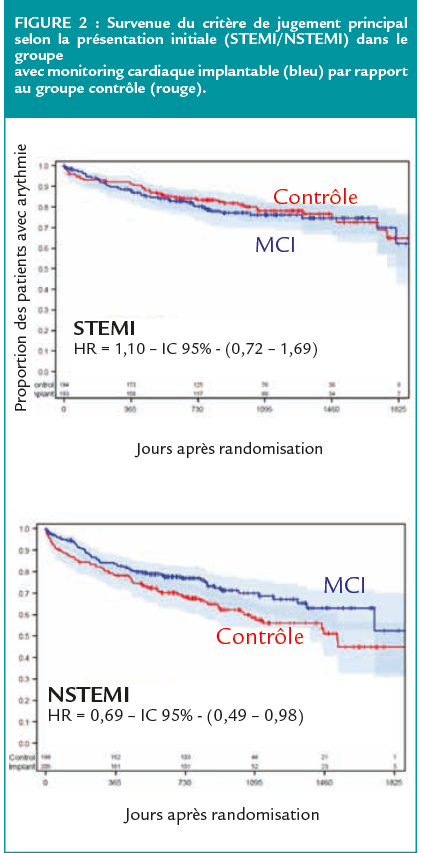
En effet, la présentation sous la forme d’un NSTEMI était indépendamment associée à la survenue du décès ou des ré-hospitalisations (HR 1,75 [IC95% 1,33-2,0], p=0,003) notamment en cas de risque élevé d’arythmies (plus de 2 facteurs sur les 4 suivants : AOMI, infarctus du myocarde à la phase aiguë, insuffisance cardiaque ou IMC > 30).
L’étude a été suspendue en raison d’un haut risque d’évènements non-cardiovasculaires chez les patients ayant bénéficié d’un monitoring cardiaque implantable, puis reprise après exploration individuelle des cas n’ayant pas montré de corrélation avec le device.
Conclusions
Le monitoring cardiaque implantable des patients à haut risque d’arythmies post-infarctus a conduit à l’instauration ou la modification d’un traitement dans 40% des cas à 2 ans comparé à 6% dans le groupe contrôle. Néanmoins, ces modifications n’ont pas été associées à une modification du pronostic dans la population globale. Les auteurs ont toutefois retrouvé un signal en faveur d’un bénéfice pronostique à la détection précoce d’arythmies grâce au monitoring cardiaque implantable dans le sous-groupe des NSTEMI.
Cette différence surprenante toutefois retrouvée entre les NSTEMI et STEMI peut être au moins partiellement expliquée par le profil différent des patients présentant un NSTEMI : plus âgés, à plus haut risque cardiovasculaire et plus comorbides, bénéficiant moins souvent
d’angioplasties et d’un traitement suboptimal à la sortie.
- Le monitoring cardiaque peut conduire à une modification ou une instauration de traitement après un infarctus et apporter un bénéfice pronostic surtout chez les patients traités de manière suboptimal.
- La technique de détection de ces arythmiques (dispositif cardiaque implantable, Smart-watch, …) reste à définir.
Références
1. Kalarus Z, Svendsen JH, Capodanno D, Dan G-A, De Maria E, Gorenek B, et al. Cardiac arrhythmias in the emergency settings of acute coronary syndrome and revascularization: an European Heart Rhythm Association (EHRA) consensus document, endorsed by the European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Acute Cardiovascular Care Association (ACCA). EP Europace. 2019 Oct 1;21(10):1603 -4.
2. Jabre P, Roger VL, Murad MH, Chamberlain AM, Prokop L, Adnet F, et al. Mortality associated with atrial fi brillation in patients with myocardial infarction: a systematic review and meta-analysis. Circulation. 2011 Apr 19;123(15):1587 -93.
3. Bougouin W, Marijon E, Puymirat E, Defaye P, Celermajer DS, Le Heuzey J-Y, et al. Incidence of sudden cardiac death after ventricular fibrillation complicating acute myocardial infarction: a
5-year cause-of-death analysis of the FAST-MI 2005 registry. European Heart Journal. 2014 Jan 2;35(2):116 -22.
