
Les ESV infundibulaires bénignes sont fréquentes puisqu’elles représentent 10% de toutes les ESV/TV et environ 50% des ESV/TV dîtes idiopathiques. Leur mécanisme est expliqué par la persistance (défaut d’apoptose au cours de l’embryogénèse) de cellules non contractiles des chambres de chasse ventriculaires1.
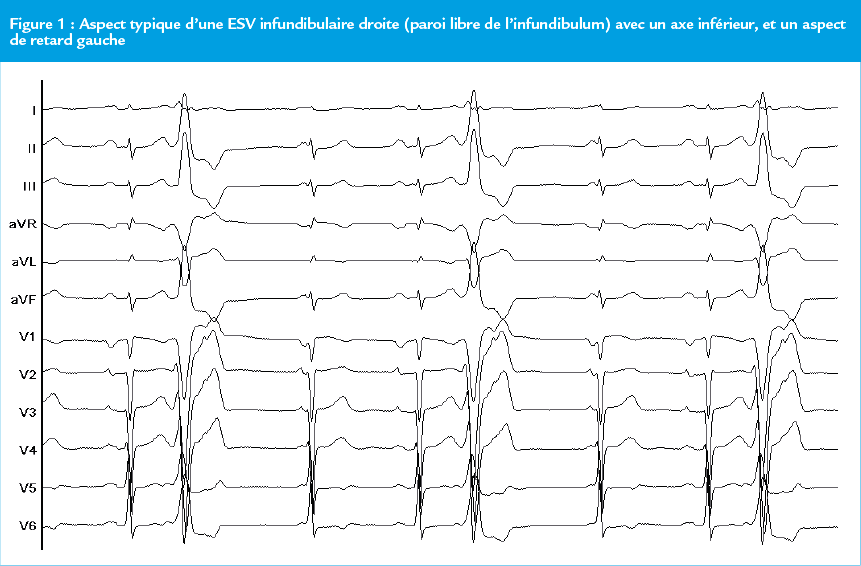
Anatomiquement elles peuvent être localisées au-dessus du plan des valves aortiques et pulmonaires du fait d’invaginations myocardiques au-dessus du plan des cusps. Elles sont facilement reconnaissables sur l’ECG de surface par un axe inférieur et le plus souvent un aspect de retard gauche (Figure 1). Elles peuvent être découvertes fortuitement à l’auscultation ou sur un ECG de dépistage ou bien être symptomatiques.
La première étape est d’affirmer le caractère bénin des ESV en éliminant une cardiopathie sous-jacente, mais également de rechercher un retentissement sur le ventricule gauche (cardiomyopathie induite par les ESV). Classiquement, on considère que la charge en ESV (si leur nombre excède 10000/24heures) est un élément fortement associé à la survenue d’une dysfonction ventriculaire gauche. Ainsi, il conviendra de réaliser un bilan comprenant au minimum un interrogatoire à la recherche de signes de gravité (syncope, antécédents familiaux de mort subite), un bilan biologique (ionogramme sanguin, TSH, syndrome inflammatoire), une échocardiographie trans-thoracique, une épreuve d’effort et un holter ECG de 24 heures (charge en ESV, morphologie(s)). Au cas par cas, d’autres examens plus approfondis pourront compléter ce bilan (recherche de potentiels tardifs, IRM cardiaque, coroscanner ou coronarographie, angiographie VD, dépistage génétique).
En cas d’ESV infundibulaires symptomatiques ou responsables d’une altération de la FEVG, un traitement antiarythmique doit être instauré (bétabloquant, antiarythmique de classe IC, ou encore l’amiodarone en cas de cardiomyopathie). L’alternative à cette stratégie médicamenteuse est la réalisation d’une ablation du foyer d’ESV.
Indications de l’ablation 2
Les recommandations distinguent les ESV infundibulaires droite et les ESV infundibulaires gauche.
- En cas d’ESV infundibulaires droite une ablation par radiofréquence pourra être proposée en 1ère intention en cas d’ESV symptomatiques, ou après échec d’un traitement antiarythmique ou si la charge en ESV est responsable d’une altération de la FEVG (recommandation de classe I, niveau de preuve B).
- En cas d’ESV infundibulaires gauche, épicardiques ou provenant d’une cusp aortique, une ablation peut être considérée en 2ème intention en cas d’ESV symptomatiques, après échec (ou mauvaise tolérance ou refus du patient) d’un traitement pharmacologique (recommandation de classe IIa, niveau de preuve B). Les recommandations précisent que l’ablation devra alors être réalisée par un opérateur expérimenté.
Localisation de l’ESV infundibulaire
Cette différence de niveau de recommandations vient d’une plus grande efficacité de l’ablation des ESV infundibulaires droite avec un risque procédural moindre.
En cas d’ablation d’ESV provenant d’une cusp aortique, les risques potentiels sont plus importants avec notamment un risque de lésion coronaire. Il est donc essentiel de déterminer l’origine droite ou gauche des ESV infundibulaires afin de mieux informer le patient sur le rapport bénéfice/risque de la procédure.
Une analyse rigoureuse de la morphologie de l’ESV sur l’ECG de surface devra donc être réalisée au préalable. De nombreux algorithmes ont été décrits pour permettre de localiser l’origine des ESV infundibulaires3. Parmi les ESV infundibulaires droite, on distingue les ESV de la paroi libre de l’infundibulum, les ESV antérieures, postérieures et septales.
Parmi les ESV infundibulaires gauche, on distingue les ESV des cusps aortiques (droite ou gauche), de la continuité aorto mitrale et épicardique.
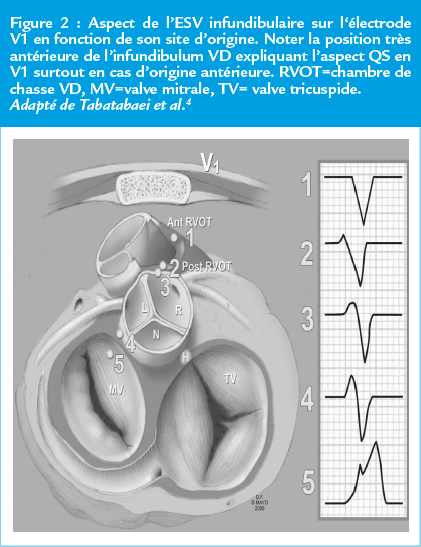
Il faut bien comprendre que l’analyse de la morphologie de l’ESV sur l‘électrode V1 permet d’appréhender l’origine antérieure (alors toute négative car fuit la face antérieure de l’infundibulum) de l’extrasystole de l’origine postérieure (origine gauche, onde R exclusive en V1)4 (Figure 2).
Elle est réalisée sous anesthésie locale minimaliste, le passage de la xylocaine en systémique ou une sédation pouvant éteindre l’arythmie. Les traitements antiarythmiques devront avoir été arrêtés depuis plus de 5 demie vies. Les 10 électrodes de l’ECG de surface doivent être rigoureusement positionnées sur le patient afin de pouvoir fidèlement identifier l’ESV clinique et la différencier des ESV induites mécaniquement. En cas d’ESV peu fréquentes voire absentes au moment de l’intervention, une perfusion d’isuprel peut permettre d’en augmenter lafréquence.
L’ablation est réalisée par voie d’abord veineuse fémorale droite en cas d’ESV infundibulaires droite et par voie d’abord artérielle rétrograde aortique ou par voie transeptale à travers la fosse ovale en cas d’ESV infundibulaires gauche.
L’ablation a été rendue plus accessible grâce aux progrès majeurs des systèmes de cartographie 3D et des sondes d’ablation contact qui permettent à l’opérateur de voir le degré de force appliqué ainsi que son vecteur.
Deux techniques électrophysiologiques sont utilisées pour localiser le foyer d’origine de l’ESV : la recherche de la primodépolarisation et la topostimulation.
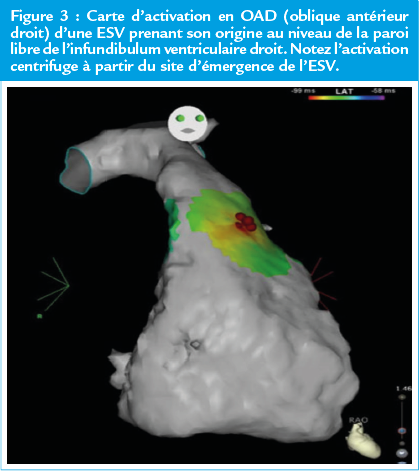
- Recherche de la primodépolarisation : l’origine des ESV étant focale, cette technique consiste à cartographier l’ESV en recherchant le site endocavitaire de primodépolarisation ventriculaire de l’ESV au sein de l’infundibulum. Une primodépolarisation ventriculaire supérieure à 30ms par rapport au début de l’ESV sur l’ECG de surface et un signal ventriculaire unipolaire négatif sur l’électrode endocavitaire sont associés à un taux de succès élevé de l’ablation. L’utilisation d’un système de cartographie 3D permet de réaliser une carte d’activation mettant en évidence l’activation centrifuge de l’infundibulum à partir du site d’émergence de l’ESV (Figure 3).
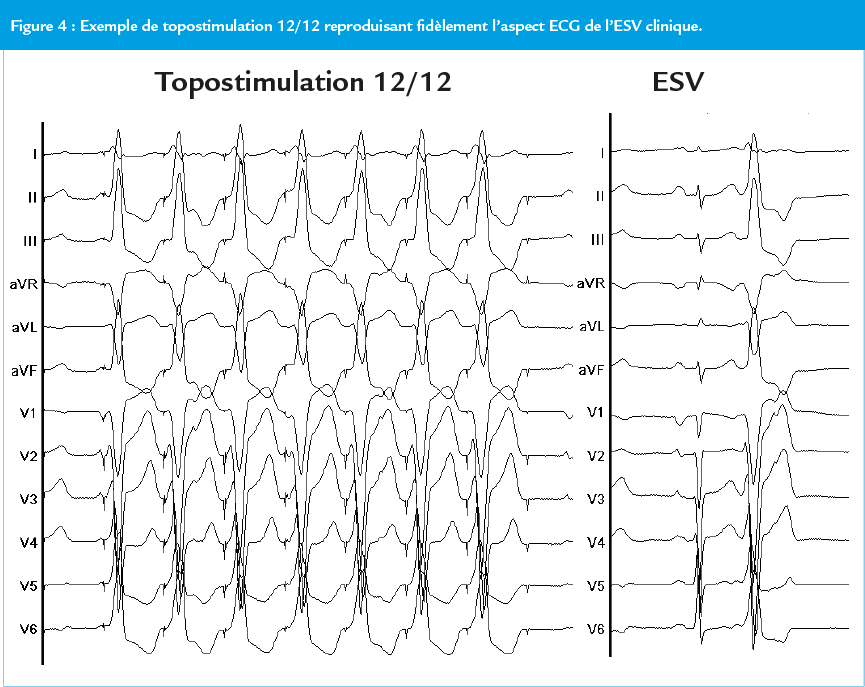
- Topostimulation : elle consiste à stimuler le myocarde ventriculaire à l’aide d’un cathéter d’électrophysiologie au niveau du site présumé d’émergence de l’ESV. Si l’aspect du QRS stimulé sur l’ECG 12 dérivations reproduit fidèlement l’aspect de l’ESV clinique, l’ablation sera le plus souvent efficace (Figure 4).
Des algorithmes exprimant en pourcentage le degré de corrélation entre le QRS stimulé et l’ESV clinique sont désormais intégrés dans les systèmes de cartographie.
Une fois le site optimal localisé, l’ablation peut débuter à l’aide le plus souvent d’un cathéter irrigué de 4mm. En cas d’ablation au niveau d’une cusp aortique, une coronarographie doit être réalisée pendant la procédure. Une ablation à moins d’1cm d’un ostium coronaire doit être évitée. Un scanner réalisé préalablement peut permettre d’estimer la distance entre les cusps aortiques et les ostium coronaires. Le taux de succès rapporté est de l’ordre de 90%. Contrastant avec les ESV de l’infundibulum , le risque de complications graves au cours d’une ablation d’une ESV gauche est plus conséquent de l’ordre de 3% (lésion coronaire, hémopéricarde, bloc atrioventriculaire, insuffisance aortique, accident vasculaire cérébral)5.
Conclusion
L’ablation des ESV infundibulaires est une alternative efficace au traitement antiarythmique chez les patients symptomatiques ou en cas de cardiomyopathie induite par les ESV. Elle suppose au préalable de réaliser une analyse rigoureuse de la morphologie de l’ESV sur l’ECG de surface afin de délivrer aux patients une information précise concernant le rapport bénéfice/risque de la procédure.
Frédéric Treguer, Clinique St Joseph, Angers
RÉFÉRENCES
1. Christoffels VM et al, Circ Arrhythmia Electrophysiol. 2009 April;2 :195-207.
2. Priori SG et al, Eur Heart J. 2015 Nov 1;36(41):2793-2867.
3. Park KM et al, PACE. 2012 Dec;35(12):1516-27.
4. Tabatabaei N et al, Circ Arrhythmia Electrophysiol. 2009 June;2 :316-326.
5. Bohnen M et al, Heart Rhythm. 2011 November;8(11) :1661-1666.
