Les maladies cardiovasculaires (infarctus du myocarde, accident vasculaire cérébral) représentent la première cause de mortalité dans le monde. Longtemps considérée comme une pathologie dégénérative, l’athérothrombose implique également des processus inflammatoires chroniques, faisant participer les leucocytes, macrophages, cellules spumeuses et cellules endothéliales dans la formation de la plaque d’athérome et l’apparition des événements cardiovasculaires. Le microbiote intestinal est depuis une décennie décrit comme jouant un rôle dans la régulation métabolique de l’hôte et sa dysrégulation, appelée dysbiose, et influence les phénomènes inflammatoires de nombreuses pathologies, y compris cardiovasculaires (1).
Qu’est-ce que le microbiote intestinal ?
Le microbiote intestinal est composé de plus de 1014 microorganismes, incluant des bactéries, des levures, des archées et des virus. Le microbiote intestinal bactérien comporte plus de 500 espèces et contient 100 fois plus de gènes que dans le génome humain. Les bactéries sont réparties en quatre phyla majeurs : Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria avec une nette prédominance des Bacteroidetes et des Firmicutes. Cette communauté bactérienne s’est développée et adaptée depuis des millions d’années à l’hôte, créant une relation mutualiste étroite avec les fonctions physiologiques de la digestion, aux fonctions complexes de régulation du système immunitaire. Ses fonctions peuvent être affectées par le génome humain mais également par des facteurs environnementaux tels que les infections, le régime alimentaire ou le style de vie.
Comment expliquer son implication dans les maladies cardiovasculaires ?
La compréhension de l’implication du microbiote intestinal dans le développement des maladies cardiovasculaires est restée limitée durant ces dernières quinze années. Des preuves biologiques suggèrent un rôle potentiel de ces micro-organismes dans l’athérogenèse. Tout d’abord, des études de composition du microbiote ont montré une différence significative de la présence d’ADN bactérien dans les plaques carotidiennes de patient ayant fait un AVC. Plus loin que la simple approche descriptive, des travaux mécanistiques montrent que la modification de la composition du microbiote par la prise d’antibiotique (vancomycine) réduit de 27% les infarctus du myocarde, améliorant de 35% la perfusion myocardique. Ces actions s‘expliquent également par la diminution des taux de leptine et de métabolites délétères.
Les études de transplantation fécale ont démontré la possibilité de transmettre un phénotype de type athérosclérose ou obésité chez les souris transplantées de selles de patients coronariens ou obèses. Cette athérogenèse est amplifiée par un régime riche en phosphatidylcholine.
Cet intérêt pour le microbiote intestinal a conduit les chercheurs à s’intéresser à ses métabolites, certains plutôt délétères et d’autres protecteurs. Le métabolite le plus connu et décrit est le triméthylamine N-oxide (TMAO), produit par le foie à partir de la phosphatidylcholine. Dans le tube digestif, la L carnitine ou la phosphatidylcholine, la source alimentaire principale de choline, peut être convertie en trimethylamine (TMA) par le microbiote. Le TMA circule dans le sang et s’oxyde sous la forme de TMAO grâce à l’enzyme hépatique : la fl avine monooxygénase (2). Le TMAO affecte le métabolisme du cholestérol et des stérols dans les macrophages, le foie et l’intestin et apparaît alors comme un facteur clé dans le mécanisme associant microbiote intestinal et maladies cardiovasculaires, puisque la dysbiose conduit à une augmentation sérique de TMAO et la génération de toxine urémique.
Le TMAO contribue à la progression de la maladie cardiovasculaire par différents mécanismes. La production de TMAO par le microbiote intestinal augmente l’hyperréactivité plaquettaire, le relargage de calcium par les plaquettes et l’augmentation de leur potentiel thrombogène. Une élévation de son taux plasmatique est corrélée à une augmentation des événements thrombotiques, de même qu’à un épaississement de l’épaisseur intima-média carotidienne, un marqueur précoce d’athérosclérose.
Les endotoxines dérivées du microbiote peuvent se transformer dans la circulation systémique et stimuler toute une cascade inflammatoire. L’altération de la barrière intestinale favorise la translocation des produits bactériens et notamment le lipopolysaccharide (LPS) et in fine, l’inflammation systémique (3).
Un microbiote signature a été identifié chez les patients présentant une pathologie cardiovasculaire et chez les patients à haut risque cardiovasculaire (4). Les espèces Prevotella, Bacteroides, Clostridium, Faecalibacterium présentent un rôle pathogène dans l’athérosclérose via une altération du métabolisme des lipides. De plus, le microbiote est impliqué dans la pathogenèse des facteurs de risque cardiovasculaire tels que le diabète de type 2, l’HTA, la dyslipidémie et l’obésité. Il existe un déséquilibre dans la composition du microbiote intestinal avec une abondance d’enterobactéries (E. Coli, E. Aerogenes, K. Spp) et de streptocoque, ainsi que d’Eggerthellalenta dont les enzymes désactivent l’effet de certains traitements cardiaques comme la digoxine. À l’inverse, les bactéries productrices de butyrate (RoseburiaintestinalisetFaecalibacterium cf. prausnitzii) sont en minorité.
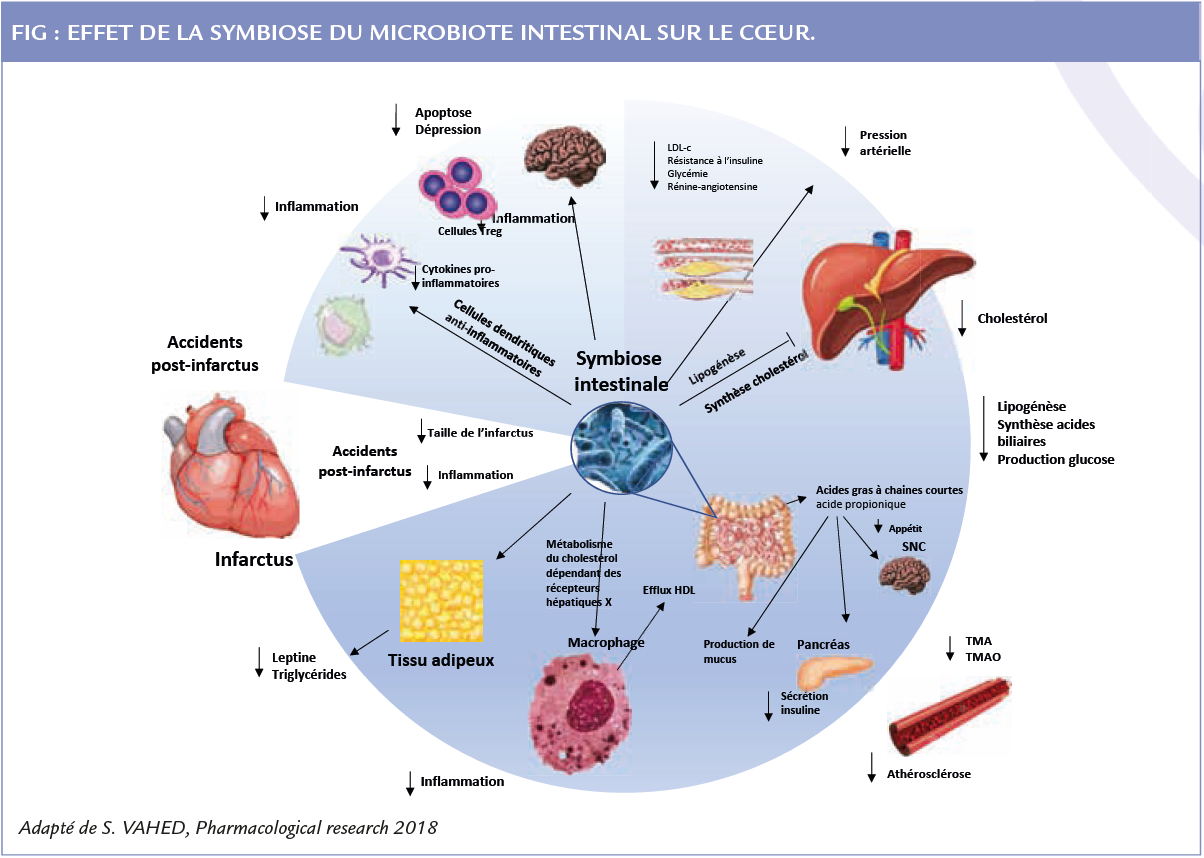
La dysbiose favorise le développement des pathologies cardiovasculaires mais la symbiose est protectrice.
Des études in vitro, in vivo chez l’animal et chez l’homme ont révélé des métabolites issus du microbiote qui régulent les fonctions physiologiques de l’hôte et sont bénéfiques.
Les acides biliaires primaires produits par le foie sont transformés en acides biliaires secondaires dans le tube digestif par le microbiote. Ces acides biliaires ont un rôle signalétique hormonal à travers leurs deux récepteurs que sont FXR et TGR5. Ils modulent l’inflammation en réduisant l’expression de cytokines pro-inflammatoires (IL1β, IL6) par les macrophages et la charge de LDL oxydés dans les cellules spumeuses.
Les acides gras à chaîne courte, moins connus, que sont les acides acétique, propionique et butyrique, ont un rôle anti-inflammatoire. Les patients atteints de maladies cardiovasculaires ont une diminution de la synthèse des acides butyrique et propionique associée à ’une augmentation de leur dégradation.
Les mécanismes impliquant le microbiote dans la diminution du risque cardiovasculaire passent par la modulation du métabolisme lipidique et la production d’anti-oxydant. Par ailleurs, la réponse immunitaire de l’hôte et l’expression des gènes peuvent être modifiées par le microbiote. Le concept le plus innovant par lequel le microbiote modifie l’expression génique de l’hôte est le rôle des récepteurs Toll-like (TLR) et l’existence de protéines effectrices bactériennes pouvant manipuler la réponse signalétique de l’hôte.
Le microbiote « équilibré »
– contrôle l’homéostasie lipidique en activant les récepteurs liver X (LXR) des macrophages, permettant l’absorption, le transport, l’efflux et l’élimination du cholestérol
– améliore le contrôle tensionnel grâce aux acides gras à chaîne courte
– diminue le stress oxydatif par le contrôle et l’élimination des dérivés réactifs de l’oxygène et du NO (5).
Le microbiote, protecteur dans l’infarctus du myocarde ?
Le microbiote intestinal diminue le risque d’événement ischémique en post-infarctus. Il est possible
– de contrôler la réponse immunitaire :
Les phénomènes inflammatoires post IDM sont corrélés à la sévérité de la dysfonction du ventricule gauche et du pronostic. La production de cytokine favorise l’inflammation, la fibrose et les dommages microvasculaires et myocardiques (6).
– de diminuer la taille d’un infarctus du myocarde :
Durant l’ischémie, les myocytes subissent une mort cellulaire par différents mécanismes : apoptose, nécrose et autophagie. La reperfusion entraîne également une mort cellulaire participant pour 50% de la taille de l’infarctus. Il est possible de « down réguler » la voie NFκB par certaines bactéries du microbiote intestinal. L’adjonction de probiotique L. plantarum et B. lactis pendant 14 jours diminue la taille de l’IDM et le taux de leptine (7).
– de réduire la sévérité de l’insuffi sance cardiaque
L’insuffisance cardiaque post IDM est une conséquence grave, dont l’incidence est diminuée grâce au traitement conventionnel. L’adjonction de certains probiotiques permet de restaurer le taux de taurine, l’acide aminé le plus abondant dans le cœur, qui diminue l’hypertrophie et améliore la fonction ventriculaire dans l’insuffisance cardiaque (8).
Comment moduler le microbiote intestinal ?
L’implication certaine du microbiote intestinal dans les pathologies cardiovasculaires en fait une cible particulièrement intéressante. Il existe différentes possibilités pour influencer le microbiote :
– les prébiotiques sont des aliments non digérables qui vont sélectivement stimuler la croissance d’une ou d’un nombre limité de bactéries dans le tube digestif avec des effets bénéfiques pour la santé de l’hôte. Par exemple, les fructo-oligosaccharides et l’inuline favorisent la croissance de bactéries bénéfiques telles que les Bifidobacterium et Lactobacillus (9)
– les probiotiques sont des microorganismes vivants qui, une fois administrés en quantité adéquate, permettent de coloniser le tube digestif et de délivrer des bénéfices à la santé de l’hôte. Les genres les plus communs sont les Bifidobacterium et Lactobacillus (10)
– les antibiotiques ciblent les populations de microorganismes pathogènes et ne sont pas utilisés dans la modulation du microbiote du fait de leur large champ d’action empêchant de cibler un genre particulier (11)
– le régime alimentaire (12)
✓ Un régime riche en glucides et en fibres réduit le pH des selles et augmente la production d’acide gras à chaîne courte.
✓ Un régime riche en protéines et en acides aminés favorise l’excrétion du nitrogène, l’absorption des glucides et la production d’acides gras à chaîne courte.
✓ Un régime riche en acides gras amincit la barrière intestinale ce qui augmente le risque de colonisation de bactéries pathogènes.
✓ le régime occidental classique (appelé « Western diet ») diminue la richesse du microbiote intestinal et favorise la prolifération la dysbiose, la déplétion en métabolites énergétiques et l’augmentation du taux plasmatique d’endotoxines.
✓ le régime végétarien augmente la concentration d’enzymes impliquées dans la biosynthèse des acides aminés et améliore la richesse du microbiote intestinal. Une diminution de production du TMAO est constatée.
– la transplantation fécale vise à remplacer le microbiote préexistant par le microbiote d’un donneur. La méthode reste expérimentale et est limitée par le risque de transmettre des endotoxines, des agents infectieux, un risque d’obésité ou même des maladies auto-immunes au receveur.
Conclusion
Le microbiote intestinal est un véritable organe, « chef d’orchestre », notre « autre cerveau », qui régule de nombreuses fonctions physiologiques. Sa symbiose favorise la santé de l’hôte mais sa dysbiose est à l’origine de phénomènes infl ammatoires chroniques délétères. La connaissance de l’implication du microbiote intestinal dans la pathologie cardiovasculaire telle que l’infarctus du myocarde amène à rechercher des thérapeutiques dans ce sens. Bien que notre compréhension du lien microbiote intestinal – coeur reste encore à approfondir et ne représente que la face découverte de l’iceberg, les études fondamentales et le développement de recherches cliniques aideront à améliorer notre prise en charge des patients cardiovasculaires. L’évolution thérapeutique tend vers une médecine personnalisée et le microbiote intestinal est une cible de choix dans l’adaptation individuelle des traitements.
Caroline Chong-Nguyen
Service de cardiologie, Hôpital Simone Weil, Eaubonne
caroline.ng87@gmail.com
RÉFÉRENCES
1. Tilg, H. A Gut Feeling about Thrombosis. N. Engl. J. Med.374, 2494–2496 (2016).
2. Koeth, R. A. et al. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat. Med.19, 576–585 (2013).
3. Neves, A. L., Coelho, J., Couto, L., Leite-Moreira, A. et Roncon-Albuquerque, R. Metabolic endotoxemia: a molecular link between obesity and cardiovascular risk. J. Mol. Endocrinol.51, R51-64 (2013).
4. Tang, W. H. W. et Hazen, S. L. The Gut Microbiome and Its Role in Cardiovascular Diseases. Circulation135, 1008–1010 (2017).
5. Neri, M. et al. Cardiac oxidative stress and infl ammatory cytokines response after myocardial infarction. Curr. Vasc. Pharmacol.13, 26–36 (2015).
6. Nian, M., Lee, P., Khaper, N. et Liu, P. Infl ammatory cytokines and postmyocardial infarction remodeling. Circ. Res.94, 1543–1553 (2004).
7. Lam, V. et al. Intestinal microbiota determine severity of myocardial infarction in rats. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol.26, 1727–1735 (2012).
8. Azuma, M. et al. Taurine attenuates hypertrophy induced by angiotensin II in cultured neonatal rat cardiac myocytes. Eur. J. Pharmacol.403, 181–188 (2000).
9. Cani, P. D., Osto, M., Geurts, L. et Everard, A. Involvement of gut microbiota in the development of low-grade infl ammation and type 2 diabetes associated with obesity. Gut Microbes3, 279–288 (2012).
10. Parracho, H., McCartney, A. L. et Gibson, G. R. Probiotics and prebiotics in infant nutrition. Proc. Nutr. Soc.66, 405–411 (2007).
11. Dethlefsen, L. et Relman, D. A. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc. Natl. Acad. Sci. U. S. A.108 Suppl 1, 4554–4561 (2011).
12. Chen, J., He, X. et Huang, J. Diet effects in gut microbiome and obesity. J. Food Sci.79, R442-451 (2014).