
Stéphane Combes, Clinique Pasteur, Département de Rythmologie, Toulouse Mark La Meir, Département de Chirugie Cardiaque, Hospital Universitaire de Brussels

Depuis 2 décennies, le traitement de la fibrillation atriale est dominé par l’ablation endocavitaire
qu’elle soit par radiofréquence ou cryoablation.
S’est développée de manière parallèle une technique hybride médico-chirurgicale prometteuse venue de l’approche chirurgicale de Cox Maze.
Pourtant plébicitée par les dernières recommandations européennes, avec un niveau de recommandation, l’ablation hybride de la fibrillation atriale reste peu développée en France de par l’organisation complexe nécessaire mais aussi par son coût.
Dans les années 80, l’ablation chirurgicale de FA est mise à l’honneur par James Cox. Elle évoluera avec les années vers une approche moins invasive. Dérivant de cette technique, l’approche hybride combine l’approche chirurgicale mini-invasive et une étude électrophysiologique associées à une ablation endocavitaire complémentaire si nécessaire. Elles seront effectuées soit dans le même temps soit en deux temps opératoires. Cette technique nécessite l’expertise et les ressources de 2 équipes, chirurgicale et d’électrophysiologie. Elle permet, en outre, de s’affranchir de certains obstacles liés à l’ablation endocavitaire, détaillés dans le tableau ci-dessous. Elle réaliserait des lésions plus efficaces et durables dans le temps pour un effet favorable sur les résultats.
Tableau 1: Avantages et inconvénients de l'approche hybride médico-chirurgicale
Avantages
o Visualisation macroscopique des lésions
o Lésions transmurales
o Absence de sténose pulmonaire
o Ablation des plexus ganglionnaires possible
o Délivrance efficace de la RF sur muscles épais ou graisse
o Ablation des structures épicardiques arythmogènes (ex : ligament de Marshall)
o Accès par voie endocardique à des zones non accessibles par voie épicardique (septum inter ventriculaire, isthme mitral, isthme cavotricuspidien)
o Ligature de l’auricule (potentiel arythmogène : débattu)
o Vérification des blocs de conduction
o Ablation des circuits de tachycardie lorsque conversion de la FA en tachycardie organisée par carte d’activation
o Résultats maintenus dans le temps
Inconvénients
o Morbidité plus élevée qu’une procédure endocardique (risque de conversion en thoracotomie…)
o Durée d’hospitalisation plus longue (entre 5 et 10 jours)
o Coût financier de procédure élevé
Les différentes approches utilisées en France
Pour le premier temps opératoire chirurgical, essentiellement deux systèmes sont utilisés. Le premier consiste en un abord abdominal trans-diaphragmatique (nContactsurgical®, Inc, Morrisville, NC) (Figure 1) avec fenêtre péricardique pour un accès direct au mur postérieur de l’oreillette gauche en évitant une déflation pulmonaire et une dissection des tissus cardiaques avoisinants.
Figure 1 : Approche trans-diaphragmatique d’ablation à énergie unipolaire (nContact surgical®)
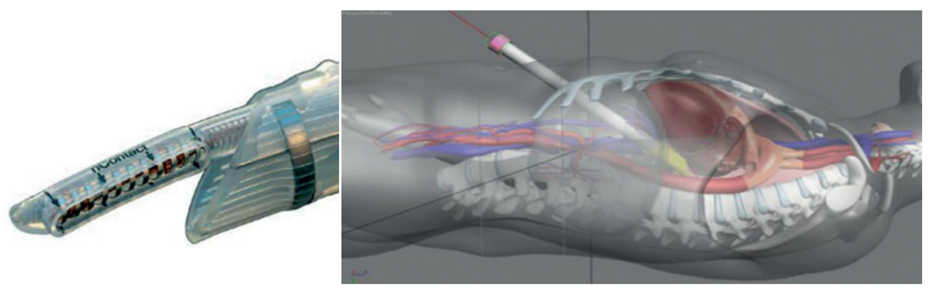
Une canule endoscopique permet de délivrer une énergie de radiofréquence unipolaire sur les antrums des veines pulmonaires et sur tout le mur postérieur de l’oreillette gauche. Le deuxième système s’effectue par abord bi ou unilatéral thoracoscopique avec mise en place de clamp à énergie cette fois-ci bipolaire autour des veines pulmonaires réalisant alors l’isolation antrale (système Atricure®, West Chester, OH, USA). L’intervention sera complétée par isolation du mur postérieur par deux lignes de radiofréquence bipolaire au niveau du toit et du plancher de l’oreillette gauche. Enfin l’auricule est isolé hémodynamiquement et électriquement par un clip dédié (Figure 2).
Figure 2 : Approche thoracoscopique uni ou bilatérale d’ablation à énergie bipolaire.
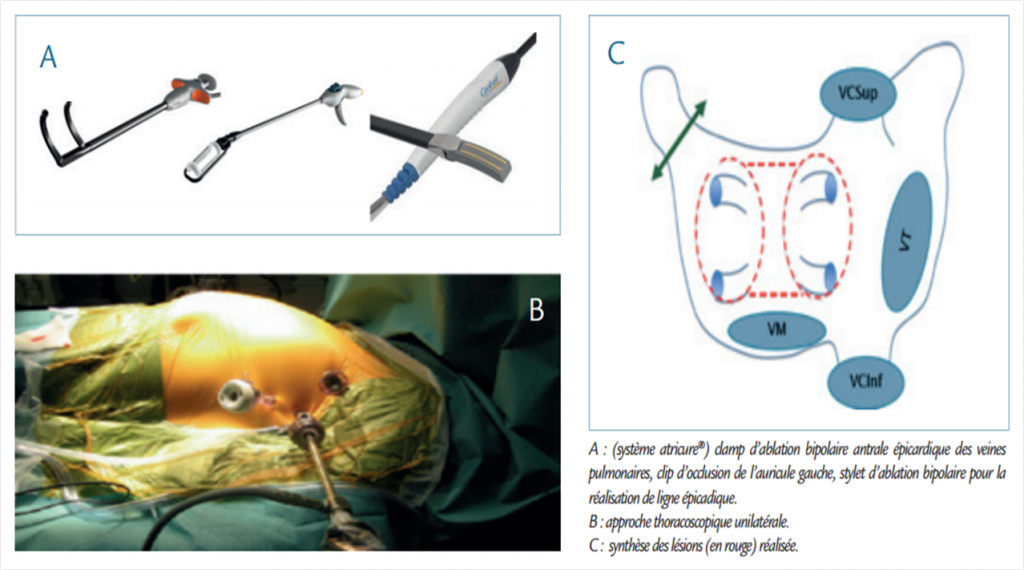
Le deuxième temps opératoire électrophysiologique, réalisé lors de la même procédure ou à distance du temps chirurgical, est identique quelle que soit la technique chirurgicale. Il consiste après la réalisation d’une ponction transseptale à vérifier l’isolation complète des antrums veineux pulmonaires et les lignes de bloc. Les lésions seront complétées si nécessaire par radiofréquence par voie endocardique. La procédure pourra se poursuivre par une ablation ciblée complémentaire bi-atriale.
Figure 3 : Exemple de carte de voltage obtenue après une ablation chirugicale (système de cartographie CARTO III® (BioSense Webster®)). En rouge zone cicatricielle ( < 0,5mv), en violet zone saine > 0,5mV. (A) vue antérieure, (B) vue postérieure
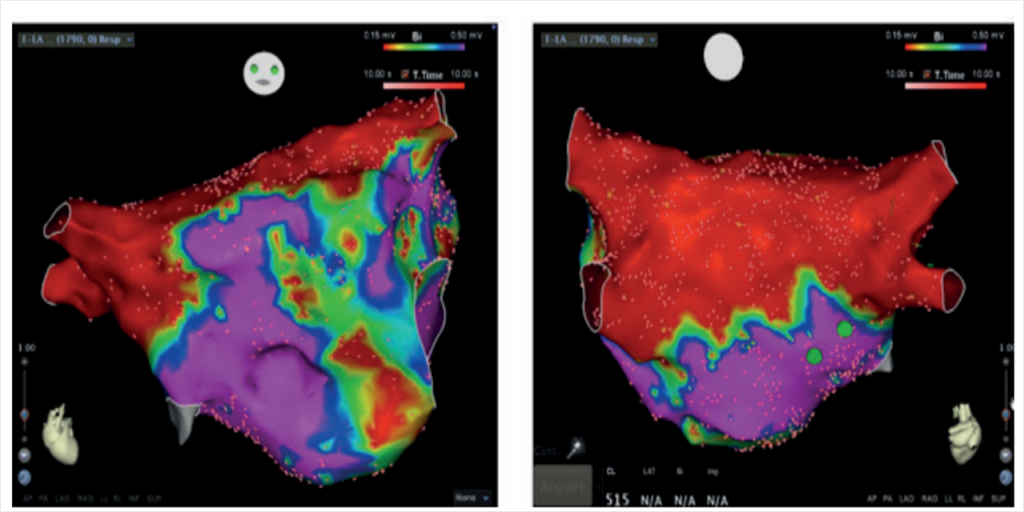
Les preuves scientifiques
La littérature est dense sur le sujet et il est parfois difficile de s’y retrouver tant les techniques utilisées et les lésions réalisées sont nombreuses et différentes. Il s’agit souvent de cohorte de faible volume. Retenons cependant la métanalyse de Van Der Heijden et al4 parue récemment en 2019 permettant d’avoir une bonne vue d’ensemble des résultats de cette approche originale. Dans ce travail, on constate que le taux de rythme sinusal maintenu moyen est significativement plus élevé dans le groupe chirurgical que dans le groupe ablation conventionnelle (70,7% vs 49,9%, P < 0.001) au détriment d’un taux plus important de complication (entre 0 et 17%). A noter que les résultats se maintiennent à 3 ans au contraire de l’ablation endocavitaire pouvant faire supposer des lésions plus durables4. D’autres travaux mettent l’accent sur l’amélioration des indices de qualité de vie postopératoire5 et sur l’intérêt de cette technique après l’échec d’une première procédure endocavitaire6. Rappelons en revanche, qu’il n’existe pas à ce jour d’étude randomisée comparant la technique de référence endocavitaire et l’approche hybride, mais des travaux prospectifs multicentriques sont en cours notamment en France.
L’approche hybride médico-chirugicale de la fibrillation atriale persistante ou de longue durée a été mise en avant lors des dernières recommandations sur le sujet en 2016¹ avec un niveau de recommandation IIa, et un an plus tard dans une conférence de consensus internationale7.
Conclusions
Approche originale unissant le chirurgien cardiaque et l’électrophysiologiste, l’ablation hybride médico-chirurgicale est une alternative validée par les dernières recommandations 2016 de l’ESC. Elle semble plus particulièrement intéressantes dans la prise en charge de la FA persistante ou de longue durée qui reste encore aujourd’hui un challenge difficile. Les prochains travaux comparatifs devront préciser sa place dans la fibrillation atriale.
Références 1. Kirchhof P et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS The Task Force for the management of atrial fi brillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC Endorsed by the European Stroke Organisation (ESO) 2. Cox JL, Boineau JP, Schuessler RB, et al. Successful surgical treatment of atrial fi brillation. JAMA 1991; 266:1976-1980. 3. Van der Heijden CAJ, Vroomen M, Luermans JG et al. Hybrid versus catheter ablation in patients with persistent and longstanding persistent atrial fibrillation : a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2019 4. Maesen B, Pison L, Vroomen M et al. Three-year follow-up of hybrid ablation for atrial fi brillation. Eur J Cardiothorac Surg. 2018 5. Osmancik P, Budera P, Talavera D et al. Improvement in the quality of life of patients with persistent or long-standing persistent atrial fibrillation after hybrid ablation. J Interv Card Electrophysiol. 2019 6. Al-Jazairi MIH, Rienstra M, Klinkenberg TJ et al. Hybrid atrial fi brillation ablation in patients with persistent atrial fibrillation or failed catheter ablation. Neth Heart J. 2019 7. Calkins H et al. HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: executive summary. J Interv card Electrophysiol 2017
