La circulation pulmonaire de l’athlète
L’exercice musculaire aigu perturbe l’homéostasie de l’organisme. Il engendre des réponses immédiates et, en cas d’entraînement régulier, des adaptations bénéfiques pour la performance, réversibles. Les exercices d’endurance intenses et prolongés (marathon, triathlon, ski de fond, cyclisme sur route, natation en eau libre, …) sont les plus contraignants.
La performance dans ces sports est fortement corrélée à la consommation maximale d’oxygène (VO2 max) du pratiquant qui dépend des capacités de réponse des trois maillons du transport et de l’utilisation de l’O2 que sont les systèmes, pulmonaire (SP), cardiovasculaire (SCV) et musculaire squelettique.
Physiologiquement le SCV est un circuit fermé composé de deux unités circulatoires en série, l’unité cœur gauche-circulation systémique et l‘unité cœur droitcirculation pulmonaire. Leurs réponses et adaptations à l’entraînement en endurance sont mieux décrites pour l’unité cœur gauche-circulation systémique. L’unité cœur droit-circulation pulmonaire dont l’entraînabilité paraît moindre pourrait être le maillon faible de la pratique à un haut niveau de l’endurance1.
Rappels anatomiques et physiologiques de l’unité cœur droit-circulation pulmonaire
L’amplitude, qualitative et quantitative, des réponses à l’exercice d’endurance qui dépend des réserves individuelles des systèmes organiques les plus sollicités sont améliorables par un entraînement régulier. Ces améliorations mal évaluables au repos doivent être explorées à l’effort.
Les circulations pulmonaire (CP) et systémique sont similaires architecturalement mais pas hémodynamiquement ni fonctionnellement. Hémodynamiquement, la CP est traversée par un haut débit sanguin, le débit cardiaque (DC), avec une basse pression qui empêche l’extravasation liquidienne vers l’espace interstitiel et permet au ventricule droit (VD) de fonctionner avec un coût énergétique minimal. Fonctionnellement, la CP ne participe pas à la perfusion des organes ventilatoires, dépendante de la circulation bronchique, et se limite à la conduction du sang et à l’hématose sanguine.
Réponses de l’unité cœur droitcirculation pulmonaire à l’exercice musculaire aigu
Les méthodes d’exploration non invasives fiables, comme l’échocardiographie transthoracique et les explorations fonctionnelles respiratoires ont amélioré l’étude des réponses de la circulation pulmonaire à l’effort2, 3.
À l’effort aussi le poumon est le seul organe traversé par l’ensemble du DC qui augmente linéairement et proportionnellement à son intensité avec un plateau à l’effort maximal ou le DC de repos est multiplié par un facteur de 5 à 8 (25 à 40 l/min) selon le niveau de performance physique du pratiquant. Les pressions artérielles pulmonaires (PAP), produit du DC par les résistances vasculaires (RV), augmentent linéairement avec le DC. Les RV pulmonaires diminuent moins que les systémiques. Ainsi les PAP systoliques (PAPS) et moyenne augmentent relativement plus (x 2 à 3) que les systémiques (x 1,5 à 2). La PAPS maximale, mesurée par échocardiographie, qui dépend du DC et de l’intensité de l’effort peut atteindre 60-70 mm Hg chez l’athlète3. La majoration du travail du VD (+170 %), structurellement mal adapté pour cela, est donc plus importante que celle du ventricule gauche (VG, + 23 %). Lors d’un effort intense et bref le VD arrive à maintenir un couplage artério-ventriculaire efficace4. Mais en cas d’exercice très prolongé comme un marathon, les réponses myocardiques fonctionnelles, diastoliques et systoliques, du VD n’équilibrent pas les conséquences des contraintes de l’effort1, 3. Un dysfonctionnement post-effort du VD, asymptomatique et transitoire, plus marqué que sur le VG est observé ainsi à l’échographie5.
Les élévations du DC et de la pression de perfusion pulmonaire augmentent le recrutement et la distension de capillaires pulmonaires fermés au repos. Le maintien d’une hématose adaptée aux besoins accrus de l’organisme par cette réserve vasculaire pulmonaire est prouvée par les majorations du volume sanguin capillaire pulmonaire, de la conductance de la membrane alvéolo-capillaire et de la capacité de diffusion pulmonaire du CO2.
Leur élévation linéaire et proportionnelle à l’intensité de l’effort sans plateau à l’effort maximal témoigne d’une grande compliance des capillaires pulmonaires. L’augmentation majeure de la surface alvéolo-capillaire associée maintient des échanges gazeux efficaces malgré la baisse limitée des RV et les élévations de la PAPS et de la postcharge VD. Une capacité de réserve vasculaire pulmonaire importante, définie comme une faible RV pulmonaire avec une capacité de diffusion pulmonaire élevée, est associée à une VO2 max élevée paramètre indispensable à de la performance d’endurance6. Une étude basée sur l’échocardiographie de contraste à l’effort, a distingué deux groupes d’athlètes très endurants selon leur capacité à recruter des anastomoses artérioveineuses au niveau de la CP3. Une capacité d’ouverture élevée limite l’élévation de la PAPS et donc le travail systolique du VD2. Cette ouverture d’anastomoses participerait aussi à l’augmentation de la différence alvéolo-artérielle et à la désaturation en O2 parfois observée lors des épreuves d’effort chez certains athlètes endurants4. Les effets cliniques en particulier sur la performance sportive à long terme d’un shunt pulmonaire plus ou moins important à l’effort restent à déterminer6, 7. Avec le vieillissement, une moindre capacité de recrutement de ces anastomoses et une baisse de la vasomotricité pulmonaire pourraient partiellement expliquer l’élévation plus marquée de la PAPS à l’effort après 50-55 ans2.
Adaptations de l’unité cœur droit- circulation pulmonaire à l’entraînement en endurance
Un entraînement intense et prolongé, surtout en endurance, induit des modifications physiologiques, électrocardiographiques et échocardiographiques, réunies sous le terme de cœur d‘athlète. Observables au repos les adaptations morphologiques du cœur d’athlète se caractérisent par une dilatation modérée et harmonieuse des quatre cavités cardiaques associée en accord avec la loi de Laplace à un épaississement pariétal. Les adaptations fonctionnelles surtout visibles à l’effort participent à l’augmentation de la VO2 max et aux performances de ces athlètes. Après les efforts, surtout d’endurance, une diminution fonctionnelle ventriculaire surtout droite, associée à des modifications de biomarqueurs myocardiques (BNP et troponines) asymptomatiques et transitoires objectivent une fatigue myocardique post-effort considérée comme physiologique8.
Ventricule droit
L’augmentation du DC à l’effort majore le retour veineux vers l’OD. Cette surcharge volumique détermine la dilatation progressive de l’OD et du VD.
Ainsi par rapport au sujet non entraîné, le VD de l’athlète présente un remodelage excentrique avec une sphéricité majorée et un discret épaississement pariétal. Les diamètres des voies de remplissage et d’éjection du VD sont aussi élargies.
Ses adaptations morphologiques sont plus marquées que sur le VG avec un rapport VD/VG augmenté9. Afin d’éviter des « surdiagnostics » de maladie arythmogène du VD, des normes spécifiques sont proposées pour l’athlète (Tableau 1). À noter qu’à l’inverse du VG il n’est pas rapporté de différence selon l’ethnicité.
Tableau 1. Valeurs (télédiastoliques en mm) acceptables maximales pour les ventricules droit (VD) et gauche (VG) des athlètes adultes. VDD1 = diamètre basal du VD ; VEVD = voie d’éjection du VD ; DTDVG = diamètre télédiastolique du VG.
Modifié d’après la référence 9.

Une légère diminution de la fonction systolique de repos, souvent régionale (basale ou paroi libre médiane), sur un VD avec dilatation ventriculaire télédiastolique importante et volume d’éjection systolique normal est considérée comme physiologique9. En cas de doute, une normalisation rapide de la fraction d’éjection à l’écho d’effort est rassurante7. La relaxation systolique et diastolique tardive est normale ou améliorée. Son altération est à priori pathologique et nécessite des investigations plus approfondies9. Une fuite tricuspide centrale avec une PAPS ne dépassant pas 40 mm Hg au repos est fréquente et classée comme physiologique9.
Il existe une relation dose-réponse entre l’ancienneté de l’entraînement et l’importance des dilatations cavitaires sans altération fonctionnelle significative10. En cas de doute, fréquent en cas de faible expérience du cœur d’athlète, outre l’écho d’effort, c’est l’IRM cardiaque qui aide le plus souvent à affirmer le diagnostic d’une pathologie11.
Veine cave inférieure et oreillette droite
Au repos, la veine cave inférieure est dilatée (26 mm en moyenne jusqu’à 40 mm) chez l’endurant avec une vidange inspiratoire normale9. Pour le remplissage du VD, au repos, l’OD agit comme un « conduit passif » pour le sang protodiastolique avant sa contraction télédiastolique. Pendant l’exercice la surcharge volumique des cavités droites concerne aussi l’OD. À long terme, une dilatation atriale droite est observée au repos avec une onde P ample sur l’ECG fréquente chez les endurants. Cette surcharge volumique prolongée participe à la libération des peptides natriurétiques de type B et de la troponine cardiaque I, déjà citée, rapportée après un marathon8.
Les valeurs maximales de surfaces atriale, en valeur absolue et indexée par la surface corporelle, proposées chez l’athlète sont de 18 vs 15 cm2 et de 10,5 vs 9 cm2 / m2 pour les non entraînés sans différence significative liée au sexe ni à l’ethnicité9.
Adaptations vasculaires pulmonaires
Une amélioration du recrutement de la réserve capillaire pulmonaire, de la capacité de diffusion de la membrane alvéolo-capillaire, et une hypertrophie de la circulation lymphatique améliorant le drainage liquidien extracellulaire sont décrites chez l’athlète2. Lors d’un exercice progressivement croissant pour le même niveau d’effort la pression capillaire pulmonaire augmente moins chez l’athlète que chez le non entraîné (Figure 1).
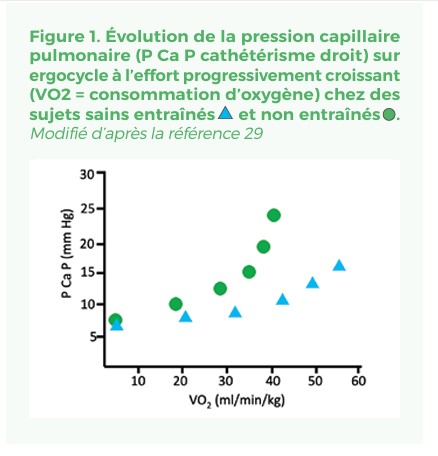
Lors d’un exercice sous maximal prolongé (60 min) réalisé par des athlètes endurants d’âge moyen les PAPS et capillaire pulmonaire augmentent au début puis se stabilisent sans altération de la fonction VD. Chez des sujets sains non entraînés appariés en âge les mêmes pressions et le travail du VD augmentent tout au long de l’exercice. Ces observations suggèrent donc qu’après un entraînement en endurance le VD, les circuits artériels et veineux pulmonaires comme les oreillettes gauches, s’adaptent au débit sanguin élevé induit par l’exercice12. Enfin, récemment une exploration au repos par IRM a évoqué chez certains athlètes endurants (9,3 %) la possibilité d’un remodelage structurel et fonctionnel de l’arbre artériel pulmonaire avec augmentation du diamètre et majoration des RV majorant le travail systolique VD13. Les conclusions proposées sont limitées par le fait que les formules utilisées pour le calcul des RV utilisées n’ont pas été validées chez des sujets sains. Des études complémentaires semblent donc nécessaires.
Limites des réponses et adaptations de l’unité cœur droit-circulation pulmonaire à l’entraînement en endurance
Seules les limitations, aiguës et chroniques, des adaptations de l’unité cœur droit-circulation pulmonaire sont abordées dans cet article. Les limitations spécifiquement pulmonaires comme la bronchoconstriction induite par l’exercice, la fatigue des muscles pulmonaires, la baisse modeste (10-15 %) et asymptomatique des fonctions pulmonaires au décours d’épreuves de longue durée bien décrites dans une excellente revue récente14 ne seront pas abordées ici.
Facteurs limitants la consommation maximale d’oxygène du sujet sain
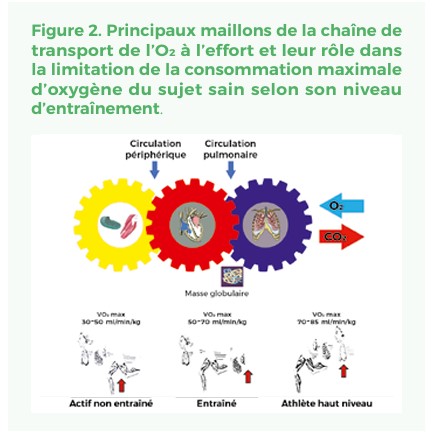
Le facteur limitant principal de la VO2 max varie selon le niveau d’entraînement du sujet sain (Figure 2). Le sujet peu entraîné est limité musculairement. Le SCV et la masse de globules rouges sont en cause chez le sujet modérément entraîné en endurance. Chez ces sujets les réserves microvasculaires alvéolaires pour les échanges gazeux pulmonaires ne sont jamais atteintes même à l’effort maximal. L’athlète endurant de haut niveau de performance qui atteint des niveaux extrêmement élevés de ventilation et de perfusion alvéolaires est limité par ses poumons. En effet, contrairement aux capacités CV et musculaires qui déterminent l’apport d’O2 et l’extraction tissulaire d’O2, les déterminants structurels de la diffusion alvéolaire ne sont pas significativement modifiés par l’entraînement physique. L’augmentation de la capacité ventilatoire observée chez ces athlètes s’explique par l’adaptation de leurs muscles respiratoires alors que leurs réserves microvasculaires pulmonaires avec une limitation de la conductance de la membrane alvéolo-capillaire sont épuisées comme en témoigne l’hypoxémie artérielle observée15, 16.
Limites des réponses de la circulation pulmonaire
Une efficacité optimale de la barrière alvéolo-capillaire est essentielle au maintien d’une hématose alvéolaire suffisante pour assurer un apport d’O2 adapté aux besoins de l’organisme. Elle dépend de sa surface, de son épaisseur, de sa perméabilité fortement liée à la composition du glycocalyx, et au volume de sang dans les capillaires pulmonaires. L’équilibre hydrique pulmonaire qui retentit sur l’épaisseur de cette barrière est indispensable pour un échange gazeux fonctionnel14 efficace. La réabsorption liquidienne à l’extrémité veineuse des capillaires pulmonaires qui est auto-limitée doit être complétée par le drainage des vaisseaux lymphatiques pleuraux pour maintenir un volume minimal de liquide pleural avec une pression sub-atmosphérique (≤ – 5 cm H2O). Différents facteurs de sécurité au niveau de la perméabilité microvasculaire et de la résistance tissulaire au stress mécanique préviennent l’extravasation de liquide.
Lors d’un exercice prolongé d’endurance l’augmentation de la pression capillaire pulmonaire aggravée par l’élévation de la pression dans l’OG et l’effet des cytokines pro-inflammatoires circulantes par son risque de rupture des parois capillaires est un facteur œdématogène. Les signes d’œdème pulmonaire (OP) peuvent être objectivés par l’imagerie, radiographies et scanner, et par l’échographie pulmonaire qui met en évidence des lignes B ou queues de comètes ultrasonores qui reflètent l’eau extravasculaire pulmonaire17. La surveillance posteffort (30 min) de la saturation périphérique en oxygène (SPO2) est aussi proposée14.
Au laboratoire, un test d’effort progressif maximal de courte durée ne déclenche pas d’OP. Il est par contre observé chez 15 % des sujets après 2 heures de course (70 % VO2 max) et chez 65 % après 7 minutes de course à VO2 max14. Sur le terrain, l’imagerie ou l’échographie pulmonaire systématique après des marathons, triathlons, et épreuves de natation en eau libre a révélé chez plus de 50 % des participants des sub-œdèmes pulmonaires généralement pauci- ou asymptomatiques et rapidement résolutifs (12-24 heures). Plus fréquents en cas d’environnement hostile surtout chez des sujets prédisposés ils semblent favorisés par la surhydratation classique chez les sujets peu entraînés14, 18, 19, 20. Les mécanismes physiopathologiques varient selon l’intensité, la durée de l’effort et les conditions environnementales.
Rôle de l’endurance prolongée
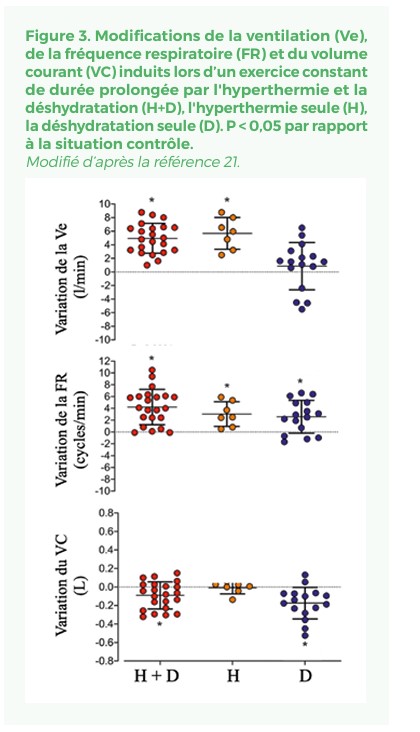
Le cycle inspiration-expiration impose un « dépliagerepliage » alvéolaire. L’hyperventilation lors de l’exercice d’endurance impose un étirement mécanique du parenchyme avec un risque de lésion alvéolaire et majoration de la filtration capillaire et d’OP majoré en cas d’exercice de longue durée. La capacité de thermolyse corporelle est un facteur de performance majeur lors de ces épreuves. Les pertes liquidiennes induites par la transpiration ne peuvent pas être totalement compensées par les apports hydriques. Une déshydratation et une hypovolémie s’installent progressivement avec réduction des flux sanguins systémique et pulmonaire. Pour une intensité d’effort constante, le niveau de VO2 est maintenu par des mécanismes compensateurs comme la tachycardie qui maintient le DC. Au niveau ventilatoire une hyperventilation disproportionnée par rapport aux besoins métaboliques de l’organisme s’installe progressivement avec hypocapnie et hypoperfusion cérébrale secondaires. L’hyperventilation est surtout due à l’hyperthermie centrale et à l’activation sympathosurrénalienne modulatrice de la fonction CV pour compenser les effets délétères de la déshydratation sur la performance (Figure 3). Cette tachypnée « inappropriée » majore la fréquence de dépliage-repliage alvéolaire et donc l’OP interstitiel21.
Rôles de l’environnement
Le facteur oedématogène de l’exercice prolongé est majoré en cas d’hypoxie (plongée, altitude) qui augmente la perméabilité membranaire à l’eau.
Deux environnements, aquatique et haute altitude (HA), favorisent principalement la survenue d‘OP. L’œdème pulmonaire d’immersion (OPI) peu fréquent est assez mal connu des cliniciens y compris du sport17, 22, 23. Initialement décrit chez les apnéistes, il est rapporté chez les plongeurs, les triathlètes, les nageurs et les aqua-joggers (longe-côte). Son incidence (1 à 5 %) varie selon les populations étudiées23. Il est favorisé par l’âge (> 50 ans), le sexe féminin, les facteurs de risque et antécédents cardiovasculaires souvent méconnus, l’hyperhydratation avant l’exercice, le port de combinaisons serrées, l’exposition à l’eau froide et l’entraînement en endurance22. Sa physiopathologie associe la redistribution du sang veineux des extrémités vers la poitrine lors de l’immersion, la vasoconstriction liée au froid, et l’exercice physique qui majorent la pression capillaire pulmonaire avec risque de rupture et d’inondation hydro-sanguine alvéolaire. Chez les apnéistes, le gradient de pression transcapillaire induit par l’effet compressif sur les poumons de la pression hydrostatique et la baisse de la pression de l’air alvéolaire a un rôle majeur. Un trouble de la fonction diastolique du VG serait un facteur favorisant surajouté expliquant l’impact de l’âge et des troubles cardiovasculaires comme l’HTA22, 23.
Essoufflement inadapté, toux, expectorations, hémoptysie voire hypoxie post-immersion sont les symptômes dominants avec à l’auscultation des râles et/ ou des crépitants associés à une hypoxémie. L’imagerie montre des infiltrats et/ou des opacités acineuses et lobulaires en verre dépoli23. Une sortie immédiate de l’eau avec prise en charge adaptée (O2, agonistes des bêta 2, diurétiques) à la gravité clinique permet une évolution le plus souvent favorable en moins de 48 heures. Les formes mineures transitoires peuvent ne pas inquiéter le sportif qui ne va pas consulter avec un risque de récidive imprévisible et potentiellement grave. La reprise de la natation, progressive et dans un environnement contrôlé, éventuellement avec prise de sildénafil avant l’effort est envisageable après décision partagée avec le patient bien informé des risques23.
En HA, un œdème (OPHA) dont le risque est majoré par l’exercice peut se développer progressivement (2 à 5 jours) surtout chez des sujets prédisposés. L’hypertension artérielle pulmonaire secondaire à l’hypoxémie vasoconstrictive due à la baisse de pression partielle en O2 associée au phénomène de dépliagerepliage augmentent la perméabilité microvasculaire et diminue la résistance de la paroi capillaire et donc la survenue d’un OPHA14, 20.
Limites des adaptations du cœur droit de l’athlète
Une courbe en J ou U, sans dose limite bien définie de volume et d’intensité de pratique sportive, pourrait illustrer la relation entre quantité de pratique et bénéfice pour la santé de l’activité physique ou sportive24. Les bénéfices sanitaires de sa pratique régulière et modérée (150 minutes/semaine) imposent sa recommandation à la population générale et sa prescription dans la plupart des maladies chroniques.
À l’inverse, chez les athlètes de très haut niveau d’endurance (20 à 32 h/semaine), des pathologies CV sont rapportées chez certains sujets probablement prédisposés. De par les contraintes hémodynamiques particulières et métaboliques (inflammation, stress oxydatif, acidose, catécholamines, …) générales imposées par l’endurance l’unité cœur droit-circulation pulmonaire est particulièrement exposée. Les deux limites du cœur droit de l’athlète endurant les plus citées et étudiées sont la fibrillation atriale (FA) et la cardiomyopathie arythmique du ventricule droit26, 27. Une baisse de l’efficacité du système immunitaire pourrait aussi favoriser la survenue de myocardites potentiellement fibrosantes24, 25.
La fibrillation atriale de l’athlète
Un mode de vie sédentaire augmente le risque de FA alors qu’une activité physique légère à modérée le réduit. À l’inverse, la prévalence de la FA est plus élevée (x 5 en moyenne) chez les athlètes que dans la population générale. Les endurants d’âge moyen très entraînés depuis longtemps (5 à 10 % des marathoniens après 35 ans) sont les plus concernés8, 27. Plusieurs mécanismes plus ou moins associés favorisent la FA chez les athlètes (Figure 4).

L’apparition de la FA n’est pas spécifiquement liée à l’OD, mais les effets de l’entraînement sur le remplissage de l’oreillette gauche (OG) via les veines pulmonaires ont un impact majeur sur celle-ci. En bref la FA peut s’expliquer par une dilatation atriale avec altération fonctionnelle associée à de l’inflammation et à de la fibrose favorisant le développement d’activités électriques ectopiques au niveau de l’abouchement des veines pulmonaires et modulées par les modifications du système nerveux autonome. Une prédisposition génétique a récemment été proposée27.
Toute FA doit bénéficier d’un bilan étiologique exhaustif. Le traitement à privilégier et recommandé est l’ablation. L’indication du traitement anticoagulant est le même que pour tout patient avec une FA. La preuve du bénéfice de la restriction de l’entraînement sur son évolution n’est pas démontré. Enfin la FA, paroxystique asymptomatique ou symptomatique avec une cadence ventriculaire adaptée à l’effort, n’est pas une contreindication à la pratique sportive, sauf pour les sports de contact en cas d’anticoagulant8.
La cardiomyopathie arythmogène du ventricule droit
Les cardiomyopathies arythmogènes (CMA) associent une dilatation-dysfonction ventriculaire avec atrophie myocardique et infiltration fibro-adipeuse pariétale et un risque de troubles du rythme ventriculaire graves (Figure 5). Le VD est principalement concerné (CMAVD) mais des formes VD-VG ou VG peuvent être observées8, 25.
La distinction CMAVD – cœur d’athlète peut être un défi pour les cardiologues du sport25. Les adaptations du VD de 99 % des athlètes endurants sont physiologiques avec dysfonction. Un remodelage structurel du VD disproportionné souvent compliqué d’arythmies venant du VD a été rapporté chez certains endurants (Figure 5) surtout s’ils présentent une prédisposition génétique desmosomale cliniquement silencieuse24. En effet, chez ces sujets la pratique sportive intense peut révéler la maladie ou aggraver son évolution, et toute pratique sportive intense est contre-indiquée

même chez les sujets génotype +/phénotype24. D’autres données, expérimentales et cliniques, ont montré que les contraintes de l’entraînement intense et prolongé pouvaient favoriser le développement de zones de fibrose myocardique. Fréquemment localisées au niveau des points d’insertion du VD sur le VG chez des jeunes athlètes, elles n’ont pas de valeur pathologique. Chez l’endurant plus âgé elles sont observées surtout au niveau du septum VG24, 26.
Conclusion
Les effets de l’entraînement en endurance sur l’unité cœur droit-circulation pulmonaire la circulation pulmonaire restent peu étudiés. Des adaptations moins marquées que celles de l’unité cœur gauche-circulation systémique sont cependant rapportées. Parfois du fait du niveau de pratique, de la nature des contraintes, et surtout du patrimoine génétique du pratiquant, les limites adaptatives peuvent être dépassées avec un remodelage structurel et/ou fonctionnel pathologique avec apparition de foyers arythmiques atriaux ou ventriculaires.
François Carré, Université Rennes – CHRU Rennes-INSERM U1099
RÉFÉRENCES
La Gerche A, Roberts T, Claessen G, et al. The response of the pulmonary circulation and right ventricle to exercise: exercise-induced right ventricular dysfunction and structural remodeling in endurance athletes (2013 Grover Conference series). Pulm Circ, 2014, 4 : 407-416.
Taylor BJ Coffman KE, Summerfield DT, et al. Pulmonary capillary reserve and exercise capacity at high altitude in healthy humans Eur J Appl Physiol 2016; 116:427–437
La Gerche A, Mac Isaac AI, Burns AT et al. Pulmonary transit of agitated contrast is associated with enhanced pulmonary vascular reserve and right ventricular function during exercise. J Appl Physiol 2010; 109:1307-17.
Chemla D, Berthelot E, Assayag P, Physiopathologie hémodynamique du ventricule droit. Rev Mal Resp 2018; 35:1050-62
Lord RN, Zoe H. Adams ZH, George K et al. Exploratory assessment of right ventricular structure and function during prolonged endurance cycling exercise. Echo Res Prac 2023; 10: doi.org/10.1186/s44156-023-00035-8
Sanz-de la Garza M, Antonia Vaquer-Seguı A, Karina Dura K, et al. Pulmonary transit of contrast during exercise is related to improved cardio-pulmonary performance in highly trained endurance athletes. Eur J Prev Cardiol 2020; 27: 1504-14 La
Gerche A, Rakhit DJ, Claessen G. Exercise and the right ventricle : a potential Achilles’ heel. Cardiovasc Res. 2017; 113: 1499-1508
Leischik R, Dworrak, Strauss M Special Article – Exercise-induced right ventricular injury or arrhythmogenic cardiomyopathy (ACM): The bright side and the dark side of the moon. Prog Cardiovasc Dis 2020; 63 : 671–681
D’Andrea A, Formisano T, Riegler L et al. Acute and Chronic Response to Exercise in Athletes: The «Supernormal Heart» Adv Exp Med Biol 2017: 999: 21-41
Sørensen E, Myrstad M, Solberg MG, et al. Right heart structure and function in lifelong recreational endurance athletes with and without paroxysmal atrial fibrillation. J Am Soc Echocardiogr. 2022; 35 :1259-1268
Maceira AM, Monmeneu JV, Pilar López M, et al. J CardiovasMag Res 2023 25:12 https://doi.org/10.1186/ s12968-023-00910-7
Buchan TA, Wright SP, Esfandiari S, et al. Pulmonary hemodynamic and right ventricular responses to brief and prolonged exercise in middle-aged endurance athletes. Am J Physiol Heart Circ Physiol. 2019; 316: H326-H334.
Domenech-Ximenos B, Sanz-de la Garza M, Prat-Gonzalez S et al. Exercise-induced cardiopulmonary remodeling in endurance athletes: Not only the heart adapts. Eur J Prev Cardiol 2019; DOI: 10.1177/2047487319868545
Miserocchi G· Egidio Beretta E A century of exercise physiology: lung fluid balance during and following exercise. Eur J Appl Physiol 2023; 123:1–24 Joyner MJ, Dominelli PB Central cardiovascular system limits to aerobic capacity Exp Physiol 2021; 106: 2299-2303
Hsia CC, Hyde DM, Weibel ER.Lung Structure and the intrinsic challenges of gas exchange. Compr Physiol. 2016; 6: 827-95
Patrician A, Pernett F, Lodin-Sundström A et al. Association between arterial oxygen saturation and lung ultrasound B-lines after competitive deep breath-hold diving.Front. Physiol. 2021 ; 12:711798. doi: 10.3389/fphys.2021.711798
Zavorsky GS, Milne EN, Lavorini F, et al. Interstitial lung edema triggered by marathon running. .Respir Physiol Neurobiol. 2014; 190: 137-41
Boussana A, Galy O, Le Galla ais D et al. The effect of an olympic distance triathlon on pulmonary diffusing capacity and its recovery 24 hours later J Hum Kinet 2021; 80: 83-92.
Bove AA. Pulmonary aspects of exercise and sports. Methodist Debakey Cardiovasc J. 2016; 12: 93-7.
González-Alonso J, Calbet JAL, Mora-Rodríguez R, et al. Pulmonary ventilation and gas exchange during prolonged exercise in humans: Influence of dehydration, hyperthermia and sympathoadrenal activity. Exp Physiol 2023; 108 :188-206.
Tetzlaff K, Swenson ER, Bärtsch P. An update on environment-induced pulmonary edema – «When the lungs leak under water and in thin air» Front Physiol. 2022 doi: 10.3389/fphys.2022.1007316
Smith R, Ormerod JOM, Sabharwal N, et al. Swimming-induced pulmonary edema: current perspectives. Open Access J Sports Med. 2018; 9: 131-137
Stadiotti I, Lippi M, Maione AS, et al. Cardiac biomarkers and autoantibodies in endurance athletes: potential similarities with arrhythmogenic cardiomyopathy pathogenic mechanisms. Int J Mol Sci. 2021; 22: doi: 10.3390/ijms22126500.
D’Andrea A, Formisano T, La Gerche A, et al. Right heart-pulmonary circulation unit in cardiomyopathies and storage diseases. Heart Fail Clin. 2018; 14: 311-326
Shen MJ, Arora R, Jalife J. Atrial myopathy. JACC Basic Transl Sci. 2019; 4: 640-654
Tso J, Kim JH Master endurance athletes and cardiovascular controversies. Curr Sports Med Rep. 2020; 19:113-118
Achkasov E, Bondarev S, Smirnov V et al. Atrial fibrillation in athletes-features of development, current approaches to the treatment, and prevention of complications. Int J Environ Res Public Health. 2019; 16: doi: 10.3390/ijerph16244890
Stickland MK, Welsh RC, Petersen SR, et al. Does fitness level modulate the cardiovascular hemodynamic response to exercise ? J Appl Physiol. 2006;100:1895-1901
