AU CŒUR DES JEUX OLYMPIQUES : LA SANTÉ CARDIAQUE DES ATHLÈTES
Le système cardiovasculaire des sportifs paralympiques
François Carré, Université Rennes – CHRU Rennes-INSERM U1099

La proportion de personnes souffrant de déficiences physiques ou mentales augmente dans la population active. Ainsi, les lésions de la moelle épinière (LME), de cause traumatique et non traumatique, concernent plus de 20 millions de personnes dans le monde(1). La participation à des activités physiques (AP) et sportives de sujets porteurs de handicap a été, à juste titre, encouragée et les sports paralympiques deviennent de plus en plus populaires.
Les Jeux internationaux de Stoke Mandeville mis en place en 1948 par un neurologue allemand le Dr Guttman proposés initialement aux seuls sujets avec des LME se sont progressivement ouverts aux autres handicapés physiques, mentaux ou sensoriels. Ils ont été remplacés en 1964 par les premiers Jeux Paralympiques parallèlement aux Jeux Olympiques de Tokyo. Les sportifs paralympiques, modèles de résilience, de volonté et de réussite suivent des entraînements très intenses qui leur permettent de réaliser des performances impressionnantes (marathon en fauteuil roulant 1 h 17 min 6 sec pour les hommes et 1 h 34 min 16 s pour les femmes). Ces sportifs ont rapidement suscité un intérêt médical et scientifique croissant, particulièrement pour leur évaluation cardiovasculaire, qui a donné naissance à la médecine paralympique(2). Sur le plan des adaptations à l’effort physique, deux groupes de sportifs sont individualisés, les ambulatoires capables de se tenir debout et les sujets en fauteuil roulant parmi lesquels les sportifs avec LME qui présentent en plus des limitations neurologiques. La plupart des études actuelles concernent ces derniers. Cet article comprend deux parties, la première concerne la pratique d’AP et sportives par les sujets avec une LME et la seconde est focalisée sur les sportifs paralympiques surtout de haut niveau d’entraînement.
Les Jeux internationaux de Stoke Mandeville mis en place en 1948 par un neurologue allemand le Dr Guttman proposés initialement aux seuls sujets avec des LME se sont progressivement ouverts aux autres handicapés physiques, mentaux ou sensoriels. Ils ont été remplacés en 1964 par les premiers Jeux Paralympiques parallèlement aux Jeux Olympiques de Tokyo. Les sportifs paralympiques, modèles de résilience, de volonté et de réussite suivent des entraînements très intenses qui leur permettent de réaliser des performances impressionnantes (marathon en fauteuil roulant 1 h 17 min 6 sec pour les hommes et 1 h 34 min 16 s pour les femmes). Ces sportifs ont rapidement suscité un intérêt médical et scientifique croissant, particulièrement pour leur évaluation cardiovasculaire, qui a donné naissance à la médecine paralympique(2). Sur le plan des adaptations à l’effort physique, deux groupes de sportifs sont individualisés, les ambulatoires capables de se tenir debout et les sujets en fauteuil roulant parmi lesquels les sportifs avec LME qui présentent en plus des limitations neurologiques. La plupart des études actuelles concernent ces derniers. Cet article comprend deux parties, la première concerne la pratique d’AP et sportives par les sujets avec une LME et la seconde est focalisée sur les sportifs paralympiques surtout de haut niveau d’entraînement.
Activités physiques et sportives par les sujets atteints de LME
Particularités des réponses cardiovasculaires, ventilatoires et thermorégulatrices à l’exercice d’un sujet lésé médullaire
• La consommation maximale d’oxygène En bref, la capacité d’exercice, reflétée par sa consommation maximale d’oxygène (VO2 max), d’un sujet avec LME est inversement proportionnelle au niveau de sa lésion et à son degré d’intégralité(3).
La cholestyramine, résine échangeuse d’ions, reste stable au fil du temps. La diminution de l’utilisation des fibrates est régulière, avec une baisse de trois-quarts entre 2000 et 2024, ce qui est logique compte tenu de l’absence de bénéfice cardio-vasculaire constatée dans différentes études cliniques. Enfin, on remarque une chute brutale des oméga 3 à partir de 2015, à la suite du déremboursement de l’Omacor. On verra dans les années à venir si les résultats contradictoires des études REDUCE-IT puis STRENGTH modifient les habitudes de prescription.
En bref, la capacité d’exercice, reflétée par sa consommation maximale d’oxygène (VO2 max), d’un sujet avec LME est inversement proportionnelle au niveau de sa lésion et à son degré d’intégralité(3). Les LME au-dessus du sixième segment thoracique (LME ≥ T6) perturbent la commande sympathique au niveau et en dessous de la lésion, ce qui altère les réponses cardiovasculaires à l’exercice(1,3). L’alitement plus ou moins prolongé secondaire à la pathologie peut être responsable d’un remodelage délétère du ventricule gauche (VG) avec trouble de la fonction systolique et diastolique(4,5) et d’une fonte des muscles squelettiques avec altération fonctionnelle de leur métabolisme aérobie(3).
La VO2 max est le produit du débit cardiaque et de la différence artério-veineuse en O2. Son niveau dépend des qualités ventilatoires, cardiovasculaires et musculaires squelettiques du sujet évalué.
Sur le plan ventilatoire, le déficit concerne surtout les muscles expiratoires, mais aussi inspiratoires en cas de LME haute. La compliance pulmonaire et l’excursion diaphragmatique sont aussi diminuées. Le volume maximal expiré en 1 s (VEMS) est ainsi diminué de 10 % et 40 % respectivement chez les paraplégiques et les tétraplégiques(3).
Sur le plan cardiovasculaire, à l’effort maximal, le débit cardiaque est diminué par la baisse de la fréquence cardiaque maximale (≤ 120-125 bpm en cas de lésion haut située) et du volume d’éjection systolique par baisse de la contractilité myocardique si LME ≥ T6 et du retour veineux par l’absence de contractionrelaxation des muscles squelettiques paralysés et par une veinoconstriction altérée(3,4). L’élévation de la pression artérielle systolique (PAS) est limitée par une faible vasoconstriction(4). Lors d’exercices d’haltérophilie les évolutions de la PAS après l’effort différent chez les valides et les sujets avec LME. Si la PAS est toujours augmentée par l’exercice, elle redescend plus vite et pendant plus longtemps après celui-ci chez les sportifs avec LME(6).
Sur le plan musculaire, la masse musculaire fonctionnelle et sa capacité d’extraction de l’oxygène à l’effort sont d’autant plus diminués que le sujet est peu actif d’où une différence artério-veineuse limitée améliorable par l’entraînement physique. Enfin, les sujets avec LME utilisent principalement, voire exclusivement, la musculature du haut du corps pour leurs activités sportives. D’où une fatigabilité précoce et une limitation de la consommation maximale d’oxygène (VO2 max) qui chez des sujets sains est en moyenne égale à 75 % de celle obtenue avec les jambes. La VO2 max atteinte avec les bras par des sportifs paraplégiques est inférieure de 24 % à celles de sportifs valides avec les jambes bloquées sans différence sur le coût énergétique(6). Au total, des valeurs moyennes de VO2 max entre 0,76 et 1,03 l/ min 1,03 et 2,51 l/min respectivement pour les sujets tétraplégiques et paraplégiques non ou peu entraînés, sont rapportées. Ces valeurs sont améliorables par l’entraînement physique.
- Réponses thermorégulatrices à l’effort
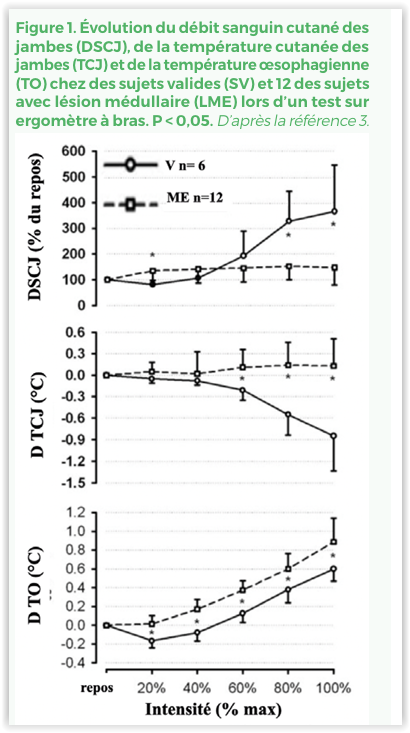
Une thermorégulation efficace est un élément majeur de la performance physique en particulier en cas de conditions, chaudes ou froides, difficiles. La fonction thermorégulatrice des sujets avec LME est perturbée avec, surtout en cas de LME complète, une perte de vasodilatation et de transpiration, sous le contrôle du système nerveux autonome, efficaces sous le niveau de la LME (Figure 1)(3,6). Si les sujets paraplégiques supportent généralement assez bien cette contrainte, cela est particulièrement critique pour les personnes tétraplégiques ou en cas de conditions thermiques difficiles avec un risque d’hyperthermie voire de coup de chaleur avec défaillance cardiaque(6). Des stratégies de refroidissement, en particulier des extrémités, et/ ou le port de gilets réfrigérants ou l’utilisation de vaporisateurs montrent une relative efficacité(3). De même la pratique de sports de neige et de glace peut être limitée. Les sportifs avec LME s’adaptent mal à la baisse de la pression barométrique associée à l’altitude et présentent un taux élevé de mal aigu des montagnes et l’absence de capacité de vasoconstriction en dessous du niveau de la LME aggrave le risque d’hypothermie. Les sportifs avec déficience d’un membre peuvent aussi potentiellement perdre plus de chaleur en raison de la réduction de leur masse musculaire squelettique(6).
- La dysréflexie autonome
La dysréflexie autonome est particulièrement fréquente chez les personnes avec des LME au-dessus de T6. Elle consiste en une vasoconstriction générale réflexe en réponse à un stimulus nociceptif induite par le système sympathique dans les parties du corps non innervées. Il s’ensuit une poussée d’hypertension artérielle sévère, une transpiration excessive, des céphalées, des tremblements et des troubles de la vision. Une bradycardie réflexe marquée et brutale avec vasodilatation dans les zones innervées du corps corrective représente une urgence clinique avec nécessité d’éliminer la source nociceptive(3). Le « boosting » correspond à une dysréflexie volontairement induite, par l’intermédiaire d’un globe vésical, pour améliorer les performances sportives. Outre son risque sanitaire, le boosting considéré comme une méthode de dopage est interdit par les instances sportives.
Prévalence des facteurs de risque et maladies cardiovasculaire chez les lésés médullaires
Le niveau de sédentarité très élevé des lésés médullaires est malheureusement peu modifiable. Leur inactivité physique fréquente est favorisée par leurs limitations physiques mais aussi par les barrières environnementales et psychologiques qu’ils rencontrent. Ainsi, environ 50 % des sujets limitent leur engagement, quantitatif et qualitatif, dans une AP journalière(4,5). L’association AP réduite et perte des contrôles somatique et autonome induit un déconditionnement physique accéléré, avec accumulation de graisse ectopique, apparition d’un profil métabolique défavorable et baisse marquée de la CCR. Le risque de développer précocement des facteurs de risque puis des maladies cardiovasculaires est majoré par rapport à la population valide (Tableau 1)(1,5,7,8).

Dans les pays de haut niveau économique, les progrès des traitements et des techniques de réadaptation médicale ont nettement augmenté l’espérance de vie de ces patients qui reste cependant inférieure à celle de la population générale (8). De plus, leurs principales causes de décès rapportées qui étaient classiquement les affections respiratoires et rénales sont aujourd’hui le diabète et les maladies cardiovasculaires(9,10). Ainsi, le risque de décès lié à une maladie cardiovasculaire est multiplié par 3 chez les lésés médullaires par rapport à la population générale(11).
De plus une étude rétrospective a montré que les facteurs de risque traditionnels sous-estiment beaucoup la survenue à 5 ans de la morbidité et de la mortalité cardiovasculaires chez les personnes avec une LME. Alors que le score médian de risque à 5 ans de Framingham était de 1,6 % sur un suivi de 5,7 ans, 19,5 % patients ont développé un événement cardiovasculaire, dont 10 décès.
Il semble que ces marqueurs doivent encore être utilisés mais que d’autres études cliniques sont justifiées pour préciser les valeurs seuils des facteurs de risque cardiovasculaires et la prise en charge préventive précoce de ces patients (12
Effets d’une pratique régulière d‘activité physique chez les lésés médullaire
Pour la population générale adulte, l’organisation mondiale de la santé recommande une pratique régulière d’AP (aérobie et renforcement musculaire) modérée d’au moins 150 minutes par semaine, ou d’AP intense d’au moins 75 minutes par semaine, ou d’un mix des deux en veillant à ne pas rester plus de 48 heures sans pratique d’AP.
En cas de LME les bénéfices, sur le risque cardiométabolique, la fonction myocardique systolique et la CCR, d’une pratique régulière d’AP sont prouvés(5,13,14). Mais, leurs réponses à l’effort limitées réduisent les gains de cette pratique par rapport à des sujets ambulatoires pratiquant la même activité(6). Ainsi pour optimiser les bénéfices de l’AP les lésés médullaires qui le peuvent devraient pratiquer ou approcher une AP vigoureuse, associant aérobie et renforcement musculaire, d’au moins 150 min/semaine. Ceux qui ne peuvent atteindre de telles intensités devraient pratiquer au moins 250 à 300 min/semaine d’AP à un niveau d’intensité optimal, essoufflement marqué mais encore confortable, selon leurs capacités(11,15).
Spécificités cardiovasculaires des sportifs paralympiques
Consommation maximale d’oxygène des sportifs paralympiques
Relativement peu d’études ont évaluées les valeurs de VO2 max des sportifs paralympiques. La plupart ont concernés les sports pratiqués en position assise ou allongée, vélo à mains (handbike) ou en fauteuil(16,17). A notre connaissance quasiment pas de données, ou sur de très faibles échantillons, concernant les sportifs paralympiques ambulatoires ont été publiées.
Les sportifs utilisant un handbike sont classés de H1 à H5 selon le niveau décroissant de leur handicap. Leurs VO2 max varie de 1,3 l/min (17,3 ml/min/kg, 100 watts) pour les sportifs H1 à 3.7 l/min −1 (49.7 ml/min/kg, 250 watts) pour les H5(16).
Chez les sportifs en fauteuil (n=771, 56 % avec LME, 87 % hommes) les valeurs moyennes de VO2 max rapportées dans 14 sports différents (30 % basket-ball, 27 % course, 15 % rugby) allaient de 2,9 l/min (45,6 ml/ min/kg) en ski nordique assis à 1,4 l/min (17,3 ml/min/ kg) en tir et 1,3 l/min. Le fait d’être un homme, d’être amputé, de ne pas être tétraplégique, et de passer des tests d’effort sur ergomètre avec son fauteuil ou sur tapis roulant étaient associés à des valeurs de VO2 max plus élevées(17).
La VO2 max des sportifs avec LME VO2 max (27,1 [234] vs 38,5 [30-47] ml/min/kg ; p = 0,001) était plus faible que celle des sportifs sans LME(18). Les spécialistes d’endurance, avec ou sans LME, avaient une VO2 max plus élevée que les non endurants (46 [39-55] vs 30 [2535] ml/min/kg ; p = 0,001). Ces valeurs étant nettement plus faibles que celles rapportées chez les valides(20). La relation, décrite chez les valides, entre l’importance du remodelage, diamètre et masse VG indexée, et le niveau de VO2 max a été retrouvée chez les sportifs paralympiques.
Un bilan cardiologique (clinique, ECG repos et effort, échocardiogramme) a été réalisé chez 252 sportifs italiens (32 (29 à 41) ans, 188 hommes, 110 avec LME) ayant participé aux jeux paralympiques(21). La VO2 max des sportifs avec LME était plus faible (27,1 [2-34] vs 38,5 [3047] ml/min/kg ; p = 0,001) que celle des sportifs sans LME. Les spécialistes d’endurance, avec ou sans LME, ont une VO2 max plus élevée que les non endurants (46 [39-55] vs 30 [25-35] ml/min/kg ; p = 0,001) (18). Ces valeurs étant nettement plus faibles que celles rapportées chez les valides(17,18). L’amélioration de la VO2 max observée paraît pour la plus grande part expliquée par une amélioration musculaire, quantitative et qualitative, des muscles squelettiques efficients(17). Mais, la relation, décrite chez les valides, entre l’importance du remodelage, diamètre et masse indexée, du VG et le niveau de VO2 max est aussi retrouvée chez les sportifs paralympiques(17).
Le cœur du sportif paralympique
Chez un sujet valide, la pratique intense et régulière d’une pratique sportive, surtout d’endurance, peut induire des adaptations électrocardiographiques et échographiques réunies sous le terme de cœur d’athlète. Les adaptations, morphologiques et fonctionnelles, du myocarde et des vaisseaux périphériques en augmentant le débit cardiaque maximal participent à l’amélioration de la VO2 max et de la performance sportive(18).
Quelques travaux se sont intéressés aux caractéristiques du cœur de l’athlète paralympique En 2007 il a été observé chez des sportifs handicapés, spécialistes de disciplines dynamiques ou statiques, des adaptations myocardiques, dilatation cavitaire prédominante avec hypertrophie pariétale réactionnelle modérée, proches de celles observées chez les valides. Ces adaptations étaient moins marquées chez les sportifs en fauteuil roulant, même sans LME, que chez les sportifs handicapés ambulatoires(19). Ainsi, chez des judokas ambulatoires malvoyants (n=14, 8 hommes) de haut niveau d’entraînement (VO2 max = 62,70 ± 9,99 mlO2/ min/kg) les adaptations sont les mêmes que celles des athlètes valides. Masse VG indexée et diamètre télédiastolique étant bien corrélés (r=0,8) à la VO2 max(20).
Chez les sportifs paralympiques italiens déjà cités les modifications ECG étaient plus fréquentes chez les sportifs avec LME (11,8 %) que chez les non LME (4, 2 % ; p = 0,003)(18). Leur fréquence cardiaque de repos était plus élevée. Les autres modifications ECG classiques (R et S amples, ST surélevé, bloc de branche droit incomplet) décrites chez l’athlète valide(21) ont été retrouvées chez 33 % des sportifs, surtout endurants, paralympiques(18). La proportion d’anomalies de l’ECG non liées à l’entraînement, surtout ondes T inversées sans cause retrouvée, était voisine de celle rapportée chez les sportifs valides et concernaient surtout les sportifs avec LME avec plus de facteurs de risque cardiovasculaire et de comorbidités cardiaques ou systémiques(12, 18).
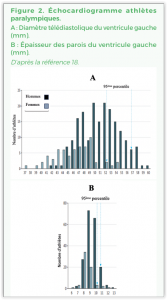
Sur l’échocardiogramme (Figure 2), le diamètre télédiastolique (48 [46-52] vs 51 [48-54] mm ; p = 0,001) et la masse VG indexée (80,6 [69-94] vs 91,3 [80-108] g/m2 ; p= 0,001) étaient moindres chez les sportifs avec LME. La dilatation VG moindre, malgré un niveau d’entraînement similaire, peut s’expliquer par leurs réponses limitées à l’effort déjà décrites et en particulier par un retour veineux moindre.
Comme chez les valides, le type de sport pratiqué est un déterminant majeur de l’importance du remodelage du VG qui est plus dilaté chez les endurants (handbike, cyclisme, aviron, ski de fond) que pour les autres disciplines (52 [47-54] vs 49 [47-53] mm ; p = 0,006) et avec une paroi un peu plus épaisse (10 mm vs 9 mm NS). Les épaisseurs pariétales du VG sont restées dans les limites de la normales (≤ 12 mm) chez tous les sportifs, indépendamment du sexe, du type de handicap, du sport pratiqué et de la morphométrie. Ainsi, comme chez le sportif valide une épaisseur de paroi VG ≥ 13 mm mérite d’être explorée. Les fonctions VG de repos ne sont pas altérées par la pratique sportive quel que soit le type et la gravité du handicap et le sport pratiqué. Les endurants avec LME présentaient un diamètre et une masse VG similaires à ceux des sportifs sans LME. La pratique de ce type de sport pourrait donc aider à compenser les limitations cardiovasculaires inhérentes à la LME(18).
Pathologies cardiovasculaires observées chez les sportifs paralympiques
- Risque cardiovasculaire des sportifs paralympiques
Le risque de lésions vasculaires athéromateuses est souvent sous-estimé chez les sportifs valides du fait d’une dyslipidémie non rare et souvent sous-traitée(22). Le profil lipidique des 289 sportifs paralympiques (JO Londres 2012 à Pékin 2022) répartis en 2 groupes, LME et non-LME, a été étudié. 35 % avaient un taux de LDL ≥ 115 mg/100 ml. Les taux moyens de LDL et de HDL des LME était respectivement plus élevé et plus bas que celui des non LME. Le profil lipidique des endurants était moins altéré (LDL plus bas et HDL plus haut) que ceux des autres disciplines(23). L’indice ESC-SCORE2 du risque de développer une maladie cardiovasculaire a été évalué chez 99 sportifs paralympiques âgés d’au moins 40 ans (78 % d’hommes, 45,7 ± 4,7 ans, 52,5 % LME). Parmi eux 54 % étaient dyslipidémiques et 23 % fumeurs. Selon l’ESCSCORE2, 29 % avaient un risque élevé et 1 % un risque très élevé. Les femmes et les endurants présentaient un meilleur profil CV. En dehors d’un HDL plus bas et d’une CCR plus faible aucune différence n’a été observée entre les sportifs avec LME et les non-LME. A noter qu’aucun sportif dyslipidémique n’était sous traitement pharmacologique, bien que leur profil lipidique altéré ait déjà été détecté(24).
- Autres pathologies cardiovasculaires
Dans une population de 2352 (âge 25 ±6 ans, 64 % d’hommes) athlètes olympiques un bilan cardiovasculaire(clinique, ECG de repos et d’effort, échocardiogramme ± bilan complémentaire ciblé) a révélé chez 92 (3,9 %) d’entre eux des anomalies cardiovasculaires, dont des maladies valvulaires et congénitales (n=45), une hypertension artérielle (n=10), une cardiomyopathie hypertrophique (n=4), une maladie coronaire (n=1) et sur le plan rythmique des tachyarythmies ventriculaires complexes (n=8), fibrillations atriales (n=2), QT long (n=2) et WPW (n=1) (22). Le même bilan cardiovasculaire réalisé chez 267 sportifs paralympiques (35 ± 9 ans, 76 % d’hommes, 116 LME) a révélé des anomalies cardiovasculaires (Tableau 2)
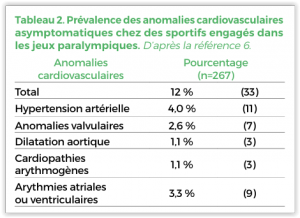
Chez 33 (12 %) sportifs avec un trouble structurel chez 24 (9 %)(25). Ces résultats montrent que quel que soit leur niveau de pratique et de performance les athlètes, quel que soit leur niveau de performance, peuvent présenter des maladies cardiovasculaires silencieuses à risque de complications potentiellement graves lors de leur activité sportive.
Bilan cardiovasculaire de pré participation chez les sportifs avec handicap
• Classification des limitations cardiovasculaires Pour garantir l’intégrité d’une compétition équitable, la classification paralympique officielle est basée sur le type de déficience qui affecte la capacité des athlètes à pratiquer différents sports(26). Chez les sujets avec LME, quel que soit le niveau de la lésion l’adaptabilité de leur fonction cardiovasculaire et autonome à l’effort est plus altérée si celle-ci est complète qu’incomplète. Cette adaptabilité peut être bien évaluée par la différence de réponse de paramètres comme l’élévation de la fréquence cardiaque et/ou de la PAS entre repos et post-stress (redressements et/ou réponse cutanée) sympathique. Pour les sports pratiqués en fauteuil roulant, pour les sujets avec LME la classification devrait tenir compte de la réponse à ces stress qui ne sont pas systématiquement réalisés(6,26).
- Bilan et suivi cardiovasculaire recommandés
Vu la fréquence rapportée des anomalies cardiovasculaires chez les athlètes paralympiques un bilan et d’un suivi médical paraît justifié(6,25). Un consensus d’expert vient de préciser le calendrier et le contenu des différents bilans organiques à réaliser en fonction du handicap (intellectuel, musculosquelettique, neurologique, sensoriel) du sportif concerné(27).
Pour le bilan cardiovasculaire en l’absence de guidelines spécifiques, l’application de celles proposées pour les sujets valides paraissent raisonnables d’autant plus que les adaptations rapportées sont similaires dans les deux populations. L’analyse de l’ECG devrait en particulier être plus fréquente(6). Pour les sujets ambulatoires sans LME le choix en fonction du handicap du test l’effort le mieux adapté pour les explorations cardiorespiratoires reste discuté. Pour les patients avec une LME, surtout haut située et/ou complète, un test fonctionnel du système nerveux autonome et l’évaluation des risques d’intolérance au froid et/ou au chaud méritent d’être ajoutés(6,26,27).
Références
1. Hodgkiss DD, Williams AMM, Shackleton C S, et al. Ergogenic effects of spinal cord stimulation on exercise performance following spinal cord injury. Front Neurosci. 2024; 18: doi.10.3389/fnins.2024.1435716.
2. Webborn N, Van de Vliet P. Paralympic medicine. Lancet. 2012; 380:65-71.
3. Theisen D. Cardiovascular determinants of exercise capacity in the paralympic athlete with spinal cord injury. Exp Physiol 2012; 97.3 : 319–324.
4. Myers J, Lee M, Kiratli J. Cardiovascular disease in spinal cord injury: an overview of prevalence, risk, evaluation, and management. Am J Phys Med Rehabil. 2007; 86: 142-52.
5. Itodo OA, Flueck JL, Raguindin PF et al. Physical activity and cardiometabolic risk factors in individuals with spinal cord injury: a systematic review and meta-analysis. Eur J Epidemiol 2022; 37:335–365.
6. Sawczuk D, Gac P, Poreba, R et al. The Prevalence of Cardiovascular Diseases in Paralympic Athletes. Healthcare 2023; 11 : doi.org/10.3390/ healthcare11071027.
7. Nash MS, Bilzon JLJ. Guideline approaches for cardioendocrine disease surveillance and treatment following spinal cord injury. Curr Phys Med Rehab Reports. 2018; 6: 264-276.
8. DeVivo MJ, Chen Y, Wen H. Cause of death trends among persons with spinal cord injury in the United States: 1960-2017. Arch Phys Med Rehab. 2022; 103:634-41.
9. Buzzell A, Chamberlain JD, Eriks-Hoogland I, et al. All-cause and causespecific mortality following non-traumatic spinal cord injury: evidence from a population-based cohort study in Switzerland. Spinal Cord. 2020 ; 58: 157–64.
10. Raguindin PF, Itodo OA, Eriks-Hoogland I, et al. Does cardiometabolic risk profile differ among individuals with traumatic and non-traumatic spinal cord injury (SCI): the evidence from the multicenter SCI cohort in Switzerland (SwiSCI). Spinal Cord. 2024; 62: 387-395.
11. Lagu T, Schroth SL, Haywood C, et al. Diagnosis and management of cardiovascular risk in individuals with spinal cord injury: A narrative review. Circulation. 2023; 148: 268–277.
12. Barton TJ, Low DA, Bakker EA, et al. Traditional Cardiovascular Risk Factors Strongly Underestimate the 5-Year Occurrence of Cardiovascular Morbidity and Mortality in Spinal Cord Injured Individuals. Arch Phys Med Rehabil. 2021; 102 :27-34.
13. Martin Ginis KA, van der Scheer JW, Latimer-Cheung AE, et al. Evidencebased scientific exercise guidelines for adults with spinal cord injury: an update and a new guideline. Spinal Cord. 2018;56 : 308–321.
14. Hodgkiss DD, Bhangu GS, Lunny C, et al. Exercise and aerobic capacity in individuals with spinal cord injury: A systematic review with metaanalysis and meta-regression. PLoS Med 2023; 20:doi.org/10.1371/journal. pmed.1004082.
15. Farkas G; Caldera L; Nash M. Assessing the efficacy of duration and intensity prescription for physical activity in mitigating cardiometabolic risk after spinal cord injury. Current Opinion in Neurology 2023; 36: 531-540.
16. Nevin J, Kouwijzer I, Stone B, et al. The Science of Handcycling: A Narrative Review. Int J Sports Physiol Perform. 2022; 17: 335-342.
17. Baumgart JK, Brurok B, Sandbakk Ø. Peak oxygen uptake in Paralympic sitting sports: A systematic literature review, meta- and pooled-data analysis. PLoS One. 2018; 13: doi: 10.1371/journal.pone.0192903.
18. Pelliccia A, Quattrini FM , Cavarretta E, et al. Physiologic and clinical features of the paralympic athlete’s heart. JAMA Cardiol. 2021; 6 :30-39.
19. Oliveira JA, Salvetti XM, Lira EB, et al. Athlete’s heart, oxygen uptake and morphologic findings in paralympic athletes. Int J Cardiol. 2007; 121: 100-1.
20. Oliveira Filho JA, Barros MBM, Salles AF, et al. Athlete’s heart in a Brazilian paralympic judo team. Case series study. Sao Paulo Med J. 2018; 136: 136-139.
21. Sharma S, Drezner JA, Baggish A, et al. International recommendations for electrocardiographic interpretation in athletes. Eur Heart J. 2018; 39:1466-1480.
22. D’Ascenzi F, Caselli S, Alvino F, et al. Cardiovascular risk profile in Olympic athletes: an unexpected and underestimated risk scenario Br J Sports Med 2019;53:37–42.
23. Gioia GD, Coletti F, Buzzelli L et al. Influence of the type of disability and sporting discipline on lipid profile in a cohort of italian paralympic athletes. Am J Cardiol. 2024; 210:107-112.
24. Di Gioia G, Vespasiano F, Mango F, et al. Cardiovascular risk profile in master paralympic athletes, a high-risk undertreated population: a cross-sectional longitudinal study High Blood Press Cardiovasc Prev. 2024; 31: 279-288.
25. Pelliccia, A, Quattrini, FM, Squeo MR et al. Cardiovascular diseases in Paralympic athletes. Br. J. Sports Med. 2016, 50, 1075–1080.
26. West CR, Krassioukov AV. Autonomic cardiovascular control and sports classification in Paralympic athletes with spinal cord injury. Disabil Rehabil. 2017;39:127-134.
27. Pinheiro L, Verhagen E, Ocarino J, et al. Periodic health evaluation in Para athletes: a position statement based on expert consensus. BMJ Open Sport & Exercise Medicine.
28. 2024; doi:10.1136/bmjsem-2024-001946.
