
Le point du vue du cardiologue
L’année 2015 aura été marquée par des études importantes dans le domaine de l’HTA et notamment par les résultats de SPRINT.(1) Dans cette étude, 9 361 patients avec PAS ≥ 130 mmHg, à haut risque cardiovasculaire mais non diabétiques, ont été randomisés pour un traitement anti-HTA intensif (PAS < 120 mmHg) ou un traitement standard (PAS < 140 mmHg). A un an, les pressions artérielles étaient respectivement (moyennes) à 121,4 et 136,2 mmHg.
L’essai a dû être arrêté prématurément après un suivi médian de 3,26 ans parce que le critère principal d’évaluation (syndrome coronaire aigu, AVC, ICC ou décès de cause CV) était déjà significativement moins fréquent avec le traitement intensif (- 25% ; p < 0,001). Il y avait aussi une réduction de 27% ; p = 0,003) de la mortalité toutes causes. Le prix à payer était un excès d’événements indésirables (hypotension, syncope, troubles électrolytiques, dysfonctions rénales) mais sans excès de chutes traumatiques. Ces données remarquables vont dans le même sens que celles de ACCORD HTA dans laquelle le seuil de significativité statistique n’avait, cependant, pas été atteint.
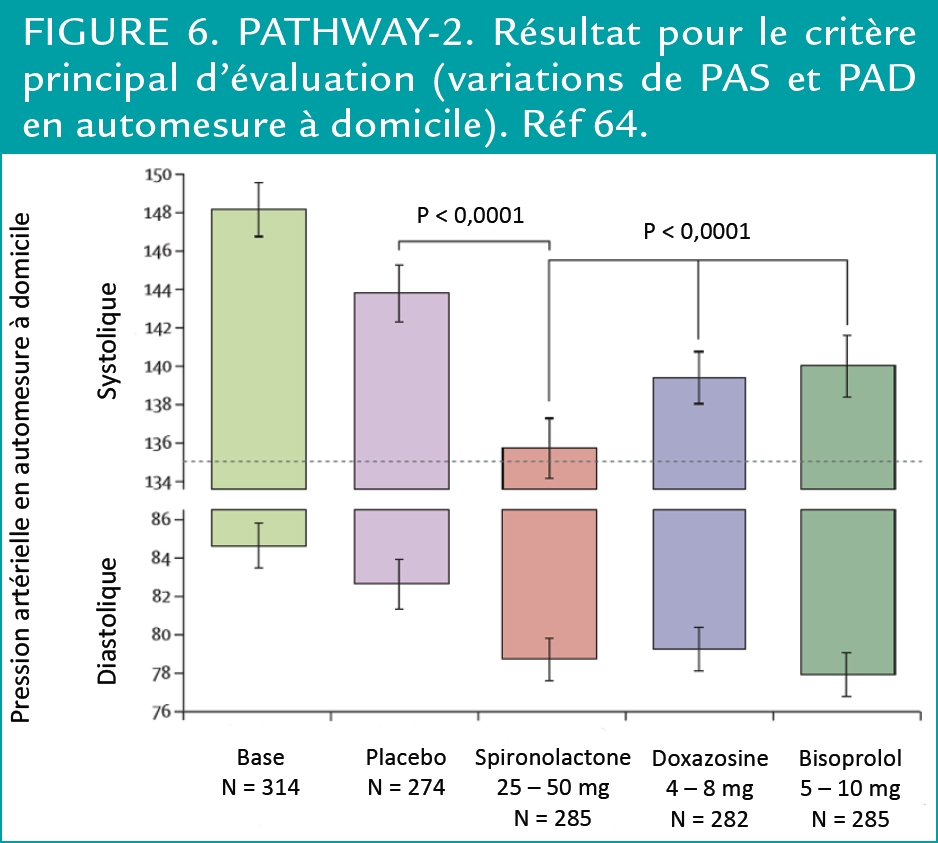
Dans PATHWAY-2, chez des patients avec HTA résistante (PAS ≥ 140 mmHg mais ≥ 135 mmHg pour les diabétiques, malgré 3 anti-HTA à dose maxi tolérée), la spironolactone (25–50 mg) a été comparée, a du bisoprolol (5–10 mg), de la doxazosine (4–8 mg) et à un placebo.(2)
Le critère principal d’évaluation était la différence en automesure de la PAS sous spironolactone vs sous placebo (et, en cas de significativité, versus les 2 autres antihypertenseurs). La spironolactone s’est avérée le traitement le plus efficace pour contrôler ces HTA résistantes avec une différence de 8,70 mmHg (p < 0,0001) contre 4,26 (p < 0,0001) pour les 2 autres réunis (Figure 6). Tous les traitements ont été dans l’ensemble bien tolérés et seuls 6 des 285 patients sous spironolactone ont eu une fois une hyperkaliémie > 6 mmol/L.
L’objectif de PATHWAY-3 était de vérifier l’effet de l’addition (ou de la substitution) à un thiazidique d’un diurétique épargnant de potassium sur l’équilibre glycémique et son efficacité anti-HTA.(3) Les patients, non diabétiques, avaient une PAS > 140 mmHg (et > 130 mmHg en automesure) sous traitement (hormis diurétique) et au moins une autre composante du syndrome métabolique. Ils étaient randomisés pour recevoir pour 24 semaines : amiloride 10 mg, HCTZ 25 mg ou amiloride 5 mg + HCTZ 12,5 mg, toutes doses doublées à mi-parcours si nécessaire. En moyenne les glycémies post-charge ont été, vs HCTZ, significativement moindre avec l’amiloride seul (-0,55 mmol/L ; p = 0,0093) ou en association (-0,42 mmol/L ; p = 0,048).
La pression artérielle n’a pas été significativement différente à 24 semaines entre les groupes amiloride et HCTZ mais la baisse a été plus importante avec l’association.
Sachant la fréquence de l’IDM chez les diabétiques les résultats de l’étude PEGASUS ne sont pas sans intérêt puisqu’ils montrent qu’après IDM, la prolongation du double traitement antiagrégant (ticagrelor + aspirine) au-delà de la première année réduit significativement les risques de décès cardiovasculaire, d’IDM, d’AVC mais au prix d’une augmentation du risque de saignements majeurs.(4)
Un suivi prolongé a été possible chez la moitié des patients de l’étude COURAGE qui avait montré que, dans l’angor stable, un traitement médical bien conduit fait jeu égal avec la revascularisation. Avec un suivi médian de désormais 11,9 ans, il y a eu autant de décès avec ou sans angioplastie (25% vs 24%).(5) La question de l’évolution des modalités de l’angioplastie depuis 2004 est posée mais ces résultats restent tout de même un plaidoyer pour un traitement médical rigoureux.
Dans l’étude ELIXA, plus de 6 000 diabétiques ont reçu, par randomisation, dans les suites d’un IDM ou d’un angor instable du lixisenatide (agoniste du GLP1, 20 μg/j SC après titration) ou un placebo en plus des traitements habituels.(6) Avec un recul de 25 mois, la non-infériorité du lixisenatide a été démontrée, pour réduire le risque d’événements majeurs par rapport au placebo mais pas sa supériorité, sans induire d’effets indésirables majeurs.
Enfin, la publication des résultats de l’étude EMPA-REG(7) et la mise sur le marché (sous ATU) de l’association sacubitril/valsartan dont il est question dans d’autres présentations de ce congrès, sont deux avancées pharmacologiques majeures de 2015 dans le domaine de l’insuffisance cardiaque dont sait la prévalence chez les diabétiques.(8)
Michel Komajda, Paris
RÉFÉRENCES
1. Group SR, Wright JT, Jr., Williamson JD, et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med 2015;373:2103-16.
2. Williams B, MacDonald TM, Morant S, et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet 2015;386:2059-68.
3. Brown MJ, Williams B, Morant SV, et al. Effect of amiloride, or amiloride plus hydrochlorothiazide, versus hydrochlorothiazide on glucose tolerance and blood pressure (PATHWAY-3): a parallelgroup, double-blind randomised phase 4 trial. Lancet Diabetes Endocrinol 2016;4:136-47.
4. Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791-800.
5. Sedlis SP, Hartigan PM, Teo KK, et al. Effect of PCI on Long-Term Survival in Patients with Stable Ischemic Heart Disease. N Engl J Med 2015;373:1937-46.
6. Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015;373:2247-57.
7. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28.
8. Claggett B, Packer M, McMurray JJ, et al. Estimating the Long-Term Treatment Benefits of Sacubitril-
Valsartan. N Engl J Med 2015;373:2289-90.
Le point de vue du diabétologue
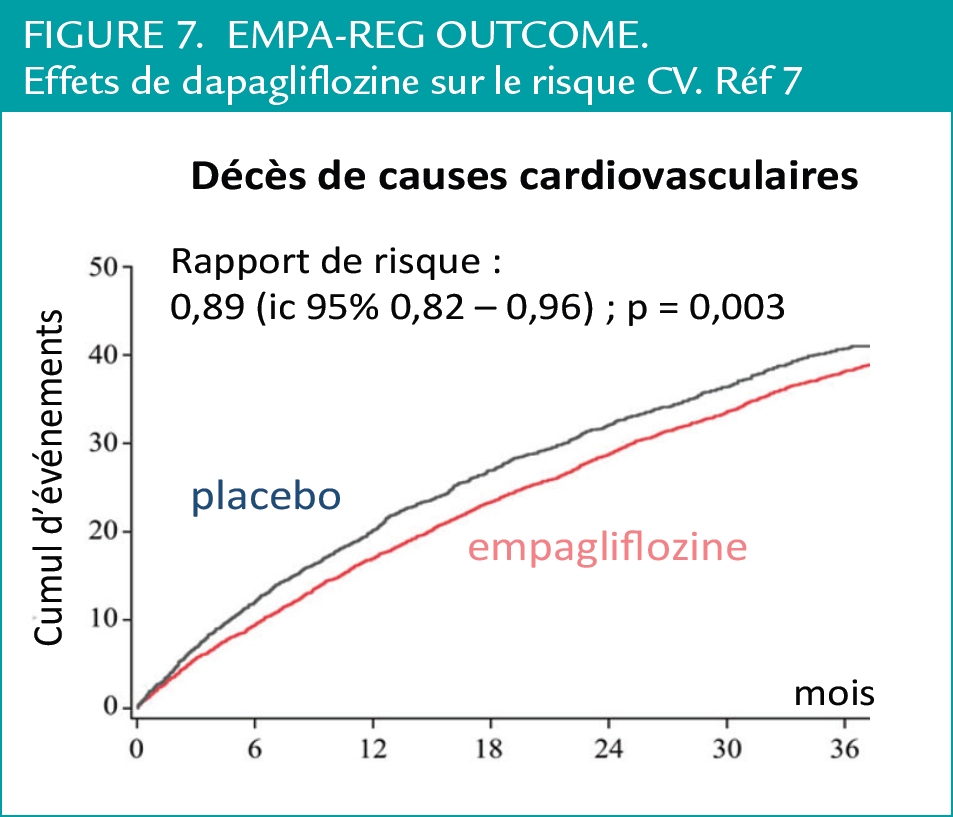
Deux publications de 2015, devraient mettre fin à la polémique sur le risque de cancer de vessie sous pioglitazone. Dans le registre KPNC le rapport de risque pour les patients traités avec cet anti-diabétique (18% des 193 000 avec cancer de vessie) y a été estimé à 1,06 (ic 95% 0,89-1,26 ; ns).(1) Ces résultats vont dans le même sens que ceux d’une compilation de 6 grandes cohortes internationales (> 1 million de diabétiques avec un suivi de 5,9 millions patients-années). Le suivi à long terme (médiane 9,8 ans) des patients de l’étude VADT a montré, que la réduction non significative du risque d’événements CV (critère principal) observée avec le traitement intensif au terme de l’étude principale est devenue significative : rapport de risque 0,83 (ic à 95% entre 0,70 to 0,99 ; p = 0,04), alors que la réduction d’HbA1c observée avec l’étude principale (médiane 6,9% vs 8,4%) s’est estompée à l’arrêt de la randomisation -0,2 à -0,3 points/ an dans les 3 ans qui ont suivi. (Figure 7)(2) Par contre, il n’a pas été observé de réduction de mortalité (cardiovasculaire ou totale). Ces nouvelles données ne permettent pas de conclure qu’atteindre un niveau d’HbA1c <7,5% peut prévenir les complications CV du diabète, peut-être en raison de la disparité des études et des objectifs d’HbA1c. Il semble malgré tout assez évident qu’il faut essayer de maintenir l’HbA1c < 8% pour ≥ 5 ans pour prévenir ces complications CV. Chaque fois que c’est possible, l’objectif de 7% reste de mise en raison de son efficacité démontrée pour réduire les complications microvasculaires.
Une nouvelle étape a été franchie dans l’évaluation de la sécurité CV des inhibiteurs de DPP-4 avec les résultats de TECOS (sitagliptine).(3) Son critère principal d’évaluation (sécurité) était la survenue d’un événement parmi décès CV, IDM ou AVC non mortel, hospitalisation pour angor instable). Dans cet essai randomisé contre placebo (près de 15 000 DT2), avec un suivi médian de 3 ans, la sitagliptine n’a pas été inférieure au placebo sur ce critère principal (Rapport de Risque 0,98 avec ic à 95% entre 0,88 et 1,09 ; p < 0,001). De plus il n’y a pas eu d’excès d’hospitalisations pour ICC (1,00 [ 0,83 – 1,20 ; p = 0,98)], un signal particulièrement attendu depuis SAVOR.
Les résultats de l’étude EMPA REG(4), déjà décrits ont donc montré le bénéfice de l’empagliflozine pour réduire les risque d’IDM et d’AVC avec une diminution significative de la mortalité CV et du risque d’hospitalisation pour ICC (Figure 7).
En conclusion, les essais cliniques publiés en 2015 ont apporté une contribution majeure à la pratique clinique dans des domaines qui intéressent autant la cardiologie que la diabétologie.
Bernard Charbonnel, Nantes
RÉFÉRENCES
1. Lewis JD, Habel LA, Quesenberry CP, et al. Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes. JAMA 2015;314:265-77.
2. Hayward RA, Reaven PD, Wiitala WL, et al. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;372:2197-206.
3. Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015;373:232-42.
4. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28.
Article publié dans le supplément du Cordiam N°12 (Juin 2016)
