L’ablation de la fibrillation atriale (FA) est une technique qui a déjà presque 20 ans mais qui n’a pas fini de susciter le débat. Si la méthode d’ablation « standard », basée sur l’isolation des veines pulmonaires, est efficace dans les formes paroxystiques, elle l’est beaucoup moins dans les formes persistantes. Nous avons décrit récemment 1 une nouvelle méthode d’ablation entièrement « sur mesure » permettant de traiter efficacement et de façon non extensive tous les types de FA et notamment les formes persistantes.
Depuis la publication princeps du groupe de Bordeaux dans le NEJM en 1998 2 nous savons que les extrasystoles initiatrices de FA paroxystique se situent le plus souvent dans la région des veines pulmonaires. Pour cette raison une isolation électrique de la veine « coupable » a d’abord été proposée. L’isolation probabiliste des 4 veines pulmonaires est ensuite devenue la « pierre angulaire » de l’ablation de la FA paroxystique. Une isolation « large » permettant d’y ajouter une ablation de « substrat fibrillatoire » atrial périveineux (par radiofréquence ou cryothérapie) est devenue la technique standard pour l’ablation de la FA paroxystique. Les résultats de cette technique dans la FA paroxystique sont satisfaisants dans environ 60 à 80% des cas selon les études 3,4.
Par extension, cette approche probabiliste d’isolation des veines pulmonaires par encerclement large est également largement appliquée dans l’ablation de la FA persistante mais avec des résultats beaucoup plus mitigés (environ 50% de succès même après plusieurs séances) 5.
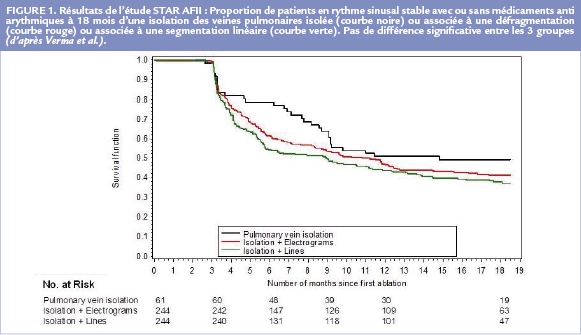
Pour cette raison, d’autres protocoles probabilistes (« lignes ») ou non probabilistes (« défragmentation ») ont été proposés. Malheureusement ces approches associées à l’isolation des veines pulmonaires n’ont pas apporté la preuve d’une amélioration des résultats à long terme comme l’a notamment démontré l’étude STAR AFII 5 publiée en 2015 (Figure 1).
Pour ces raisons, une grande partie de la communauté cardio/rythmologique considère aujourd’hui logiquement que l’ablation de la FA est peu efficace dans les formes persistantes et qu’elle ne doit être réservée qu’aux formes paroxystiques sur cœur sain.
De nombreuses équipes travaillent depuis des années à améliorer la compréhension de cette maladie afin d’améliorer son traitement et d’apporter à chaque patient une solution thérapeutique individualisée. L’enjeu crucial est de pouvoir traiter plus efficacement des patients plus sévères chez qui la FA a des conséquences graves (FA persistante dans l’insuffisance cardiaque par exemple).
L’ablation de la FA guidée par les signaux intracardiaques
En 2004, Nademanee publiait dans le JACC une méthode d’ablation basée sur l’analyse des signaux électriques intracardiaques appelée « Défragmentation » 6.
Dans cet article il décrivait le concept de « fragmentation » (potentiels électriques complexes avec plusieurs déflections) et démontrait que l’ablation de régions atriales présentant ces potentiels fragmentés permettait d’ablater tout type de FA avec des résultats particulièrement bons à l’époque. Malheureusement si certains auteurs ont confirmé l’efficacité de la défragmentation 7–9 d’autres au contraire ne reproduisaient pas ces résultats 10,11.
L’étude randomisée STAR AFII 5 ne démontrait aucun bénéfice de cette approche en raison de sa difficile reproductibilité (Figure 1). Récemment Van der Does et al. 12 ont analysé 348 articles dans le but d’identifier de nouvelles définitions plus précises de la fragmentation. Il apparaît qu’il n’existe pas de définition ou de méthode d’enregistrement uniforme de la fragmentation atriale. L’identification de signaux fragmentés pathologiques apparaît donc très complexe et la première étape afin de rendre la détection des électrogrammes fragmentés pathologiques plus objective serait, selon eux, de relier la morphologie des électrogrammes à leur séquence d’activation spatio-temporelle.
Activation régionale rotatoire
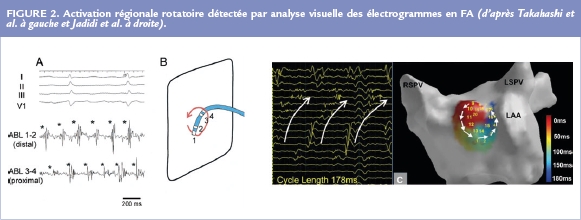
Plusieurs auteurs ont déjà démontré que des électrogrammes voisins dans les oreillettes et ayant une activation régionale non simultanée pouvaient correspondre à des sources rotatoires 13–15 (Figure 2). L’ablation de régions qui présentaient ce type de signaux pouvait permettre d’améliorer les résultats de l’isolation des veines pulmonaires. Récemment de nouveaux outils ont permis de visualiser ces sources rotatoires, de progresser dans la compréhension de la maladie 16,17 et d’orienter l’ablation de la FA vers une approche individualisée.
Le concept de Dispersion Spatio-temporelle
L’analyse visuelle des signaux intracardiaques est la base de l’électrophysiologie cardiaque et de l’ablation de presque tous les troubles du rythme. Jusqu’à présent seule la FA faisait exception à ce paradigme. Les protocoles d’ablation classiques consistent à réaliser des lésions empiriques dans des régions de l’oreillette gauche souvent impliquées (statistiquement) dans la physiopathologie de la FA mais sans avoir détecté au préalable ces « sources fibrillatoires ». La conséquence peut être un traitement incomplet ou excessif.
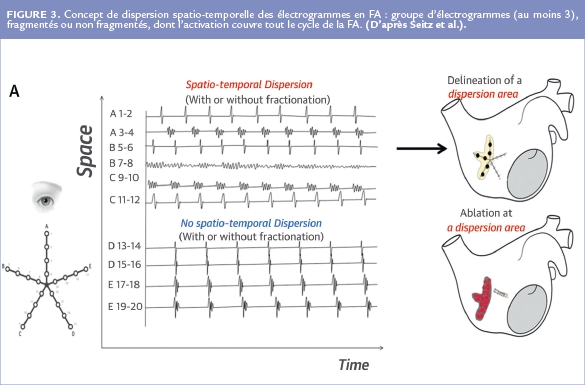
Dans notre étude 1, nous avons unifié les concepts de fragmentation et d’activation régionale rotatoire en un seul concept que nous avons appelé la « Dispersion Spatio-temporelle ». Sa définition est simple : groupe d’électrogrammes (au moins 3), fragmentés ou non fragmentés, dont l’activation couvre tout le cycle de la FA (Figure 3).
Nous avons confirmé par des expérimentations animales (cartographie optique) et des simulations mathématiques la solidité de ce concept de dispersion spatio-temporelle comme authentique signature électrique des sources de la FA. De plus nous avons observé qu’au niveau des sources de la FA, la grande majorité des électrogrammes étaient fragmentés, ce qui explique l’efficacité de la défragmentation par certaines équipes. Mais nous avons également observé, comme l’équipe de Bordeaux 15, que la fragmentation était un critère peu spécifique (retrouvé également dans des zones saines « passives »). La fragmentation étant très dépendante de la fréquence locale, le degré de fragmentation est donc variable d’un patient à un autre et également chez un même patient à plusieurs moments d’une même procédure (quand l’ablation ralentit la fréquence de la FA par exemple).
Ceci explique en grande partie la faible reproductibilité de la défragmentation comme technique d’ablation basée uniquement sur l’analyse morphologique du signal sans tenir compte de l’activation régionale.
Résultats de l’étude Substrat HD 1
Une meilleure effi cacité avec des procédures plus courtes et moins extensives qu’avec la méthode classique Dans cette étude, nous avons testé l’hypothèse que l’ablation des zones de dispersion dans les deux oreillettes permettait de traiter tout type de FA.
La méthode d’ablation utilisée est basée avant tout sur une cartographie très précise des deux oreillettes.
Ce temps de cartographie est absolument fondamental et ne doit pas être bâclé. Une concentration maximale est nécessaire avec une acquisition d’un maximum de points afin de préciser les limites des zones de dispersion qui sont différentes chez tous les patients (Figure 4).
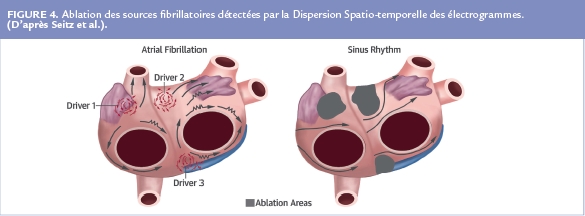
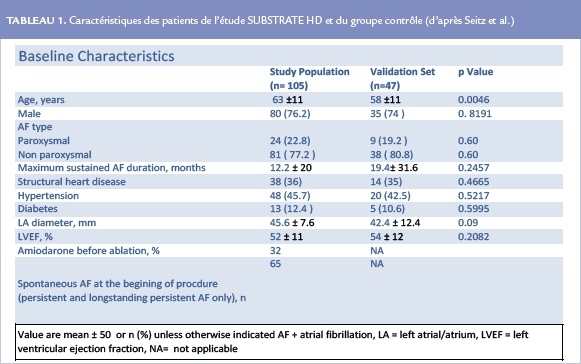
L’ablation de ces zones de dispersion a été réalisée chez 105 patients (77% de FA persistantes et persistantes de longues durée, 36% de cardiopathies et 1 an de durée moyenne de FA soutenue) et comparée à un groupe contrôle de 47 patients traités par la technique classique de référence (isolation des veines pulmonaires ± lignes ± défragmentation) (Tableau 1).
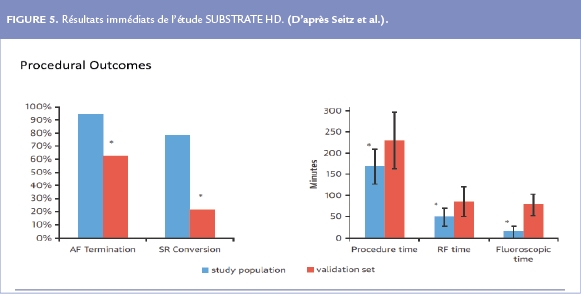
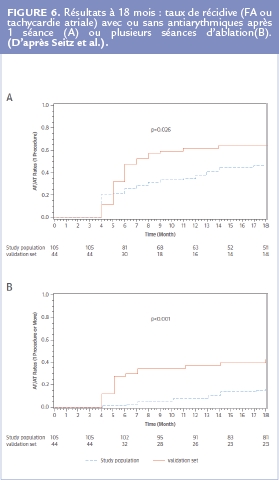
Les résultats immédiats démontrent que l’ablation des zones de dispersion permet l’arrêt de la FA dans 95% des cas avec des procédures et des temps de radiofréquence plus courts (Figure 5). A 18 mois nos résultats montraient de meilleurs résultats après une procédure (55% vs 36% de patients en rythme sinusal stable, p=0.026) mais surtout après 1,4 procédure/ patient (85% versus 59%, p<0.001) (Figure 6).
Cette différence importante après plusieurs procédures s’expliquait par le fait que la majorité de nos récidives après une procédure correspondait à des tachycardies atriales bien organisées (à l’inverse du groupe contrôle qui avait une majorité de récidives en FA). En effet la plupart des récidives après une procédure correspondaient à des tachycardies atriales bien organisées (ou « flutters atypiques » ou encore « tachysystolies ») bien plus faciles à ablater que la FA (procédures beaucoup plus courtes).
De façon très intéressante, les 3 types de FA (paroxystique, persistante et persistante de longue durée) présentaient les mêmes résultats à 18 mois : respectivement 83%, 84% et 87% de patients en rythme sinusal stable après 1.4±0.5 procédures/patient.
A noter qu’une équipe allemande complètement indépendante a publié quasiment simultanément des résultats très proches confirmant encore la validité du concept et l’efficacité de la méthode d’ablation (Figure 2, 15).
Une approche sur mesure et « non extensive »
L’efficacité de cette nouvelle technique dans les formes complexes de FA (FA persistantes) s’explique par le caractère individualisé de l’approche. En effet chaque patient étant différent, la localisation et la surface des « sources fibrillatoires » dans les 2 oreillettes est très variable d’un patient à un autre.
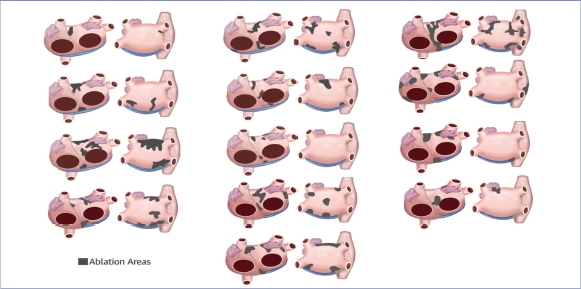
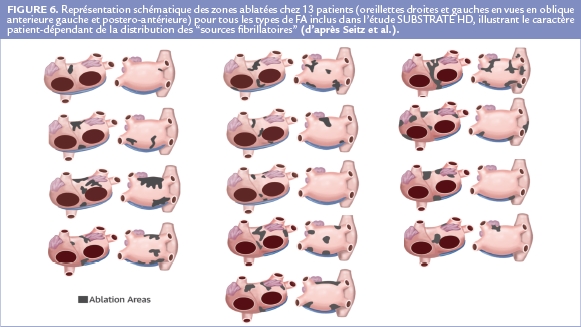
Ainsi par exemple : dans la population étudiée, la surface des « sources fibrillatoires » était de 18±10 cm² dans les FA paroxystiques contre 41±12 cm² dans les FA persistantes de longue durée (p<0.0001). La Figure 6 représente les diverses localisations des « sources fibrillatoires » ablatées chez 13 patients avec tous les types de FA. Cette figure est une bonne illustration de la variabilité de la localisation et de l’étendue des « sources fibrillatoires » expliquant la nécessité d’une approche « sur mesure ». Par ailleurs, les durées de procédure et de radiofréquence du groupe « ablation sur mesure » étaient inférieures à celles du groupe contrôle « ablation standard » (Figure 5).
De plus, avec cette nouvelle méthode, la surface ablatée représentait seulement 17±10 % de la surface de l’oreillette gauche et 10± 5% de la surface biatriale. Cette approche « sur mesure » permettrait donc une ablation « non extensive ».
Conclusion
La dispersion spatio-temporelle correspond à la signature électrique des sources de la FA. L’ablation de ces « sources fibrillatoires » permet de réaliser un protocole d’ablation entièrement “sur-mesure”. Cette méthode d’ablation est efficace pour tous les types de FA, y compris les formes persistantes et persistantes de longue durée classiquement plus difficiles à ablater et qui peuvent cependant souvent tirer un bénéfice important de l’ablation, notamment chez les patients insuffisants cardiaques. Plusieurs procédures peuvent être nécessaires et une récidive sous forme organisée (tachycardie atriale) apparaît être un facteur pronostique favorable, comparé à la récidive sous la forme de fibrillation.
Julien Seitz, Edouard Gitenay, Clément Bars, Sylvain Beurtheret, Michel Bremondy, Ange Ferracci, André Pisapia. Hôpital Saint Joseph, Marseille.
RÉFÉRENCES
1. J. Seitz, C. Bars, G. Théodore, S. Beurtheret, N. Lellouche, M. Bremondy, et al., AF Ablation Guided by Spatiotemporal Electrogram Dispersion Without Pulmonary Vein Isolation: A Wholly Patient-Tailored Approach, J. Am. Coll. Cardiol. 69 (2017) 303–321. doi:10.1016/j.jacc.2016.10.065.
2. M. Haïssaguerre, P. Jaïs, D.C. Shah, A. Takahashi, M. Hocini, G. Quiniou, et al., Spontan eous initiation of atrial fi brillation by ectopic beats originating in the pulmonary veins, N. Engl. J. Med. 339 (1998) 659–666. doi:10.1056/NEJM199809033391003.
3. K.-H. Kuck, J. Brugada, A. Fürnkranz, A. Metzner, F. Ouyang, K.R.J. Chun, et al., Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation, N. Engl. J. Med. 374 (2016) 2235–2245. doi:10.1056/NEJMoa1602014.
4. R. Providencia, P. Defaye, P.D. Lambiase, D. Pavin, J.-P. Cebron, F. Halimi, et al., Results from a multicentre comparison of cryoballoon vs. radiofrequency ablation for paroxysmal atrial fi brillation: is cryoablation more reproducible?, Eur. Eur. Pacing Arrhythm. Card. Electrophysiol. J. Work. Groups Card. Pacing Arrhythm. Card. Cell. Electrophysiol. Eur. Soc. Cardiol. 19 (2017) 48–57. doi:10.1093/ europace/euw080.
5. A. Verma, C. Jiang, T.R. Betts, J. Chen, I. Deisenhofer, R. Mantovan, et al., Approaches to catheter ablation for persistent atrial fi brillation, N. Engl. J. Med. 372 (2015) 1812–1822. doi:10.1056/ NEJMoa1408288.
6. K. Nademanee, J. McKenzie, E. Kosar, M. Schwab, B. Sunsaneewitayakul, T. Vasavakul, et al., A new approach for catheter ablation of atrial fi brillation: mapping of the electrophysiologic substrate, J. Am. Coll. Cardiol. 43 (2004) 2044–2053. doi:10.1016/j.jacc.2003.12.054.
7. J. Seitz, J. Horvilleur, L. Curel, J. Lacotte, A. Maluski, A. Ferracci, et al., Active or Passive Pulmonary Vein in Atrial Fibrillation: Is Pulmonary Vein Isolation always essential?, Heart Rhythm Off. J. Heart Rhythm Soc. (2014). doi:10.1016/j.hrthm.2014.01.009.
8. Y. Iriki, S. Ishida, N. Oketani, H. Ichiki, H. Okui, Y. Ninomiya, et al., Relationship between clinical outcomes and unintentional pulmonary vein isolation during substrate ablation of atrial fi brillation guided solely by complex fractionated atrial electrogram mapping, J. Cardiol. 58 (2011) 278–286. doi:10.1016/j.jjcc.2011.07.006.
9. J. Seitz, C. Bars, A. Ferracci, A. Maluski, G. Penaranda, G. Theodore, et al., Electrogram Fractionation-Guided Ablation in the Left Atrium Decreases the Frequency of Activation in the Pulmonary Veins and Leads to Atrial Fibrillation Termination, JACC Clin. Electrophysiol. (2016). doi:10.1016/j.jacep.2016.04.003.
10. H. Oral, A. Chugh, E. Good, A. Wimmer, S. Dey, N. Gadeela, et al., Radiofrequency catheter ablation of chronic atrial fi brillation guided by complex electrograms, Circulation. 115 (2007) 2606–2612. doi:10.1161/CIRCULATIONAHA.107.691386.
11. K.C.K. Wong, J.R. Paisey, M. Sopher, R. Balasubramaniam, M. Jones, N. Qureshi, et al., No Benefi t OF Complex Fractionated Atrial Electrogram (CFAE) Ablation in Addition to Circumferential Pulmonary Vein Ablation and Linear Ablation: BOCA Study, Circ. Arrhythm. Electrophysiol. (2015) CIRCEP.114.002504. doi:10.1161/CIRCEP.114.002504.
12. L.J.M.E. van der Does, N.M.S. de Groot, Inhomogeneity and complexity in defi ning fractionated electrograms, Heart Rhythm. 14 (2017) 616 624. doi:10.1016/j.hrthm.2017.01.021.
13. Y. Takahashi, M.D. O’Neill, M. Hocini, R. Dubois, S. Matsuo, S. Knecht, et al., Characterization of electrograms associated with termination of chronic atrial fi brillation by catheter ablation, J. Am. Coll. Cardiol. 51 (2008) 1003–1010. doi:10.1016/j.jacc.2007.10.056.
14. B. Ghoraani, R. Dalvi, S. Gizurarson, M. Das, A. Ha, A. Suszko, et al., Localized rotational activation in the left atrium during human atrial fi brillation: relationship to complex fractionated atrial electrograms and low-voltage zones, Heart Rhythm Off. J. Heart Rhythm Soc. 10 (2013) 1830–1838. doi:10.1016/j.hrthm.2013.09.007.
15. A.S. Jadidi, H. Lehrmann, C. Keyl, J. Sorrel, V. Markstein, J. Minners, et al., Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics, Circ. Arrhythm. Electrophysiol. 9 (2016) e002962. doi:10.1161/CIRCEP.115.002962.
16. M. Haissaguerre, M. Hocini, A. Denis, A.J. Shah, Y. Komatsu, S. Yamashita, et al., Driver domains in persistent atrial fi brillation, Circulation. 130 (2014) 530–538. doi:10.1161/ CIRCULATIONAHA.113.005421.
17. S.M. Narayan, D.E. Krummen, K. Shivkumar, P. Clopton, W.-J. Rappel, J.M. Miller, Treatment of atrial fi brillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial, J. Am. Coll. Cardiol. 60 (2012) 628–636. doi:10.1016/j.jacc.2012.05.022.
