Depuis une vingtaine d’année, l’étude du tissu adipeux épicardique (TAE) suscite de plus en plus d’intérêt. Sa position anatomique entourant le cœur, ses propriétés métaboliques particulières et enfin sa spécificité interviennent dans la physiopathologie des complications cardiométaboliques et endocriniennes. Cet article met en lumière les différentes études fondamentales et les applications cliniques de la mesure du TAE.
Anatomie
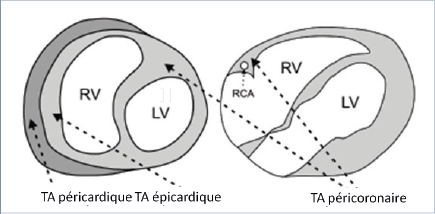
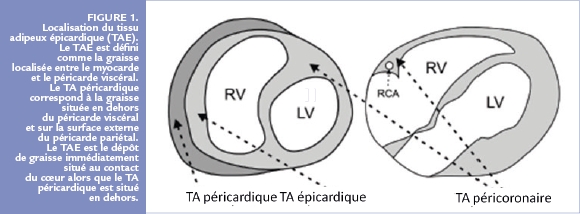
Le tissu adipeux épicardique correspond au dépôt de graisse situé entre le myocarde et le feuillet viscéral du péricarde 1. Il est présent chez l’être humain mais aussi chez d’autres mammifères et par contre très faiblement présent voire absent chez le rat ou la souris. Il provient du mésoderme splanchnopleurique et est vascularisé par des branches des artères coronaires. Il est important de le distinguer du tissu adipeux péricardique qui est situé en dehors du feuillet viscéral du péricarde, sur la face externe du feuillet pariétal du péricarde car ces deux dépôts graisseux sont différents d’un point de vue embryologique, anatomique et fonctionnel.
Le TAE est retrouvé aussi dans le cœur et plus particulièrement au niveau des sillons atrioventriculaire et interventriculaire, autour des artères coronaires au niveau de l’adventice et parfois à l’intérieur du myocarde. Cette continuité avec l’adventice et l’absence de séparation avec le reste du cœur suggère le rôle paracrine entre le TAE et le myocarde sous-jacent. Il partage avec la circulation coronaire une micro circulation via les vasa vasorum (Figure 1).
Le tissu adipeux épicardique est composé principalement d’adipocytes, mais aussi d’un stroma vasculaire, de cellules immunes, de ganglions et de nerfs d’interconnections. Son phénotype métabolique est particulier, souvent considéré comme un tissu adipeux blanc en opposition au tissu adipeux brun, mais des études récentes suggèrent le contraire.
Physiologie
En raison de sa proximité avec le myocarde, le TAE a des fonctions physiologiques uniques. Ses différentes actions sont complexes et peuvent être séparées en activité métabolique, activité thermogénique et fonction mécanique 2,3.
Activité métabolique
Le TAE est riche en acides gras saturés et a un contenu en protéines très important avec une plus grande capacité de relargage des acides gras libres par comparaison aux autres tissus adipeux viscéraux. Dans les conditions physiologiques, cette richesse et l’augmentation du métabolisme des acides gras libres sont très importantes d’un point de vue fonctionnel pour le myocarde car il s’agit d’une source d’énergie importante. Les acides gras libres présents dans le réseau coronaire artériel sont aussi partagés avec le TAE.
Activité thermogénique
De façon récente, il a été découvert que le TAE a des fonctions similaires au tissu adipeux brun et qu’il est une source de chaleur pour le myocarde 4. C’est ainsi qu’il pourrait protéger le cœur d’une chute de la température ambiante du corps ou durant des conditions hémodynamiques défavorables telles qu’une ischémie ou une hypoxie.
Fonction mécanique
Le TAE a aussi une fonction mécanique de protection des artères coronaires contre la torsion car sa compressibilité intrinsèque permet l’expansion et le remodelage positif des vaisseaux coronaires.
Physiopathologie
Le TAE est une source de production et de synthèse de nombreuses cytokines bioactives qui peuvent soit protéger soit avoir un effet délétère sur le myocarde et les artères coronaires 5. Le sécrétome (terme utilisé pour décrire l’étude globale de l’ensemble des protéines sécrétées par une cellule, un tissu ou un organisme et qui représente une classe importante de protéines contrôlant une multitude de processus biologiques et physiologiques) du TAE est très important et varié et reflète ses propriétés multiples. D’autre part, le transcriptome du TAE (l’ensemble des ARN issues de la transcription du génome, autrement dit des gènes exprimés) est très différent de celui du tissu adipeux sous cutané. En effet, il possède de nombreux gènes impliqués dans la fonction endothéliale, la coagulation et l’inflammation 6. C’est ainsi que le TAE exprime et sécrète des adipokines pro-inflammatoires et anti-inflammatoires, mais aussi des facteurs vaso-actifs qui peuvent avoir un effet direct sur le myocarde, par voie paracrine ou autocrine.
Les cytokines du TAE peuvent diffuser à travers l’adventice, la média et l’intima dans la lumière des artères coronaires (effet paracrine). Dans le même temps, les adipokines du TAE peuvent être sécrétées directement dans les vasa vasorum (signalisation vasocrine). Les adipokines sont des cytokines spécifiques du tissu adipeux viscéral en particulier l’adiponectine et l’adrénoméduline. Cet équilibre entre cytokines et adipokines anti-inflammatoires peut être facilement altéré. Par exemple, en cas de maladie coronaire, il existe une diminution de l’expression de l’adiponectine dans le TAE 7. Toute la difficulté est de savoir si ces modifications du TAE sont la conséquence d’une maladie coronaire ou sa cause. Ceci reste encore à explorer mais il est probable que le processus est réciproque et bi directionnel.
L’hypothèse que le TAE sécrète directement des adipokines dans le flux sanguin coronaire a été évaluée dans plusieurs études, mais avec des résultats contradictoires 8-10. Ces études confirment que le TAE est un acteur important de l’atteinte coronaire, soit par voie paracrine soit par voie vasocrine relarguant des cytokines bioactives dans le myocarde et dans les artères coronaires adjacentes. D’autres études sont nécessaires pour évaluer la fonction endocrine du TAE.
Pathologies
Effet local
Le TAE a des effets sur la fonction et la structure du coeur. Un accroissement de son volume est associé à une augmentation de la masse ventriculaire gauche et à une géométrie anormale du ventricule droit 11. Chez les individus ayant une obésité morbide l’excès de TAE est associé à une augmentation de la masse ventriculaire gauche 11. Des mécanismes moléculaires et mécaniques ont été suggérés pour expliquer ces effets. L’augmentation du volume du TAE entraînerait une augmentation de la masse des deux ventricules entraînant un accroissement du travail du cœur.
L’infiltration d’adipocytes du TAE dans le myocarde a aussi été suggérée 12. D’autre part, le contenu lipidique myocardique est aussi augmenté en cas d’augmentation du TAE comme cela a été montré en imagerie par résonance magnétique spectroscopie 13. L’augmentation du volume du TAE est aussi associée à une augmentation du volume des oreillettes et une altération du remplissage ventriculaire droit et gauche 14. Cette modification de la géométrie des oreillettes pourrait avoir des conséquences électrophysiologiques. C’est ainsi que le TAE pourrait être associé au développement d’une fi brillation auriculaire. D’autre part, la sécrétion de cytokines pro-inflammatoires telle que le TNF et l’interleukine-6 ainsi que les acides gras libres pourrait être associée aux modifications électromécaniques de l’oreillette 15.
Effets systémiques
Le TAE peut aussi avoir des effets systémiques et contribuer à la progression de la maladie coronaire. En effet, le déséquilibre entre les adipokines cardioprotectives et délétères secrétées par le TAE est associé de façon importante au développement de la maladie coronaire chez l’homme 16.
Le TAE pourrait altérer les artères coronaires par le biais de multiples voies : activation des macrophages, stress oxydant, réponse inflammatoire et déstabilisation de la plaque 6. Les cellules infl ammatoires sécrétées par le TAE entourent l’adventice des artères coronaires, ce qui pourrait stimuler la prolifération des vasa vasorum et entraîner des modifications structurales de la paroi artérielle 17.
Les adipocytes du TAE ont des propriétés intrinsèques pro-inflammatoires et athérogéniques. Il a été démontré que le profil inflammatoire et le ratio pro-inflammatoire des macrophages de type M1 et M2 anti-inflammatoire est altéré vers un phénotype plutôt M1 chez les patients coronariens. Il a été observé que les plaques d’athérome coronaire sont plus fréquemment retrouvées dans les régions où les dépôts de TAE sont abondants 18.
Le mécanisme par lequel le TAE pourrait favoriser l’athérosclérose est complexe et pas encore complètement élucidé. Il a été observé dans le TAE des patients coronariens une augmentation des produits réactifs de l’oxygène et une diminution de l’expression des antioxydants. D’autre part, les molécules d’adhésion cellulaire aux cellules endothéliales (en particulier l’augmentation de l’adhésion endothéliale des monocytes) sont activées en cas de pathologie coronaire 19.
Enfin, il y aurait aussi un effet lipogénique, le tissu adipeux pouvant contribuer à l’accumulation de lipides dans les plaques d’athérome. La réponse inflammatoire pourrait aussi contribuer au développement des plaques d’athérome à partir du TAE. Chez les patients coronariens, le TAE peut influencer le métabolisme myocardique glucidique en modifiant l’expression de GLUT4 (glucose transporter member 4).
D’autre part, le volume de TAE est corrélé aux taux circulants de leptine chez les patients diabétiques de type I 20. Il est possible que l’inflammation du TAE puisse contribuer à la genèse de ce que l’on appelle la cardiomyopathie diabétique chez les patients diabétiques de type II 21.
Implications cliniques
Imagerie : la détection et la quantification du TAE épicardique pourrait avoir à l’avenir une implication importante. Il est possible de mesurer son épaisseur en échocardiographie bidimensionnelle standard (Figure 2) 22 de façon simple et reproductible. Le TAE est identifié comme un espace libre d’écho entre la face extérieure du myocarde et le feuillet viscéral du péricarde. Sa mesure échocardiographique reflète de façon indépendante le niveau du volume tissu adipeux viscéral intra abdominal évalué par exemple en IRM.

De même, le contenu intra myocardique en lipides peut être mesuré en spectroscopie IRM.
Les limites de l’échocardiographie sont principalement dues au fait qu’il s’agit d’une mesure linéaire qui pourrait ne pas refléter le volume du TAE de façon précise. Le développement du scanner et de l’IRM cardiaque permet des mesures plus précises de volume mais ces méthodes sont moins disponibles et plus coûteuses que l’échocardiographie 23,24. Le scanner cardiaque est plus spécifique que l’échocardiographie pour la mesure de l’épaisseur et du volume du TAE. Quelle que soit la technique d’imagerie utilisée cette quantification peut maintenant être utilisée comme outil de stratification du risque cardiovasculaire.
Le TAE est-il un biomarqueur des maladies cardiovasculaires ?
Le TAE a été de façon constante associé au syndrome métabolique et à ces différents composants 25. Il est à noter que le TAE varie considérablement en fonction des différentes populations et de l’ethnie. C’est ainsi qu’il a été défini des niveaux de son volume pour prédire le risque de syndrome métabolique. La valeur prédictive positive de son volume calculé et son association avec le développement et la progression de la maladie coronaire ont été largement prouvées dans de larges populations 26,27. Le TAE est associé de façon significative et indépendante à l’extension et la sévérité de la maladie coronaire, les douleurs thoraciques, l’angor instable et la réserve coronaire 28,29. De plus, il est aussi associé aux événements coronariens fatals et non fatals dans la population générale quels que soient les facteurs de risque traditionnels présents : tabac, obésité, dyslipidémie et diabète 26,27.
Il a été démontré qu’il existe une corrélation positive entre le TAE et le risque de maladie coronaire ainsi que le développement des plaques à haut risque de rupture et ceci de façon indépendante à l’obésité et à la présence de calcifications coronaires 30,31. Ces résultats suggèrent que le TAE a un rôle important dans les phases précoces de développement des plaques d’athérome. En effet, il est plus souvent associé à la présence de plaques non calcifiées, instables et à risque important de rupture. Le niveau du TAE pourrait être associé au développement précoce des plaques coronaires non calcifiées et des plaques instables. Dans une étude expérimentale chez le cochon développant rapidement une maladie coronaire, il a été montré que l’exérèse chirurgicale des dépôts de TAE au niveau coronaire pourrait atténuer la progression de la maladie 32. Là encore, ces résultats suggèrent le rôle athérogénique du TAE qui entoure les artères coronaires. Enfin, le TAE a été associé à des marqueurs infracliniques d’athérosclérose tels que l’épaisseur intima-média carotidienne, le ratio ApoB/ApoA1 chez les patients symptomatiques et asymptomatiques à haut risque de maladie coronaire et de même chez l’enfant 33,34.
De façon intéressante, chez les patients en insuffisance cardiaque, le niveau du TAE pourrait aussi servir de marqueur pronostique en termes de survie 35. En effet, le volume ou l’épaisseur du TAE sont plus faibles chez les patients présentant une insuffisance cardiaque congestive par rapport aux individus avec fonction ventriculaire gauche systolique normale 35,36. Cette diminution du niveau du TAE pourrait refléter une réduction globale de la masse graisseuse observée fréquemment chez les patients en insuffisance cardiaque terminale. La mesure clinique du TAE pourrait être un outil important pour stratifier le risque cardiovasculaire de ces patients dans le futur.
Implications thérapeutiques
La simplicité de la quantification par les techniques d’imagerie du TAE et sa réponse métabolique rapide ont permis de servir de marqueur de l’efficacité des interventions de réduction pondérale (chirurgie bariatrique), ainsi que des effets de l’exercice physique et de certains traitements pharmacologiques. En effet, le niveau de TAE diminue après réduction calorique ou exercice aérobie. Son épaisseur diminue de façon beaucoup plus rapide et importante que tous les autres indices de masse graisseuse, ce qui suggère que la perte de tissu adipeux viscéral au niveau du TAE survient de façon plus précoce que dans les autres dépôts adipeux viscéraux.
Enfin, les effets de la chirurgie bariatrique sur le dépôt de TAE sont contradictoires puisqu’une étude a montré une diminution importante et une autre une diminution beaucoup plus faible. Le TAE peut aussi servir de cible thérapeutique pour les médicaments.
L’effet pharmacologique sur le TAE été évalué en particulier chez le diabétique de type 1 et 2 et en cas de dyslipidémie. Le profi l inflammatoire du TAE chez les patients diabétiques de type 2 a été nettement amélioré après traitement par pioglitazone. Chez l’homme, après angioplastie coronaire, un traitement par atorvastatine entrainait une diminution plus importante du volume du TAE qu’un traitement par simvastatine et ezetimibe 37. De même, l’effet de l’atorvastatine sur le TAE était supérieur à celui de la pravastatine chez les patientes dyslipidémiques ménopausées 38. Il n’y avait pas de corrélation entre l’effet de la réduction lipidique et la réduction du TAE sous statine, ceci suggérant des effets indépendants du médicament sur le tissu adipeux.
Conclusion
Le TAE est un tissu viscéral unique qui a des propriétés multiples tant au niveau local qu’au niveau systémique. Les implications cliniques sont très importantes. Son rôle physiologique et son adaptation aux différentes conditions hémodynamiques et métaboliques ne sont toujours pas complètements connus. D’autres études cliniques expérimentales sont nécessaires pour préciser son rôle dans le développement et la progression de l’athérosclérose. Le monitoring des modifications du TAE durant les différentes phases de la maladie coronaire pourrait nous aider à mieux comprendre la dynamique de l’athérogénèse de ce tissu. D’autre part, la simplicité de mesure du TAE pourrait servir d’outil pour évaluer l’effet d’un traitement pharmacologique.
Franck Boccara, Service de Cardiologie, INSERM U938, CDR St Antoine, Université Pierre et Marie Curie, Sorbonne, APHP, HUEP, Paris
RÉFÉRENCES
1. Iacobellis G. Local and systemic effects of the multifaceted epicardial adipose tissue depot. Nat Rev Endocrinol. 2015 Jun;11(6):363-71.
2. Iacobellis, G., Malavazos, A. E. & Corsi, M. M. Epicardial fat: from the biomolecular aspects to the clinical practice. Int. J. Biochem. Cell Biol. 2011;43, 1651–1654.
3. Iacobellis, G. & Bianco, A. C. Epicardial adipose tissue: emerging physiological, pathophysiological and clinical features. Trends Endocrinol. Metab. 2011;22, 450–457.
4. Sacks, H. S. et al. Uncoupling protein 1 and related mRNAs in human epicardial and other adipose tissues: epicardial fat functioning as brown fat. J. Clin. Endocrinol. Metab. 2009;94, 3611–3615.
5. Iacobellis, G., Corradi, D. & Sharma, A. M. Epicardial adipose tissue: anatomic, biomolecular and clinical relationships with the heart. Nat. Clin. Pract. Cardiovasc. Med. 2005;2, 536–543.
6. Mazurek, T. et al. Human epicardial adipose tissue is a source of infl ammatory mediators. Circulation 2003;108, 2460–2466.
7. Iacobellis, G. et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with CAD. Cytokine 2005 ;29, 251–255.
8. Iacobellis, G. et al. Epicardial adipose tissue adiponectin expression is related to intracoronary adiponectin levels. Horm. Metab. Res. 2009 ;41, 227–231.
9. Iacobellis, G. et al. Epicardial adipose tissue and intracoronary adrenomedullin levels in CAD. Horm. Metab. Res. 20009;45, 855–860.
10. acks, H. S. & Johnson, E. Adipokine concentrations are similar in femoral artery and coronary venous sinus blood: evidence against in vivo endocrine secretion by human epicardial fat. Adipobiology 2009;1, 51–56.
11. Iacobellis, G., Ribaudo, M. C., Zappaterreno, A., Iannucci, C. V. & Leonetti, F. Relation between epicardial adipose tissue and left ventricular mass. Am. J. Cardiol. 2004;94, 1084–1087.
12. Kankaanpää, M. et al. Myocardial triglyceride content and epicardial fat mass in human obesity: relationship to left ventricular function and serum free fatty acid levels. J. Clin. Endocrinol. Metab. 2006;91, 4689–4695.
13. Malavazos, A. E. et al. Relation of echocardiographic epicardial fat thickness and myocardial fat. Am. J. Cardiol. 2010 ;105, 1831–1835.
14. Iacobellis, G., Leonetti, F., Singh, N. & Sharma, A. M. Relationship of epicardial adipose tissue with atrial dimensions and diastolic function in morbidly obese subjects. Int. J. Cardiol. 2007;115, 272–223.
15. Mazurek, T. et al. Relation of proinfl ammatory activity of epicardial adipose tissue to the occurrence of atrial fi brillation. Am. J. Cardiol. 2014 ;113, 1505–1508.
16. Shimabukuro, M. et al. Epicardial adipose tissue volume and adipocytokine imbalance are strongly linked to human coronary atherosclerosis. Arterioscler. Thromb. Vasc. Biol. 2013;33, 1077–1084.
17. Sacks, H. S. & Fain, J. N. Human epicardial adipose tissue: a review. Am. Heart J. 2007;153, 907–917.
18. Prati, F. et al. Eccentric atherosclerotic plaques with positive remodelling have a pericardial distribution: a permissive role of epicardial fat? A three-dimensional intravascular ultrasound study of left anterior descending artery lesions. Eur. Heart J. 2003;24, 329–336.
19. Karastergiou, K. et al. Epicardial adipokines in obesity and CAD induce atherogenic changes in monocytes and endothelial cells. Arterioscler. Thromb. Vasc. Biol. 2010;30, 1340–1346.
20. Iacobellis, G., Diaz, S., Mendez, A. & Goldberg, R. Increased epicardial fat and plasma leptin in type 1 diabetes independently of obesity. Nutr. Metab. Cardiovasc. Dis. 2014;24, 725–729.
21. Greulich, S. et al. Secretory products from epicardial adipose tissue of patients with type 2 diabetes mellitus induce cardiomyocyte dysfunction. Circulation 2012;126, 2324–2334.
22. Iacobellis, G. & Willens, H. J. Echocardiographic epicardial fat: a review of research and clinical applications. J. Am. Soc. Echocardiogr. 2009;22, 1311–1319.
23. Nelson, A. J. et al. Validation of cardiovascular magnetic resonance assessment of pericardial adipose tissue volume. J. Cardiovasc. Magn. Reson. 2009 ;11, 15.
24. Sarin, S. et al. Clinical signifi cance of epicardial fat measured using cardiac multislice computed tomography. Am. J. Cardiol. 2008;102, 767–771.
25. Pierdomenico, S. D., Pierdomenico, A. M., Cuccurullo, F. & Iacobellis, G. Meta-analysis of the relation of echocardiographic epicardial adipose tissue thickness and the metabolic syndrome. Am. J. Cardiol. 2012;15, 1234–1236.
26. Mahabadi, A. A. et al. Association of epicardial adipose tissue with progression of coronary artery calcifi cation is more pronounced in the early phase of atherosclerosis: results from the Heinz Nixdorf Recall Study. JACC Cardiovasc. Imaging 2014;7, 909–916.
27. Mahabadi, A. A. et al. Association of epicardial fat with cardiovascular risk factors and incident myocardial infarction in the general population: the Heinz Nixdorf Recall Study. J. Am. Coll. Cardiol. 2013;61, 1388–1395.
28. Sade, LE. et al. Relation between epicardial fat thickness and coronary fl ow reserve in women with chest pain and angiographically normal coronary arteries. Atherosclerosis 2009;204, 580–585.
29. Eroglu, S. et al. Epicardial adipose tissue thickness by echocardiography is a marker for the presence and severity of CAD. Nutr. Metab. Cardiovasc. Dis. 2009;19, 211–217.
30. Iacobellis, G. et al. Epicardial fat thickness and CAD correlate independently of obesity. Int. J. Cardiol. 146, 452–454 (2011).
31. Yerramasu, A. et al. Increased volume of epicardial fat is an independent risk factor for accelerated progression of sub-clinical coronary atherosclerosis. Atherosclerosis 2012;220, 223–230.
32. McKenney, M. L. et al. Epicardial adipose excision slows the progression of porcine coronary atherosclerosis. J. Cardiothorac. Surg. 2014;9, 2
33. Iacobellis, G. et al. Relation of subepicardial adipose tissue to carotid intima-media thickness in patients with human immunodefi ciency virus. Am. J. Cardiol. 2007;99, 1470–1472.
34. Natale, F. et al. Visceral adiposity and arterial stiffness: echocardiographic epicardial fat thickness refl ects, better than waist circumference, carotid arterial stiffness in a large population of hypertensives. Eur. J. Echocardiogr. 2009;10, 549–555.
35. Doesch, C. et al. Bioimpedance analysis parameters and epicardial adipose tissue assessed by cardiac magnetic resonance imaging in patients with heart failure. Obesity (Silver Spring) 2010;18, 2326–2332.
36. Iacobellis, G., Zaki, M. C., Garcia, D. & Willens, H. J. Epicardial fat in atrial fi brillation and heart failure. Horm. Metab. Res.2014;46, 587 590.
37. Park, J. H. et al. Effects of statins on the epicardial fat thickness in patients with coronary artery stenosis underwent percutaneous coronary intervention: comparison of atorvastatin with simvastatin/ ezetimibe. J. Cardiovasc. Ultrasound 2010;18, 121–126.
38. Alexopoulos, N. et al. Effect of intensive versus moderate lipid-lowering therapy on epicardial adipose tissue in hyperlipidemic post-menopausal women: a substudy of the BELLES trial (Beyond Endorsed Lipid Lowering with EBT Scanning). J. Am. Coll. Cardiol. 2013;61, 1956–1961.
