
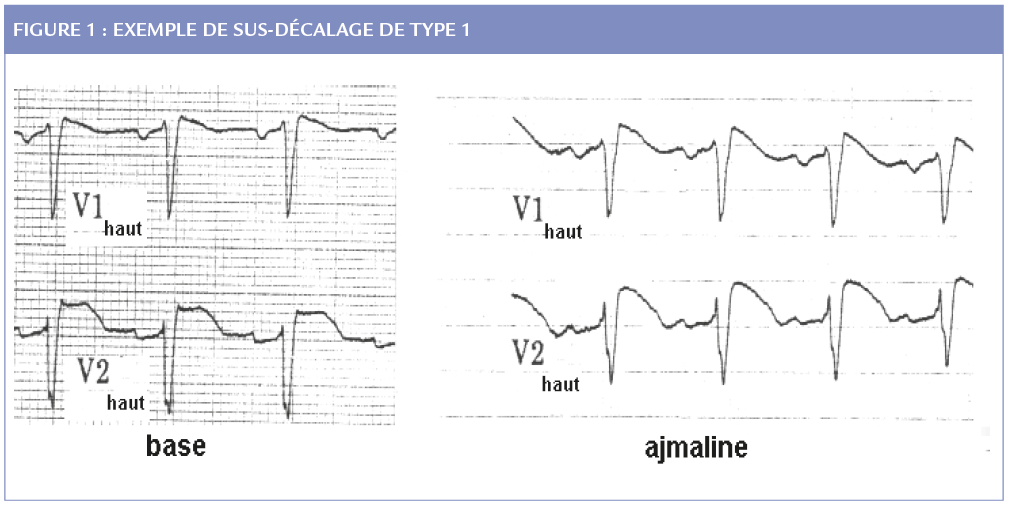
Le syndrome de Brugada est défini actuellement par la présence d’un sus-décalage de type 1 ( ≥ 2 mm, convexe, avec ondes T négatives) dans les dérivations précordiales droites en l’absence de cardiopathie structurelle ou de condition pouvant simuler cet aspect (1). Il peut être spontané ou induit par injection d’anti-arthmiques de classe 1 (figure 1). Il expose à un risque non négligeable d’arythmies ventriculaires malignes et de mort subite. Compris jusqu’à récemment comme une atteinte purement fonctionnelle électrique (« canalopathie ») il n’était donc pas considéré comme une indication potentielle d’ablation, mais des données plus ou moins récentes ont remis en cause la prise en charge de certains de ces cas. L’interêt et la possibilité d’une ablation dépendent de l’existence d’une portion critique de myocarde pouvant être détruite. Dans le cas du Brugada, tout dépend de la physio-pathologie expliquant les anomalies ECG et les arythmies.
Physiopathologie
Selon la théorie initiale des anomalies de la repolarisation, développée par Antzelevitch sur une préparation ex-vivo de ventricule de chien soumis à divers bloqueurs sodiques ou activateurs des canaux potassiques, le sus-décalage de type 1 est lié à un gradient de repolarisation entre certaines cellules épicardiques à potentiel d’action paradoxalement allongés et les cellules endocardiques à potentiels d’action plus courts. Cette théorie explique aussi la genèse d’extra-systoles et de fibrillation ventriculaire du fait de la coexistence épicardique locale de cellules à potentiels d’action court et long (« réentrée en phase 2 ») (2). De telles réentrées peuvent même donner l’apparence de potentiels tardifs ou fractionnés si elles restent bloquées localement. On comprend à première vue que ce modèle ne se prête que peu à l’idée de l’ablation.
L’autre principale théorie physio-pathologique fait intervenir des troubles de la dépolarisation, donc de la conduction intra-myocardique, comme en témoignent en clinique la présence de potentiels tardifs, de QRS fractionnés ou de mutations sur le canal sodique. Selon cette théorie, un gradient lectrique existe entre la chambre de chasse du ventricule droit et le reste du cœur, à la fois pendant la dépolarisation et la repolarisation, à cause du déphasage temporel de cette chambre de chasse du fait des troubles conductifs (3). A première vue cette hypothèse se prête mieux à l’éventualité d’une ablation car elle implique davantage l’existence de troubles structurels.
De nombreux travaux ont tenté de fournir des preuves cliniques chez l’homme pour chacune de ces théories, sans pouvoir trancher définitivement, même si manifestement il existe des troubles conductifs dans la chambre de chasse du ventricule droit des patients avec syndrome de Brugada (cf plus loin).
D’un autre coté, les investigations non invasives par imagerie des patients avec syndrome de Brugada ont à de maintes reprises retrouvé de petites anomalies de volume ou de contraction du ventricule droit. Plus récemment des anomalies de clearance du gadolinium dans le ventricule gauche ont été retrouvées chez 8% des Brugada (4). Divers autres travaux plus ou moins récents ont également mis en évidence des anomalies structurelles variées sur des biopsies (cardiomyopathies, apoptose, myocardite virale, infiltration graisseuse, fibrose, collagène, hypertrophie, baisse des connexines).
En pratique clinique, les explorations invasives endocardiques du ventricule droit chez des patients avec syndrome de Brugada ont retrouvé des délais d’activation et des potentiels fractionnés et parfois même des zones cicatricielles dans la chambre de chasse (5), même si ceci n’est pas rapporté par d’autres équipes (6). Enfin les explorations non invasives par mapping de surface de haute résolution retrouvent également des zones hypovoltées sur la face épicardique de la chambre de chasse, avec troubles conductifs et sus-décalage locaux, associés à des gradients de repolarisation locaux, validant ainsi les deux théories (7).
De multiples travaux expérimentaux ont par ailleurs démontré qu’une anomalie purement fonctionnelle, comme par exemple un déficit du canal sodique et une baisse du sodium intra-cellulaire, peut entraîner à long-terme des anomalies structurelles avec fibrose ou apoptose. Ainsi le lien entre une canalopathie et une cardiomyopathie structurelle peut être établi.
Les résultats de l’ablation
Expérimentalement, la destruction des zones de gradient ou des couches épicardiques fait disparaître les arythmies et le sus-décalage du segment ST (8).
Les premières ablations dans le syndrome de Brugada ont été réalisées devant des orages rythmiques réfractaires, en ciblant les ESV initiatrices et/ou les zones de conduction retardée par voie endocardique, modifiant ensuite parfois l’ECG (5, 9).
En 2011, Nademanee et coll. sont les premiers à explorer par voie épicardique percutanée 9 cas de Brugada avec fibrillation ventriculaire récidivante. Dans chaque cas, ils découvrent une zone de potentiels fractionnés polyphasiques post-QRS et des zones de bas voltage dans l’épicarde de la chambre de chasse, alors que les cartographies endocardiques et des autres zones épicardiques sont strictement normales (6). La destruction de ces zones par la radio-fréquence normalise l’ECG dans 89% des cas à 3 mois, seuls 20% restent inductibles en aigu et un seul patient récidivera ensuite. Il est ainsi conclu que ces zones cicatricielles sont la cause du sus-décalage et des arythmies.
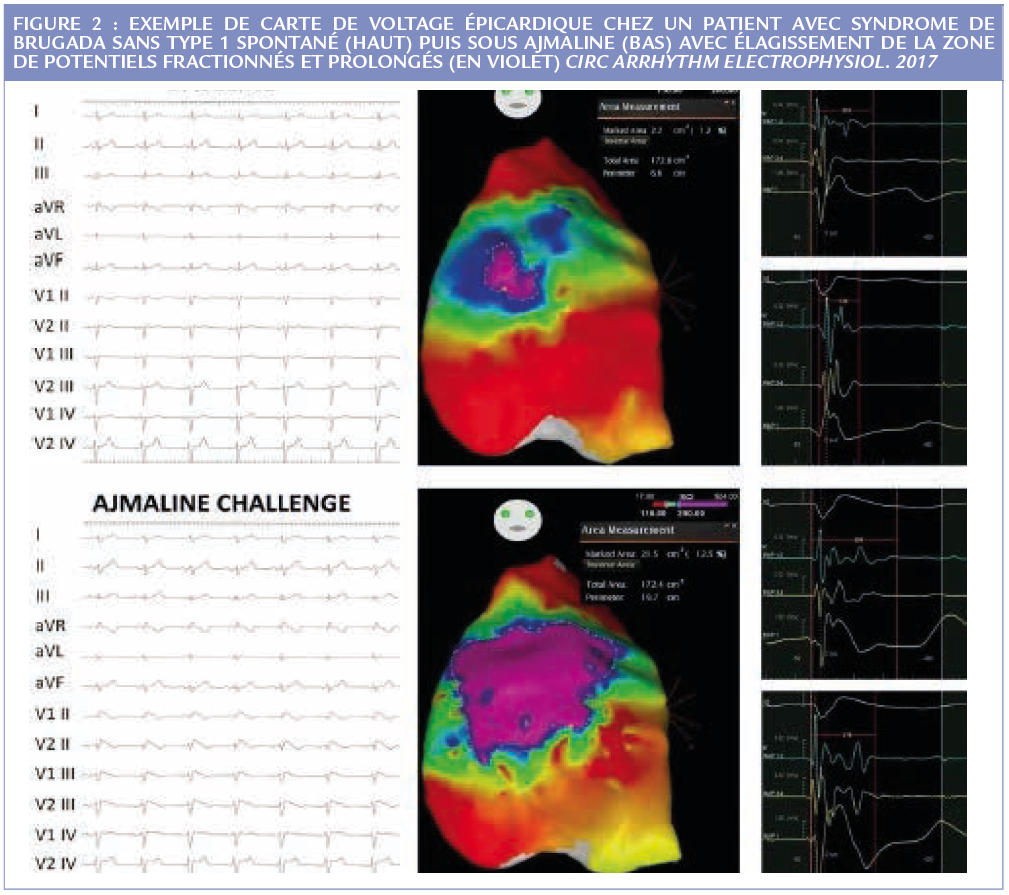
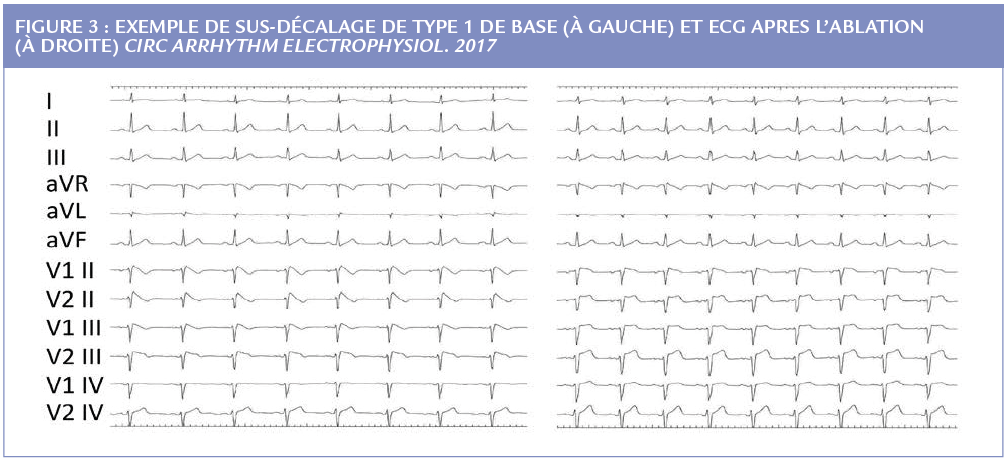
Ce concept de pathologie structurelle épicardique traitable par ablation est ensuite repris en 2015 par les frères Brugada et Carlo Pappone, sur 14 patients avec Brugada symptomatique, démontrant à nouveau l’existence de larges plages de cicatrices purement épicardiques de la chambre de chasse, augmentant même de taille sous anti-arythmiques de classe 1 (figure 2). L’ablation complète de ces zones rend les patients non inductibles, normalise les ECG (même après test médicamenteux) chez tous les patients au cours du suivi et évite les récidives sur un suivi assez court. Un travail plus récent du même groupe sur 135 cas a été ensuite publié, conduisant à l’élimination de l’inductibilité et du sus-décalage chez tous les patients (figure 3). A 10 mois de suivi, 98% des patients n’ont pas récidivé et n’ont plus de sus-décalage lors des tests médicamenteux (10). A noter que seulement une minorité des sujets inclus avaient des arythmies spontanées. Dans cette série, la surface des zones pathologiques était corrélée au sus-décalage, au type 1 spontané, aux symptômes et au sexe masculin.
Enfin récemment, il a aussi été démontré chez 21 patients avec fibrillation ventriculaire récurrente, que l’ablation endocardique des ESV initiatrices et des zones anormales conférait un excellent pronostic à long terme, et que seule une petite proportion de ces patients (notamment ceux avec encoche de l’onde S en V1) allaient présenter des récidives, et pour lesquels une approche épicardique doit être envisagée d’emblée (11).
Conclusion
Le syndrome de Brugada, pathologie structurelle génétique de la chambre de chasse du ventricule droit, semble associer des anomalies de la dépolarisation et de la repolarisation. Les différences avec d’autres pathologies myocardiques héréditaires comme la dysplasie arythmogène semblent s’estomper parfois, même si le phénotype est clairement différent dans les formes typiques. La possibilité d’un traitement curatif par l’ablation notamment épicardique existe. Plus de recul est nécessaire quant au succès à long terme et à la sélection des patients proposés à une procédure encore lourde et non anodine. Ceci pourrait cependant modifier les indications de défi brillateur dans le futur. Une étude prospective randomisée est en cours à ce sujet BRAVE study. Pour l’instant, seuls les patients avec fibrillation ventriculaire récidivante, notamment sous quinidine, doivent être adressés pour ablation, et uniquement à des centres experts.
L’auteur déclare ne pas avoir de liens d’intérêts
Adresse pour correspondance: Dr. Philippe Maury, Service de Cardiologie, CHU Rangueil, 31059 Toulouse Cedex 09, France Tel: + 33 (0) 5 61 32 30 54 Fax : + 33 (0) 5 61 32 22 46
Philippe Maury (a, b), Anne Rollin (a),
(a) CHURangueil, (b) Unité Inserm U1048, Toulouse, France
mauryjphil@hotmail.com
RÉFÉRENCES
1. Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, Blom N, Brugada J, Chiang CE, Huikuri H, Kannankeril P, Krahn A, Leenhardt A, Moss A, Schwartz PJ, Shimizu W, Tomaselli G, Tracy C. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm. 2013;10:1932-63
2. Szél T, Antzelevitch C. Abnormal repolarization as the basis for late potentials and fractionated electrograms recorded from epicardium in experimental models of Brugada syndrome. J Am Coll Cardiol. 2014;63:2037-45
3. Meregalli PG, Wilde AA, Tan HL. Pathophysiological mechanisms of Brugada syndrome: depolarization disorder, repolarization disorder, or more? Cardiovasc Res. 2005;67:367-78
4. Bastiaenen R, Cox AT, Castelletti S, Wijeyeratne YD, Colbeck N, Pakroo N, Ahmed H, Bunce N, Anderson L, Moon JC, Prasad S, Sharma S, Behr ER. Late gadolinium enhancement in Brugada syndrome: A marker for subtle underlying cardiomyopathy? Heart Rhythm. 2017;14:583-589
5. Sunsaneewitayakul B, Yao Y, Thamaree S, Zhang S. Endocardial mapping and catheter ablation for ventricular fi brillation prevention in Brugada syndrome. J Cardiovasc Electrophysiol. 2012;23 Suppl 1:S10-6.
6. Nademanee K, Veerakul G, Chandanamattha P, Chaothawee L, Ariyachaipanich A, Jirasirirojanakorn K, Likittanasombat K, Bhuripanyo K, Ngarmukos T. Prevention of ventricular fi brillation episodes in Brugada syndrome by catheter ablation over the anterior right ventricular outfl ow tract epicardium. Circulation. 2011;123:1270-9
7. Zhang J, Sacher F, Hoffmayer K, O’Hara T, Strom M, Cuculich P, Silva J, Cooper D, Faddis M, Hocini M, Haïssaguerre M, Scheinman M, Rudy Y. Cardiac electrophysiological substrate underlying the ECG phenotype and electrogram abnormalities in Brugada syndrome patients. Circulation. 2015;131:1950-9
8. Patocskai B, Yoon N, Antzelevitch C. Mechanisms Underlying Epicardial Radiofrequency Ablation to Suppress Arrhythmogenesis in Experimental Models of Brugada Syndrome. JACC Clin Electrophysiol. 2017;3:353-363
9. Haïssaguerre M, Extramiana F, Hocini M, Cauchemez B, Jaïs P, Cabrera JA, Farré J, Leenhardt A, Sanders P, Scavée C, Hsu LF, Weerasooriya R, Shah DC, Frank R, Maury P, Delay M, Garrigue S, Clémenty J. Mapping and ablation of ventricular fi brillation associated with long-QT and Brugada syndromes. Circulation. 2003;108:925-8.
10. Pappone C, Brugada J, Vicedomini G, Ciconte G, Manguso F, Saviano M, Vitale R, Cuko A, Giannelli L, Calovic Z, Conti M, Pozzi P, Natalizia A, Crisà S, Borrelli V, Brugada R, Sarquella-Brugada G, Guazzi M, Frigiola A, Menicanti L, Santinelli V. Electrical Substrate Elimination in 135 Consecutive Patients With Brugada Syndrome. Circ Arrhythm Electrophysiol. 2017;10:e005053
11. Talib AK, Takagi M, Shimane A, Nakano M, Hayashi T, Okajima K, Kentaro M, Fukada K, Kowase S, Kurosaki K, Nitta J, Nishizaki M, Yui Y, Talib A, Sato N, Kawamura Y, Hasebe N, Aita S, Sai E, Komatsu Y, Kuroki K, Kaneshiro T, Dongzu X, Tajiri K, Igarashi M, Yamasaki H, Murakoshi N, Kumagai K, Sekiguchi Y, Nogami A, Aonuma K. Effi cacy of Endocardial Ablation of Drug-Resistant Ventricular Fibrillation in Brugada Syndrome. Circ Arrhythm Electrophysiol. 2018;11:e005631
