Les inhibiteurs du co-transport rénal sodium-glucose ont fait et font l’objet de grandes études de sécurité cardio-vasculaire chez les patients diabétiques de type 2. Ces études permettent de leur reconnaître des effets bénéfiques substantiels en termes de réduction des événements cardiovasculaires majeurs et de la progression de l’atteinte rénale. S’appuyant sur ces résultats, la position commune récente EASD / ADA leur attribue une place de choix en particulier chez les patients atteints d’insuffisance cardiaque ou de maladie rénale.
Comment agissent les inhibiteurs des SGLT2 ?
Chez les personnes en bonne santé, environ 180 g de glucose sont filtrés quotidiennement par les glomérules rénaux, puis réabsorbés dans le tube contourné proximal. Ceci est réalisé par des transporteurs passifs, à savoir les « glucose transporters » ou GLUTs et des transporteurs actifs, à savoir les « sodiumglucose co-transporters », les SGLTs. Parmi les six SGLTs identifiés, deux (SGLT1 et surtout SGLT2) sont les plus importants. Les SGLT2 sont localisés seulement dans le rein, sur les segments 1 et 2 du tube contourné proximal, avec une contribution très élevée (90%) à la réabsorption du glucose.
Le premier inhibiteur des SGLTs découvert était la phlorizine, un composé naturel dérivé de l’écorce de pommier. En raison de son caractère non sélectif, avec de graves symptômes digestifs, et de sa faible biodisponibilité orale, il n’a pas donné lieu à un développement thérapeutique.
Des inhibiteurs pharmacologiques spécifiques des SGLT2 ont été développés en thérapeutique (SGLT2-i) (1). Ces médicaments, les gliflozines, évitent les effets gastrointestinaux liés à l’inhibition du SGLT1.
Administrés par voie orale, ils inhibent la fonction de cette protéine tissulaire et diminuent la réabsorption rénale du glucose, ce qui augmente la glycosurie et abaisse la glycémie. Ils sont proposés dans le traitement du diabète de type 2 de l’adulte non équilibré par d’autres médicaments hypoglycémiants, y compris l’insuline, combinés à un régime alimentaire et à l’exercice physique. Ils peuvent être prescrits en association avec divers anti-diabétiques.
Trois SGLT2-i ont une AMM en France, la canagliflozine, la dapagliflozine et l’empagliflozine et un autre, l’ertugliflozine (2), est en attente d’instruction du dossier par la Commission de transparence. Ils occupent une bonne place dans la stratégie thérapeutique dans plusieurs recommandations internationales mais ne sont pas encore disponibles en France.
Pharmacologie des gliflozines
Leur effet dépend du taux sanguin de glucose et est indépendant des actions de l’insuline. Ainsi, le potentiel d’hypoglycémie est minime. Leur efficacité est réduite en cas d’insuffisance rénale.
Plusieurs gliflozines ont été comparées sur le plan pharmacologique chez des souris diabétiques de type 2 par Tahara et coll. (3). Ces auteurs ont pu en distinguer deux catégories : les SGLT2-i à action prolongée, dapagliflozine et ipragliflozine ; et ceux à action intermédiaire, canagliflozine, empagliflozine, tofogliflozine et luseogliflozine. Bien que tous augmentent considérablement l’excrétion urinaire de glucose et réduisent l’hyperglycémie, les différences en termes de délai d’apparition et de durée de leurs effets pharmacologiques peuvent rendre compte de différence d’efficacité sur le contrôle glycémique. Ainsi, les SGLT2-i à longue durée d’action exerceraient une activité anti-hyperglycémique avec une moindre variabilité de la glycémie du fait de l’augmentation durable de l’excrétion urinaire de glucose.
Effets des SGLT2-i complémentaires de la baisse glycémique
Les inhibiteurs du co-transporteur-2 sodium-glucose entraînent une réduction du poids corporel, allant d’environ 1 à 5 kg, avec une baisse apparemment plus importante chez les patients ayant une plus longue durée de diabète et chez ceux ayant un poids plus élevé. Une partie de la perte de poids est due à la diminution de la volémie, mais il a été montré que les deux tiers de la perte de poids sont perdus à partir de la masse grasse (en particulier de la graisse viscérale).
Les SGLT2-i entraînent également une réduction significative de la PA systolique et diastolique. Ces modifications sont relativement plus importantes pour la PA systolique, ne dépendent pas de la dose et ne se caractérisent pas par une tachycardie concomitante ni par des symptômes d’hypotension / syncope dans la plupart des cas. Certaines études ont rapporté une réduction allant jusqu’à 13–17 mmHg de la PA systolique avec l’empagliflozine, une amplitude de baisse similaire à celle observée avec de nombreux médicaments anti-hypertenseurs. La baisse tensionnelle est due au début à une diurèse osmotique avec baisse de la volémie (dont témoigne l’augmentation de l’hématocrite) et à la perte pondérale. Le maintien persistant de la baisse tensionnelle implique ultérieurement des mécanismes complémentaires notamment une modification du métabolisme de l’angiotensine 1 conduisant à l’activation du récepteur Mas (une voie dotée d’effets de cardioprotection), une baisse d’activité sympathique et possiblement une réduction de la rigidité artérielle et une amélioration de la fonction endothéliale.
Enfin, les SGLT2-i semblent avoir un effet favorable ou neutre sur les lipides et font baisser l’uricémie en augmentant l’uricosurie.
Ces effets des SGLT2-i, perte de poids, baisse de la volémie, réduction de la PA et de l’uricémie, et certains effets pléiotropes à mieux documenter, au niveau vasculaire et sur le système nerveux autonome, les rendent particulièrement attrayants pour une utilisation chez les personnes atteintes d’un syndrome métabolique et chez celles souffrant d’une surcharge liquidienne légère, mais surtout chez les diabétiques de type 2 ayant une pathologie cardio-vasculaire, en particulier une insuffisance cardiaque (IC). La baisse de la pré et de la post-charge contribue en effet à réduire le risque d’IC et à un bénéfice attendu en cas d’IC avérée.
Les études de morbi-morbidité déjà parues avec les SGLT2-i
Les résultats de trois études ont été publiés. Le schéma de ces études est proche mais les populations incluses présentent quelques différences Tableau 1.
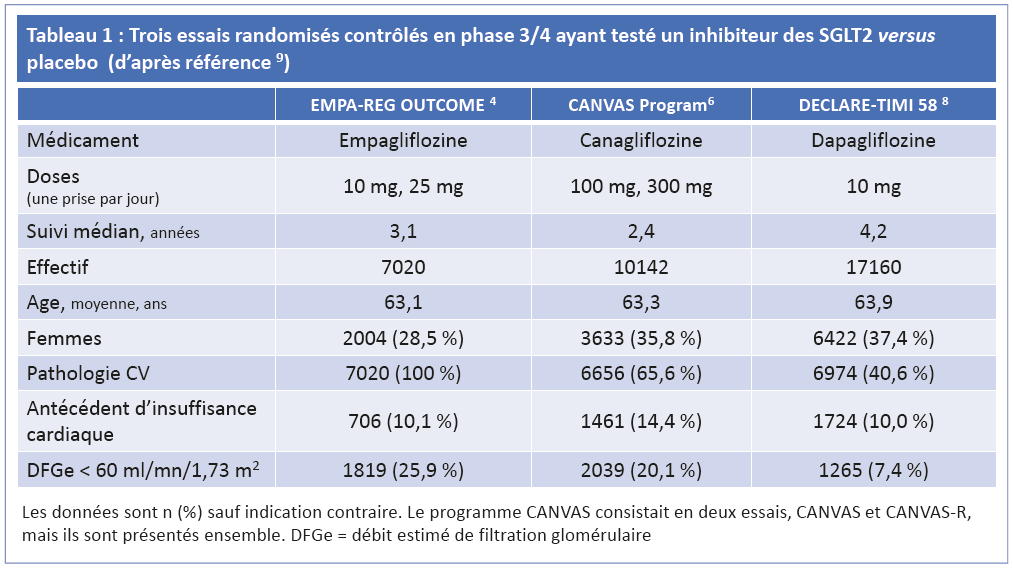
L’étude EMPA-REG OUTCOME avec l’empagliflozine (2015)
L’étude EMPA-REG (4) était une étude de sécurité CV testant l’empaglifozine (10 ou 25 mg) chez des patients diabétiques ayant une maladie CV connue.
Le critère de jugement principal (MACE-3 : mortalité CV, infarctus et AVC non fatals) était réduit sous empaglifozine de 14%, la mortalité totale de 32%, la mortalité cardio-vasculaire de 38% incluant une réduction des morts subites, et les hospitalisations pour IC de 35%, sans différence notable d’effets dans les sous-groupes examinés.
Cette étude était la première indiquant un bénéfi ce CV très consistant, sur le critère principal et sur plusieurs critères secondaires dont surtout la mortalité, avec un traitement anti-diabétique spécifique, et cela dans une population recevant les traitements de référence en prévention secondaire.
Un ralentissement de la progression de l’atteinte rénale était aussi mis en évidence (5).
L’étude CANVAS avec la canagliflozine (2017)
Le programme CANVAS a intégré les données de deux essais, CANVAS et de CANVAS-R. L’analyse intégrée a porté sur 10142 participants (4330 dans CANVAS et 5812 dans CANVAS-R) atteints de diabète de type 2 et présentant un risque CV élevé dont 65,6% avaient des antécédents de maladie CV (6,7). Les participants à chaque essai ont été randomisés pour recevoir la canagliflozine (jusqu’à 300 mg) ou un placebo et ont été suivis pendant environ 188 semaines en moyenne.
L’incidence du critère principal de jugement (MACE-3) était plus basse avec la canagliflozine qu’avec le placebo (26,9 vs 31,5 par 1000 années-patients; HR 0,86; intervalle de confiance [IC] à 95%, 0,75-0,97; p<0,001 pour la non-infériorité; p=0,02 pour la supériorité).
Bien que sur la base de la séquence d’hypothèses préspécifiées, les résultats rénaux ne soient pas considérés comme statistiquement significatifs, les résultats ont montré un bénéfice possible de la canagliflozine en ce qui concerne la progression de l’albuminurie (HR 0,73 [IC 95% : 0,67-0,79]) et le critère composite rénal (HR 0,60 [IC 95% : 0,47-0,77]).
Les effets indésirables étaient cohérents avec les risques précédemment associés à la canagliflozine, à l’exception d’un risque accru d’amputations (6,3 vs 3,4 par 1000 années-patients; HR 1,97 [IC95% 1,41-2,75]).
Les raisons de ce risque d’amputations, principalement au niveau de l’orteil ou du métatarse, ne sont pas claires mais pourraient être favorisées par l’hypovolémie et la réduction des flux distaux sur un terrain artériopathique.
L’étude DECLARE-TIMI 58 avec la dapaglifl ozine (2018)
L’étude DECLARE – TIMI 58 (8) a inclus le plus grand nombre de patients (n=17160), avec une grande représentativité de patients diabétiques de type 2, en prévention primaire (hommes ≥ 55 ans ou femmes ≥ 60 ans avec au moins un autre facteur de risque d’athérosclérose) et en prévention secondaire (patients avec une pathologie cardiovasculaire par athérosclérose). La particularité essentielle de la population incluse dans cette étude tient à la forte proportion de patients en prévention primaire (59%).
Après un suivi médian de 4,2 ans, la dapagliflozine (10 mg) a montré des résultats favorables sur les deux critères primaires d’efficacité : d’une part, le critère préspécifié de non infériorité sur le MACE-3 était atteint (HR 0,93 [IC 95% : 0,84-1,03], p <0,001 pour la non infériorité), d’autre part le taux de mortalité CV et d’hospitalisations pour IC (4,9 vs 5,8%, HR 0,83 [IC 95% : 0,73-0,95], p= 0,005) a été reduit, le bénéfice portant sur la réduction des hospitalisations pour IC. De plus, un effet bénéfique a été observé sur le critère composite rénal défini par une baisse de ≥ 40% du débit estimé de filtration glomérulaire à < 60 ml/mn/1,73 m2, insuffisance rénale terminale ou décès de cause rénale ou cv (4,3 vs 5,6%, HR 0,76 [IC 95% : 0,67-0,87]).
Dans les analyses en sous-groupes il n’a pas été constaté de différence pour le critère mixte mortalité CV ou hospitalisations pour IC ni pour le MACE-3 selon l’existence ou l’absence d’antécédent CV ou d’IC au départ.
La dapagliflozine a été généralement bien tolérée, hormis un excédent d’infections génitales et d’acidocétoses diabétiques, comme cela était noté dans les deux autres études, tandis qu’il n’a pas été rapporté d’augmentation du risque d’amputations. De plus, d’autres effets favorables ont été observés : la dapagliflozine a réduit le risque d’hypoglycémies, d’insuffisances rénales aiguës et de cancers de la vessie.
Ainsi, ces trois essais de sécurité CV menés avec des SGLT2-i montrent globalement une réduction des événements CV, mais l’étude DECLARE par le fort contingent de patients en prévention primaire suggère également un bénéfice sur les hospitalisations pour IC dans cette situation.
Une méta-analyse des trois études
En intégrant les données d’EMPA-REG OUTCOME, du programme CANVAS et de DECLARE-TIMI 58 sur les effets CV des SGLT2-i, une méta-analyse récente (9) a confirmé que les avantages cliniques des SGLT2-i dans la réduction du risque d’infarctus du myocarde, d’AVC ou de décès CV étaient présents uniquement chez les patients présentant une maladie CV athéroscléreuse établie et non chez ceux à haut risque avec plusieurs facteurs de risque en prévention primaire. Par contre, les réductions du risque d’hospitalisation pour IC ou de progression de l’insuffisance rénale étaient robustes indépendamment de la présence d’une maladie CV par athérosclérose ou d’une IC au départ.
Dans les essais individuels, l’ampleur du bénéfice sur les événements CV majeurs semblait obtenue dans les sous-groupes présentant une maladie CV par athérosclérose établie, bien que l’hétérogénéité n’ait pas été formellement démontrée en raison d’un manque de puissance lié au faible nombre de patients et d’événements dans les sous-groupes de prévention primaire.
Les données de 34322 patients (60,2% avec une maladie CV par athérosclérose établie) ont été colligées, avec 3342 événements CV majeurs, 2028 décès de cause CV ou hospitalisations pour IC et 766 événements composites rénaux. Les SGLT2-i ont réduit les événements CV majeurs de 11% (HR 0,89 [IC 95% 0,83-0,96], p=0,0014), avec un bénéfice observé uniquement chez les patients atteints de maladie CV (0,86 [IC 0,80-0,93]) et non chez ceux qui n’en étaient pas atteints (1,00 [IC 0,87-1,16]) (p pour interaction = 0,0501) Tableau 2. Les SGLT2-i ont réduit de 23% le risque de décès CV ou d’hospitalisation pour IC (0,77 [IC 0,71–0,84], p<0,0001), avec cette fois-ci un bénéfice similaire chez les patients atteints ou non de maladie CV par athérosclérose et d’antécédent d’IC (table 2). Cet effet résulte essentiellement d’une réduction de 30% des hospitalisations pour IC. Les SGLT2-i ont réduit de 45% (0,55 [IC 0,08–0,64], p <0,0001) le risque de progression de l’insuffisance rénale avec un bénéfice similaire chez les personnes atteintes ou non de maladie CV par athérosclérose. L’importance du bénéfice des SGLT2-i a varié selon la fonction rénale initiale, avec une réduction plus importante des hospitalisations pour IC (p pour interaction = 0,003) et des réductions moins amples de la progression de l’insuffisance rénale (p pour interaction = 0,0258) chez les patients avec une atteinte rénale plus marquée (débit de filtration glomérulaire < 60 ml/mn/m2) au départ.
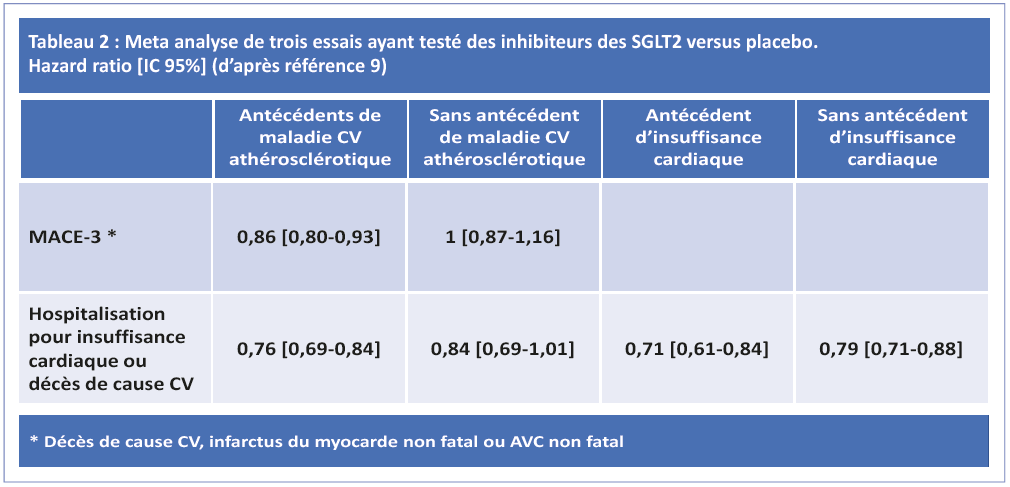
S’il est tentant d’évoquer un effet classe des SGLT2 il faut noter certaines hétérogénéités entre les résultats de ces 3 études. En particulier dans le sous-groupe des patients avec antécédent de maladie CV la réduction de mortalité CV était la plus forte dans l’étude EMPAREG, ce qui peut être rapproché d’une forte différence de mortalité CV sous placebo dans ce sous-groupe entre les 3 études.
Les données de cette méta-analyse soutiennent que les SGLT2-i devront être considérés chez les patients atteints de diabète de type 2, indépendamment de la présence d’une maladie CV par athérosclérose ou d’antécédents d’insuffisance cardiaque, dans la mesure où au-delà de leur effet consistant sur le contrôle glycémique ces médicaments réduisent le risque d’hospitalisation pour IC et de progression d’une insuffisance rénale chez un large spectre de patients atteints de diabète de type 2. Une réduction des événements CV majeurs peut également être attendue chez les patients en prévention secondaire atteints d’une maladie CV par athérosclérose établie. D’autres analyses de ces études permettront sans doute de préciser, en dehors de l’insuffisance rénale,
le profil de patients diabétiques particulièrement exposés au risque d’hospitalisation pour IC et ainsi de bénéficier de cette classe thérapeutique. Enfin des essais cliniques en cours dans des populations de patients atteints d’IC ou de maladie rénale clarifieront si les effets des SGLT2i se retrouvent en l’absence de diabète.
Dès à présent, sur la base des résultats de ces études, la position commune EASD / ADA (European Association for the Study of Diabetes et American Diabetes Association) attribue, en seconde ligne après les mesures hygiéno-diététiques et la metformine, une place de choix aux SGLT2-i.
Nous avons hâte en France que cette nouvelle classe thérapeutique puisse enfin être mise à disposition de nos patients.
Déclaration de conflits d’intérêt potentiels
Pierre Attali déclare avoir fait des conférences à la demande d’Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Bristol Myers Squibb (BMS), Merck Sharp Dohme, Novartis, Pfizer, Servier.
Paul Valensi déclare avoir fait des conférences à la demande de Merck Santé, GlaxoSmithKline (GSK), Merck Sharp Dohme (MSD), Novo Nordisk, Novartis, Pierre Fabre, Abbott, Eli-Lilly, Bayer, Bohringer, Bristol Myers Squibb (BMS)-AstraZeneca (AZ), Sanofi ; avoir obtenu des crédits pour ses recherchesde la part de Merck Santé, GSK, Novo Nordisk, Bayer, Abbott, BMS-AZ ; avoir participé à des Comités d’Experts pour GSK, Novo Nordisk, Boehringer Ingelheim, Astra Zeneca, BMS, MSD, Daiichi-Sankyo, Lilly, Sanofi ; être intervenu comme expert auprès de l’HAS, l’AFSSAPS, l’ANSM ; être membre de la Task Force ESC/EASD sur Diabetes, Prediabetes and CVD 2013 et 2019.
Pierre Attali
Pôle Cardiovasculaire médico-chirurgical, Nouvel hôpital civil, Hôpitaux universitaires de Strasbourg
Paul Valensi
Services d’Endocrinologie Diabétologie Nutrition, hôpitaux Jean Verdier, René Muret et Avicenne; Université Paris Nord, CINFO, CRNH-IdF. Bondy, Sevran et Bobigny
paul.valensi@aphp.fr
RÉFÉRENCES
1. Kalra S. Sodium Glucose Co-Transporter-2 (SGLT2) Inhibitors: A Review of Their Basic and Clinical Pharmacology. Diabetes Ther 2014; 5: 355-66.
2. Ertugliflozin for Type 2 Diabetes. JAMA 2018;319): 2434-2435.
3. Tahara A. et al. Characterization and comparison of sodium-glucose cotransporter 2 inhibitors in pharmacokinetics, pharmacodynamics, and pharmacologic effects. J Pharmacol Sci 2016; 130: 159-69.
4. Zinman B. et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes N Engl J Med 2015; 373: 2117-28.
5. Wanner et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375:323-34.
6. Mahaffey K.W. et al. Canagliflozin for Primary and Secondary Prevention of Cardiovascular Events: Results From the CANVAS Program (Canagliflozin Cardiovascular Assessment Study). Circulation 2018; 137: 323-334.
7. Neal B. et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017;377:644-657.
8. Wiviott S.D. et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2018.
9. Zelniker T.A. et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet 2018.
10. Davies MJ et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018;61:2461-2498.
