
L’accès des patients à l’imagerie par résonance magnétique (IRM) reste un enjeu majeur. L’IRM est devenue un outil de prise en charge diagnostique et thérapeutique incontournable pour un nombre toujours croissant de situations cliniques (atteintes neurologiques, musculo-squelettiques, oncologiques et cardiovasculaires).
Parallèlement à l’augmentation des examens IRM, le nombre de patients porteurs de dispositifs cardiaques implantables (PM ou DAI) a également augmenté. En France entre 2011 et 2016, on note une augmentation de plus de 8,6 % du nombre de stimulateurs implantés et de plus de 25% pour les DAI (livre blanc EHRA 2012 et 2017). L’augmentation combinée de ces deux phénomènes conduit à une probabilité de 50% à 75% pour un patient d’avoir une IRM au cours de sa vie (1). Pourtant, en raison d’une méconnaissance du rapport bénéfice/risque, cette option reste souvent refusée au patient.
Les principaux obstacles à sa réalisation sont encore actuellement les réticences liées au risque mais aussi probablement à la logistique pour organiser l’examen. S’il est important que les patients ne bénéficient pas d’examens IRM inutiles, il est surtout essentiel qu’ils ne soient pas privés de cet outil diagnostic important.
Quelle est la réalité du besoin d’imagerie par résonance magnétique chez les porteurs de prothèse ?
Il est estimé que 28% des patients avec prothèse auront une indication d’IRM sur une période de 4 ans avec pour un tiers d’entre eux la nécessité de plus d’un examen. (2) Dans une étude plus récente, c’est 53 à 64% des patients avec PM ou DAI qui auront besoin d’une IRM sur une période de 10 ans. (3)
Pourtant les patients porteurs d’un PM/DAI ne bénéficient pas d’un accès optimal à l’IRM, ce qui constitue probablement une perte de chance pour eux. Un registre (4) montre qu’après un AVC, 42 % des patients sans DAI bénéficieront d’une IRM cérébrale contre seulement 0,3 % des porteurs d’un dispositif. De même, en cas de douleur rachidienne, 30 % des patients sans prothèse auront une IRM contre 0,4 %.
L’étude « Really ProMRI » (5) montre que si une IRM a été prescrite chez 7,0% des patients /an, beaucoup de ces examens ont été refusés malgré la présence de dispositifs IRM compatibles en particulier chez les patients avec DAI. Ainsi, 83% des procédures IRM prescrites ont été effectuées chez les patients avec stimulateur cardiaque alors que seulement 29% seront réalisées chez les
patients du groupe DAI.
La contre-indication historique à l’IRM pour les patients porteurs de prothèse semble toujours influencer l’opinion et le comportement des cardiologues mais aussi des radiologues. Dans cette étude, 86% des examens refusés, étaient dus à une décision du radiologue.L’attention est encore trop souvent orientée sur la sécurité, avec peu de données sur l’utilité diagnostique de l’IRM.
Pour la première fois, on trouve dans l’étude de Huma Samar (6) la notion de valeur ajoutée pour un risque assumé.
Chez 97% (n = 132) des patients, l’IRM a ajouté de la valeur au diagnostic et à la gestion du patient. Dans 49% des cas (n= 67), l’IRM a donné des informations précieuses au diagnostic principal et chez 30% des patients, l’IRM a changé le diagnostic principal ainsi que le traitement ultérieur. Aucun problème de sécurité, pour tous les patients, n’a été rencontré au cours de l’examen IRM. Interaction PM-DAI/IRM : effets des différents champs.
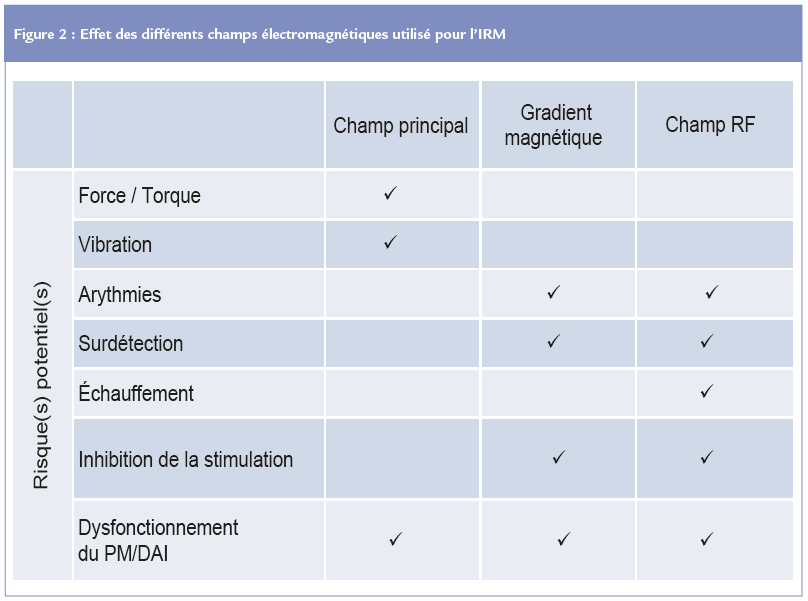
Les différents champs électromagnétiques utilisés en IRM
Lors d’un examen IRM, trois champs électromagnétiques puissants sont utilisés pour créer l’image et peuvent générer des interférences électromagnétiques.
Seuls ou combinés, ces champs sont susceptibles d’induire des effets potentiellement dangereux sur les patients et leurs dispositifs implantables.
CHAMP MAGNÉTIQUE STATIQUE (AIMANT PRINCIPAL)
L’aimant principal se caractérise par l’intensité du champ magnétique qu’il produit.
Actuellement le parc IRM en France est dominé par les IRM 1,5 teslas. Certains centres possèdent des IRM 3 teslas. Le champ statique peut être à l’origine de dysfonctionnements potentiellement graves. Ces effets restent toutefois théoriques car ils n’ont jamais été décrits jusqu’à présent avec les appareils récents de dernière génération, conventionnels ou compatibles.
Risque de déplacement mécanique du boitier
Le risque du champ magnétique statique concernant le déplacement mécanique du dispositif est théorique car le contenu ferromagnétique de ces appareils est si bas qu’ils n’a souvent aucune conséquence clinique. Au pire le patient présente des sensations de vibrations ou de brûlures thoraciques (7).
De même, les sondes ne sont pas affectées par les champs magnétiques statiques car elles n’ont pas de matériaux ferromagnétiques. Cela élimine la possibilité pour la sonde de se déplacer et ne pas capturer (8).
L’effet délétère du mode « sous-aimant » des PM et DAI sous l’effet du champ magnétique, lié au comportement des interrupteurs à lame souple « ILS » qui entraînent un fonctionnement en mode asynchrone de la stimulation (VOO ou DOO), est lui aussi théorique et extrêmement faible. (9)
Il pourrait intervenir éventuellement sur des cœurs fragilisés (insuffisance cardiaque, post infarctus).
R. Frank décrit 2 épisodes de fibrillation ventriculaire par phénomène R sur T, lors de 40 000 activations de l’ILS, sur un total de 8000 patients (une fois en phase aiguë d’un infarctus du myocarde, et l’autre sur une cardiomyopathie très évoluée). (10)
Cette interaction n’existe que pour les stimulateurs non IRM compatibles. Ces interrupteurs sont en effet désormais remplacés dans les nouvelles prothèses par des capteurs à effet Hall ou équivalents qui permettent de mieux contrôler le comportement du mode sous aimant.
La déprogrammation (“Reset”) en mode secours
Il s’agit d’un type spécifique de reprogrammation qui rétablit les réglages d’usine lorsque la tension de la batterie est inférieure à un niveau critique ou si des dommages des circuits sont détectés.
Les paramètres auxquels l’appareil revient, sont différents selon les fabricants. De nombreux appareils se réinitialisent en mode inhibition pour la stimulation avec réinitialisation des thérapies anti-tachycardiques si c’est un DAI.
Cela peut être problématique si un courant induit est détecté sous forme d’activité cardiaque intrinsèque rapide. Cela pourrait entraîner en effet, l’inhibition de la stimulation chez un patient stimulo-dépendant ou déclencher une thérapie par le DAI par détection d’une fausse tachycardie.
Les cas rapportés vont de 0% à 10,4% (11) et semblent essentiellement être associés à des dispositifs anciens, fabriqués avant 2002 et de marque Medtronic, même si un cas a été rapporté en 2009 avec un PMK Biotronik fabriqué en 2005, lors d’une IRM cérébrale à 3 teslas. (12)
Déplétion transitoire de la batterie du DAI et détérioration définitive du DAI.
Le mécanisme en est le même. (13)
Le noyau ferromagnétique du transformateur du circuit de charge devient saturé sous l’effet du champ magnétique statique et ne peut augmenter efficacement son flux vers le condensateur. La charge du condensateur est alors prolongée, ce qui entraîne une fausse alerte d’état de la batterie fin de vie (EOL).
L’appareil peut aussi tenter à plusieurs reprises de se charger et de délivrer un choc sans succès et ainsi vider sa batterie.
Parfois il y a surchauffe des composants du circuit et le DAI devient définitivement défectueux.
Aucune de ces complications n’a été décrite avec des dispositifs récents.
LES CHAMPS DE RADIOFRÉQUENCE
Les antennes de radiofréquence sont des éléments externes à l’aimant. Elles sont à l’origine du phénomène de résonance dont la mesure permet de déterminer la composante chimique des tissus explorés (sang, graisse …).
L’énergie haute fréquence est normalement dissipée dans tout le corps, mais du fait de la présence de la sonde, l’énergie va se concentrer sur l’interface sonde/ endocarde et sera convertie en chaleur.
Ces champs sont donc responsables d’un échauffement des tissus en bout de sonde comparable à celui d’une ablation par radiofréquence. Ce sont les tissus qui chauffent le bout de la sonde et non l’inverse.
Cet échauffement en bout de sonde est proportionnel au SAR (correspondant à l’énergie haute fréquence absorbée) et à la durée d’exposition à la RF. L’échauffement dépend aussi de nombreux facteurs notamment la longueur de la sonde (effet antenne), sa forme, sa proximité avec l’aimant, l’épaisseur de l’isolant, la géométrie du corps humain.
Ceci rend l’élévation de température difficile à prédire et explique les discordances entre les études in-vitro (14) et in-vivo (15) en partie par l’effet refroidissant protecteur du sang au niveau de l’interface sonde/tissus.
Les conséquences cliniques possibles via la brûlure locale du myocarde sont une augmentation du seuil de stimulation jusqu’à la perte de capture, et le déclenchement d’arythmies ventriculaires sur myocarde vulnérable (identiques à l‘effet de la RF endocavitaire).
Chez l’homme, les résultats des études cliniques sont contradictoires. Pour les plus anciennes, on note parfois une augmentation du seuil de stimulation (16) tandis que pour les plus récentes on ne note pas de modification significative de ces seuils. (17,18)
Les seuils de capture de stimulation avant et après l’imagerie qui subissent des modifications mineures reflètent vraisemblablement une lésion thermique minime (œdème régressif) induite par l’IRM. Cependant, ces changements de seuil sont rarement cliniquement significatifs, et sont généralement temporaires, ne nécessitant pas de reprogrammation du stimulateur.
Les champs de radiofréquence créent aussi des courants induits (directement ou rectifiés par les filtres) pouvant inhiber une stimulation cardiaque ou provoquer un choc inapproprié en présence d’un DAI.
Il existe aussi la possibilité théorique d’induire une tachycardie auriculaire ou ventriculaire par stimulation rapide au même cycle que celui de la radiofréquence ou à un multiple de ce cycle (effet d’antenne du stimulateur ramenant les courants induits de la RF vers les circuits de sortie du PM, démodulation du courant de RF par le circuit d’entrée). Il n’y a pas de description récente de ce phénomène au niveau ventriculaire.
BOBINES DE GRADIENTS
Ce sont des aimants situés à l’intérieur de l’aimant principal. Ils permettent de créer des gradients d’aimantation perpendiculaires qui serviront à localiser précisément le signal dans les trois plans de l’espace.
Les gradients de champs magnétiques sont aussi responsables de courants induits de faible amplitude. Si le seuil de stimulation est excellent, ces courants peuvent potentiellement être à l’origine
de stimulations intempestives, entraînant dans ce cas des tachycardies par stimulation rapide mais aussi des inhibitions de la stimulation ou de fausses reconnaissances de tachycardie par le DAI.
Dans la vraie vie, des risques finalement non retrouvés et souvent exagérés ?
Même si historiquement l’IRM était une contre-indication chez les porteurs de PMK, sur des données issues d‘un registre allemand, les premières études sur des dispositifs non IRM compatibles avec un plus grand nombre de patients, ont été plutôt rassurantes en montrant qu’aucun décès n’était rapporté chez des patients bien sélectionnés et monitorés.
Les patients décédés dans ce registre allemand (6 décès sur une période de 9 ans) l’ont été dans un contexte d’absence de monitorage pendant l’examen et hors surveillance cardiologique avant l’examen.
Très récemment, les résultats du registre MagnaSafe ont été publiés. (17) L’objectif était de définir le risque dans la vraie vie, d’un examen IRM à 1,5 Teslas chez des patients porteurs de pacemakers ou de DAI non IRM compatible.
Ce registre incluait 1500 patients (1000 PM et 500 DAI).
Les critères d’inclusion étaient des appareils implantés après 2001, de toutes marques et une IRM hors thorax. Les critères d’exclusion étaient la présence de sondes abandonnées ou épicardiques, les patients porteurs d’un DAI et stimulo-dépendants, les appareils implantés en région abdominale et à l’ERI.
Les résultats ont montré qu’aucun décès n’est survenu ainsi qu’aucune dysfonction de sondes ou arythmie ventriculaire. Une fibrillation auriculaire est survenue chez 4 patients et un flutter chez 2 patients, au cours ou immédiatement après l’IRM. Cinq de ces patients avaient des antécédents de fibrillation auriculaire. Six PM sont passés en mode secours temporaire sans incidence clinique. Un défibrillateur a dû être remplacé immédiatement en raison d’une erreur de réglage (thérapies sur ON en pré IRM). Celui-ci n’était finalement pas endommagé lors de l’expertise du boîtier.
Nazarian et al (18) ont publié une autre grande étude prospective, non randomisée sur 1509 patients porteurs de dispositifs cardiaques non-IRM compatibles (stimulateurs 58 %, DAI 42 %), qui confirme la sécurité de l’IRM 1,5 teslas y compris de la région thoracique mais aussi chez 137 patients stimulo-dépendants dont 22 étaient porteurs d’un DAI.
Aucun décès, dysfonction de sondes, perte de stimulation ou arythmie ventriculaire n’a été rapporté durant les examens d’IRM. Neuf cas de déprogrammation en mode secours ont été rapportés (0,4 %) dont 8 transitoires. Quelques variations de seuils de stimulation, de détection et d’impédance ont été notés, mais sans conséquence clinique au long terme pour les patients.
Ce que l’on retient de ces deux grandes études, outre l’absence de complication majeure, sont les règles de bonne pratique communes : des patients correctement sélectionnés, une organisation bien définie du circuit des patients, des référents bien identifiés, une coopération tripartite entre prescripteur, rythmologue et radiologue, indispensable pour mieux cerner les indications et limiter les risques et des procédures bien codifiées avant, pendant et après l’examen avec des patients.
Devenir des patients habituellement exclus des protocoles ?
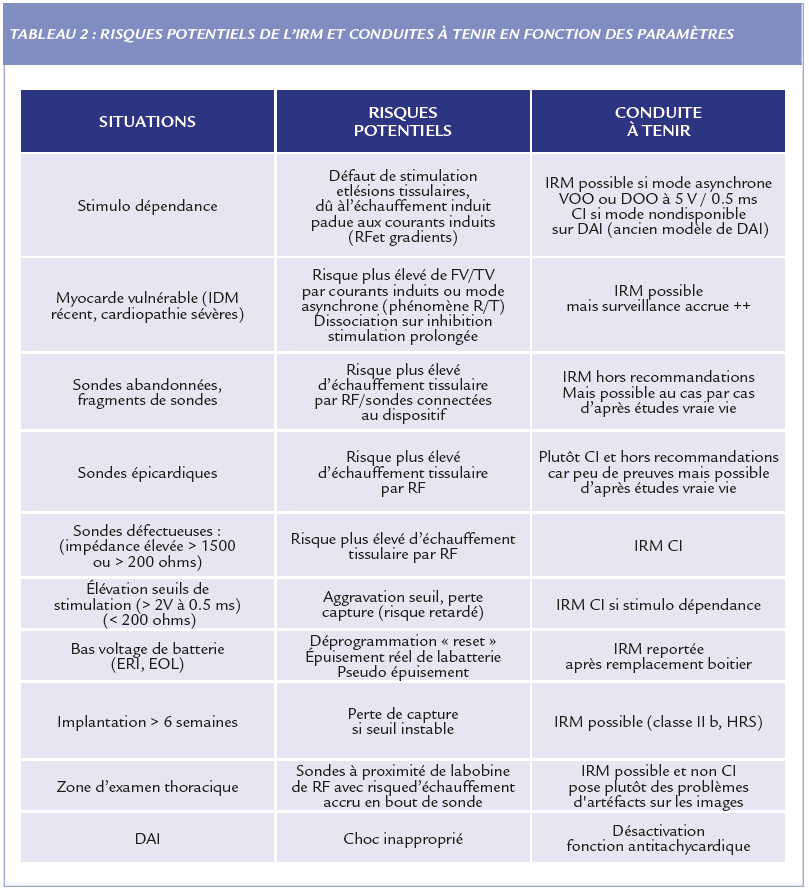
Les systèmes conventionnels ont donc fait l’objet d’une large expérience pratique avec peu d’incidents mais qu’en est-il des patients habituellement exclus des protocoles ?
IMPLANTATION RÉCENTES < 6 SEMAINES
Le but d’une période d’attente après l’implantation est de permettre d’obtenir des seuils de stimulation stable et d’éviter les pertes de capture en cas d’échauffement de l’extrémité de la sonde et de mauvais seuil.
Friedman et al (19) ont comparé de manière prospective les résultats de huit examens après implantation précoce (7–36 jours) contre 211 examens en période chronique (moyenne de 1150 jours). Ils n’ont observé aucune complication majeure ou augmentation de la troponine, ni aucune différence dans les paramètres de la sonde au cours du suivi.
Des résultats comparables ont été observés chez les 80 patients nouvellement implantés du registre MagnaSafe. Ces résultats sont rassurants pour les patients qui nécessitent une IRM urgente après implantation d’un dispositif.
SONDES ÉPICARDIQUES OU ABANDONNÉES
Les sondes épicardiques et abandonnées sont traditionnellement exclues des études en raison d’un possible échauffement imprévisible.
Higgins et al (20) ont réalisé 35 examens chez des patients présentant des sondes abandonnées (IRM cérébrale ou rachidienne).
Ils n’ont observé aucun symptôme, ni arythmie chez ces patients. Chez 10 des patients qui ont eu leur générateur reconnecté pour raison clinique, la plus forte augmentation du seuil de capture a été de 0,7 V.
Les auteurs ont conclu qu’il n’y avait pas d’effet significatif de l’IRM sur les sondes abandonnées.
Plus récemment une étude 21 a inclus 90 sondes abandonnées dont 18 sondes de DAI, 9 sondes de stimulation du ventricule gauche et 9 sondes épicardiques correspondant à 8,4 % des patients passant à l‘IRM.
Aucune élévation de la troponine ou autre complication n‘est survenue.
Malgré ces observations indiquant un risque limité, la plupart des études excluent encore les patients avec des sondes abandonnées.
L’expérience et la littérature concernant les sondes épicardiques mises par voie chirurgicale sont plus limitées. Il est impossible de déterminer leur sécurité.
Les sondes épicardiques postchirurgicales temporaires ne sont pas considérées comme abandonnées et ne sont donc pas des contre-indications à l’IRM.
EXAMENS IRM EN SÉRIE
Des effets mineurs cumulatifs pourraient-ils devenir cliniquement significatifs en cas de réalisation de plusieurs IRM chez un même patient ?
Naehle et al (22) ont réalisé une revue rétrospective de 47 patients avec PM ayant eu au moins deux examens (y compris des IRM thoraciques) à 1,5 T. L’étude incluait trois patients ayant subi plus de 10 examens.
Ils constatent que les modifications de seuils de capture, d’impédance et de modification de la tension de la batterie n’étaient pas cliniquement significatifs même après 10 fois plus d’examens.
De même des IRM cardiaques à répétition chez les patients porteurs d’un DAI (23) n’ont créé aucun changement significatif des paramètres des sondes.
STIMULO DÉPENDANCE
Il y a assez de preuves actuellement pour ne plus contre indiquer un patient stimulo dépendant. La dépendance au pacemaker entraîne un risque potentiel plus élevé lors d’une IRM en raison d’une inhibition possible et inappropriée de l’activité du stimulateur cardiaque entraînant une asystolie.
En 2019, un réglage en mode asynchrone et une surveillance appropriée pendant l’IRM permet de s’affranchir de ce problème car comme dit précédemment, aucune déprogrammation en mode
secours qui pourrait faire revenir le stimulateur en mode inhibé n‘a été décrite depuis 2005.
IRM THORACIQUE ET CARDIAQUE
La réticence à la réalisation d’une IRM cardiaque chez un porteur de dispositif PM ou DAI était sous tendue par le fait que l’excès d’énergie à proximité de la prothèse pourrait entraîner des complications plus sévères.
Là aussi, la plupart des études incluant des IRM thoracique et cardiaque ont eu un profil de sécurité équivalent à celui d’une IRM extra thoracique. (24)
Prothèses IRM compatibles
Les prothèses IRM compatibles ont été conçues pour limiter les risques potentiels des champs magnétiques et de la radiofréquence sur le matériel et le patient.
Des modifications ont été apportées aux dispositifs pour les rendre compatibles avec une diminution du nombre de composants ferromagnétiques permettant d’atténuer la sensibilité aux champs magnétiques, une protection des circuits internes d’alimentation et du hardware pour éviter le passage en mode secours, l’introduction de résistances pour filtrer l’énergie transmise par la sonde et des capteurs à effet Hall ou équivalents pour contrôler le comportement du mode aimant.
Enfin des modifications de logiciel ont été apportées. Les nouveaux logiciels facilitent la programmation manuelle en mode IRM et, dans certains cas, changent automatiquement pour un mode IRM lorsque le champ magnétique est détecté.
Des modifications ont aussi été apportées aux sondes en particulier des modifications de leur géométrie pour prévenir les interactions avec les champs de radiofréquence et réduire l’échauffement de l’extrémité de la sonde (augmentation du nombre de spires du conducteur interne, isolant à moindre polarisation, diminution du pas de bobinage (pitch), filtre en bout de sonde).
Le dispositif est compatible avec un environnement IRM, en respectant certaines conditions. Les unes sont communes à tous les appareils (c’est le système sonde/boitier du même fabriquant qui est compatible, un panachage le rend non compatible) et d’autres propres à chaque fabricant (puissance de l’aimant, zone à scanner, SAR, vitesse de balayage du champ de gradient, temps d’imagerie).
C’est cette spécificité ou ces variantes, qui évoluent en permanence avec des autorisations corps entier ou non, 1,5T ou 3T, des validations étendues ou des rétro validations de matériels anciens, qui peuvent actuellement compliquer la prise en charge.
Il est difficile de donner une liste exhaustive de tous ces appareils récents car cela évolue en permanence. Un site référençant les pacemakers et défibrillateurs implantables IRM compatibles, alimenté et mis à jour par les constructeurs est désormais accessible : irm-compatibilite.com
Le premier PM IRM compatible a été implanté en France en juin 2010 et le premier système testé cliniquement a été le système Medtronic SureScan constitué du boitier EnRhythm couplé avec les sondes CapSureFix 5086. Dans un essai prospectif randomisé et contrôlé de 464 patients, Wilkoff et al. (25) n’ont révélé aucune complication ou effet délétère dans le groupe subissant une IRM. Cette tendance a été confirmée avec d’autres PM et DAI compatibles testés sous résonance magnétique 2. Sur 872 examens IRM réalisés avec un PM Medtronic, aucune complication grave n’a été révélée. Six événements en rapport avec l’IRM sont survenus (2 cas de fibrillation auriculaire, 2 cas avec symptômes de brûlure thoracique, un cas avec une perte de capture à 48 h de l’examen chez un patient non dépendant qui avait un seuil de stimulation élevée avant l’examen (> 1.5 V), un cas avec une augmentation transitoire du seuil de stimulation auriculaire de 1 à 2.5 V régressant en une semaine).
LIMITES DES DISPOSITIFS COMPATIBLES
Un des problèmes des dispositifs compatibles est parfois l’identification du dispositif compatible complet (boitier plus sondes). On rappelle que c’est le système PMK/DAI/sondes qui est compatible (certains patients sont équipés de système compatible mais associant des marques différentes).
Chaque constructeur a ses conditions : sondes et réglages IRM dédiés (zone d’intérêt/Tesla/SAR/gradients) qui complexifient la prise en charge. Si ces conditions ne sont pas respectées les patients redeviennent IRM non compatibles.
Enfin rappelons que l’organisation du circuit patient reste inchangée par rapport au matériel non compatible.
Celle-ci pourrait cependant être améliorée par la reconnaissance automatique du champ magnétique. Actuellement seul deux fabricants le proposent, Biotronik qui laisse un délai de 15 jours pour la réalisation de l’IRM, une fois activé le mode IRM automatique avec retour à la programmation initiale une fois quitté le champ magnétique. Pour les PMK Microport/Sorin les patients ont un délai de 48 heures pour passer l’IRM.
Les recommandations
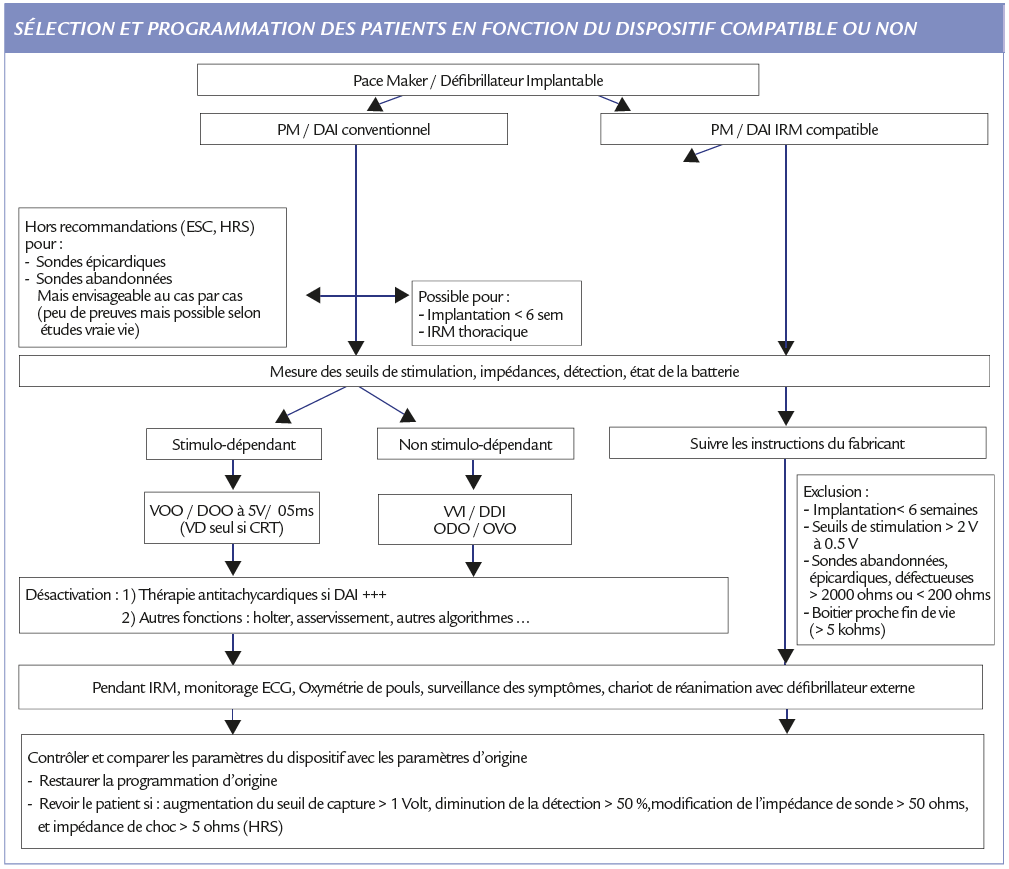
Différentes sociétés savantes ont publié des recommandations pour certaines assez récentes et précises et pour d’autres déjà plus anciennes comme celles de la société européenne de cardiologie (ESC) (26) datant de 2013. Les recommandations ESC autorisent les patients porteurs de prothèses conventionnelles à passer un examen IRM en suivant le protocole de l’équipe de Baltimore (Nazarian) (classe II b).
Elles donnent ainsi quelques suggestions de sélection, de programmation et surveillance quand l’IRM est nécessaire :
✓ Importance du monitoring par du personnel qualifié
✓ Exclusion des patients avec des sondes trop récentes (< 6 sem après implantation), et des sondes épicardiques ou abandonnées
✓ Programmation en mode de stimulation asynchrone pour les patients stimulo-dépendants,
✓ Programmation en mode inhibé pour les patients non stimulo-dépendants
✓ Désactivation des thérapies anti-tachycardiques (ATP/chocs) pour éviter les thérapies inappropriées
✓ Désactivation des autres fonctions (holter, mode aimant, bruit, détection des ESV, réponse à la FA …)
Publiées en 2017 et de façon intéressante, les recommandations allemandes (27) mettent en avant les situations les plus à risque pour lesquelles la présence d’un cardiologue pendant l’examen est recommandée, notamment en cas de stimulo dépendance, de présence d’un DAI ou lors de la réalisation d’une IRM cardiaque, ce qui n’est pas le cas dans d’autres pays européens et notamment en France.
Les recommandations de la Heart Rhythm Society (HRS) sont le dernier document de référence mis à jour disponible. (28)
Les experts insistent surtout sur la nécessité d’un protocole institutionnel standardisé, définissant les responsabilités et disponibilités de chacun et la coopération cardiologue/radiologue.
Il recommande d’utiliser une checklist d’éléments à ne pas oublier afin de minimiser les risques de complications et d’améliorer la sécurité des patients.
Pour les appareils compatibles, les conditions d’examen sont liées aux exigences des fabricants (classe I). Pour les non compatibles, elle se réfère aux protocoles des grands registres déjà décrits. (Classe II a).
Les recommandations contre indiquent toujours la réalisation de l’IRM s’il y a des sondes fracturées, épicardiques ou abandonnées même si des données récentes probantes provenant de registres ou d’études mono-centriques récents montre l’absence de complication. (21)
Les dispositifs récemment implantés sont considérés comme une indication possible si l’IRM est cliniquement justifiée (classe II).
Les autres prothèses
Le holter Implantable ( Reveal-Medtronic ou Confirm- St Jude Médical ) est classé dans la catégorie IRM compatible et ne nécessite pas d’être programmé sur un mode spécifique avant l’IRM.
Le défibrillateur implantable sous cutané est lui aussi IRM compatible. Il n’y a pas d’échauffement du myocarde car il n’y a pas de sonde et une programmation OOO permet d’éviter des détections inappropriées.
Enfin les PM sans sonde sont eux aussi compatibles avec l’IRM. Il s’agit de nouveaux dispositifs qui contiennent la totalité du système de stimulation dans un petit boîtier se trouvant dans le ventricule droit. Les données précliniques ont démontré moins d’échauffement du dispositif par rapport à un stimulateur cardiaque normal.
Une série de 15 patients avec le système Micra (Medtronic) n’a révélé aucun événement indésirable. (29)
Conclusion
Les dispositifs non compatibles ont fait l’objet d’une large expérience pratique avec peu d’incidents. L’IRM est donc possible avec très peu de contre-indications si l’organisation et le protocole de l’examen sont bien codifiés.
Même ces contre-indications pourront se discuter au cas par cas (sondes abandonnées, épicardiques). Les examens sont de toute façon réalisés hors cadre réglementaire et engagent la responsabilité des radiologues et des cardiologues.
Les dispositifs compatibles apportent ce cadre réglementaire avec une couverture médico-légale si les conditions d’utilisation des dispositifs, dictées par les fabricants, sont rigoureusement respectées ce qui n’est pas toujours si simple en pratique du fait des disparités de ces conditions entre les fabricants.
Ces dispositifs sont supérieurs aux dispositifs conventionnels car ils apportent l’assurance de matériels testés et adaptés pour atténuer les effets de l’IRM en particulier pour la réalisation d’IRM 3 teslas, d’IRM thoracique ou si le dispositif est un DAI ou une prothèse multisite. Ils disposent d’un mode IRM facile à activer. Tous les éléments de conception ou algorithmes de programmation simples comme la reconnaissance automatique du champ magnétique sont aussi les bienvenus car il vise à simplifier la procédure et permettent de ce fait d’améliorer l’accès des patients à l’IRM.
En 2019, récuser “systématiquement” un examen d’IRM chez un patient porteur d’un PM ou un DAI ne semble plus possible car c’est une perte de chance pour le patient.
Cependant, que le dispositif soit compatible ou non, l’IRM ne doit pas être banalisée car elle peut comporter des risques.
L’IRM compatibilité ne rend pas les appareils totalement insensibles aux champs magnétiques mais en atténue les effets. La procédure doit être bien codifiée si les prothèses sont non compatibles mais aussi si compatibles car elles le sont sous conditions. Le mieux est la mise en place d’un circuit patient, institutionnel si possible bien codifié et écrit avec une collaboration étroite entre le prescripteur, le cardiologue et le radiologue.
Franck Raczka
Service de cardiologie interventionnelle, clinique du Millénaire, Montpellier
RÉFÉRENCES
1. Kalin R et al. Current clinical issues for MRI scanning of pacemaker and defi brillator patients. PACE 2005;28:326–8
2. Williamson BD et al . Real-World Evaluation of Magnetic Resonance Imaging in Patients With a MagneticResonance Imaging Conditional Pacemaker System: Results of 4-Year Prospective Follow-Up in 2,629 Patients. Jacc Clin Electrophysiol. 2017;3:1231–9
3. Nazarian S et al Utilization and likelihood of radiologic diagnostic imaging in patients with implantable cardiac defi brillators. J Magn Reson Imaging 2016;43:115–27
4. Turakhia M. Medtronic data on fi le 2013. Data from MarketScan and Medicare database, Truven analysis. Patient cohort represent ICD patients in terms of age, gender and major comorbidities ( n= 10,778) Celentano E et al. Access to magnetic resonance imaging of patients with magnetic resonance-conditional pacemaker and implantable cardioverter-defi brillator systems: results from the Really ProMRI study. Europace. 2018;20:1001–9.
6. Huma Samar et al .Diagnostic Value of MRI in Patients With Implanted Pacemakers and Implantable Cardioverter-Defi brillators Across a Cross Population Does the Benefi t Justify the Risk? A Proof of Concept Study J Am Coll Cardiol EP 2017; 3: 991–1002
7. Luechinger R et al. Force and torque effects of a 1.5-Tesla MRI scanner on cardiac pacemakers and ICDs. Pacing Clin Electrophysiol 2001;24(2):199–205.
8. Irnich W et al. Risks to pacemaker patients undergoing magnetic résonance imaging examinations. Europace 2010;12(7):918–920)
9. Jeff S. Healey, MD et al Canadian Cardiovascular Society/Canadian Anesthesiologists’ Society/Canadian Heart Rhythm Society joint position statement on the perioperative management of patients with implanted pacemakers, defibrillators, and neurostimulating devices
10. Frank R, Hidden-Lucet F, Himbert C, Petitot JC, Fontaine G. Cardiac. Pacemakers, implantable defi brillators and IRM. Arch Mal Coeur Vaiss. 2003;96(Spec No 3):46–9.
11. Higgins JV et al. “Power-on resets” in cardiac implantable electronic devices during magnetic resonance imaging. HeartRhythm 2015;12(3):540–544.
12. Gimbel JR. Et al Unexpected asystole during 3T magnetic resonance Imaging of a pacemaker-dependent patient with a ‘modern’ pacemaker. Europace 2009;11(9):1241–1242
13. S. Maffè et al. / International Journal of Cardiology 156 (2012) e36–e39
14. Achenbach S et al ,Effects of magnetic resonance imaging on cardiac pacemakers and electrodes. Am Heart J 1997;134(3):467–473.
15. Luechinger R et al. In vivo heating of pacemaker leads during magnetic resonance imaging. Eur Heart J 2005;26(4):376–383
16. Sommer T et al. Strategy for safe performance of extrathoracic magnetic resonance imaging at 1.5 tesla in the presence of cardiac pacemakers in non-pacemaker-dependent patients: a prospective study with115 examinations. Circulation 2006;114(12):1285–1292.)
17. Russo RJ et al. Assessing the risks associated with MRI in patients with a pacemaker or defi brillator. N Engl J Med 2017;376(8):755–764
18. Nazarian S et al. Safety of magnetic resonance imaging in patients with cardiac devices. N Engl J Med 2017;377(26):2555–2564
19. Friedman HL et al. Magnetic resonance imaging in patients with recently implanted pacemakers. Pacing Clin Electrophysiol 2013;36(9):1090–1095.
20. Higgins JV et al. Safety and outcomes of magnetic, resonance imaging in patients with abandoned pacemaker and defi brillator leads. Pacing Clin Electrophysiol 2014;37(10):1284–1290
21. Deepak Padmanabhan et al Safety of magnetic resonance imaging in patients with legacy pacemakers and defibrillators and abandoned Leads , Heart Rhythm 2018;15:228–233
22. Naehle CP et al. Magnetic resonance imaging at 1.5-T in patients with implantable cardioverter-defi brillators. J Am Coll Cardiol 2009;54(6):549–555.)
23. Junttila MJ et al. Safety of serial MRI in patients with implantable cardioverter defi brillators. Heart 2011;97(22):1852–1856.
24. Buendía F et al. Cardiac magnetic résonance imaging at 1.5 T in patients with cardiac rhythm devices. Europace 2011;13(4):533–538.
25. Wilkoff BL et al. Magnetic resonance imaging in patients with a pacemaker system designed for the magnetic résonance environment. Heart Rhythm 2011;8(1):65–73 )
26. Brignole M et al (2013) 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 34:2281–2329
27. Sommer T et al (2017) MR imaging in patients with cardiac pacemakers and implantable cardioverter defi brillators. Rofo 189:204–217
28. Indik JH et al (2017) 2017 HRS expert consensus statement on magnetic resonance imaging and radiation exposure in patients with cardiovascular implantable electronic devices. Heart Rhythm 14:e97–e153
29. Soejima K,et al. Safety evaluation of a leadless transcatheter pacemaker for magnetic resonance imaging use. Heart Rhythm 2016;13(10):2056–2063.).
