Les connexions coronaires anormales (CCA) sont les anomalies coronaires congénitales les plus fréquentes (ANOCOR). Depuis des décennies, les CCA intriguent les cardiologues en raison du risque de mort subite (MS) cardiaque. Contrairement à certaines cardiopathies congénitales à risque de MS, très peu de travaux expérimentaux et de rares études à large échelle ont été consacrées aux CCA. Aussi, les recommandations actuelles reposent essentiellement sur des avis d’experts.
Cette mise au point se propose de fournir des informations sur les quelques avancées observées ces dernières années, mais aussi de rappeler les nombreuses interrogations. Seules seront abordées les CCA diagnostiquées chez l’adolescent et l’adulte, et non associées à une pathologie des troncs artériels.
Développement coronaire et génétique
Il n’existe pas de continuum embryologique coronaire entre l’aorte et les vaisseaux coronaires (1). Les artères coronaires se connectent à l’aorte assez tardivement lors de la vasculogénèse coronaire, avec un réseau coronaire épicardique en partie déjà développé. Les connexions coronaires surviennent après la septation conotroncale (formation de l’artère pulmonaire et de l’aorte), élément important pour comprendre certains trajets ectopiques. Si la coronaire droite en développement est proche du sinus aortique approprié, la coronaire gauche doit contourner l’artère pulmonaire pour rejoindre le sinus aortique approprié. Une zone myocardique péripulmonaire répulsive éviterait une connexion
pulmonaire ectopique.
Les CCA associées aux cardiopathies du tronc artériel assurent une vascularisation myocardique adéquate car une artère coronaire ectopique va toujours rejoindre son territoire myocardique dédié. Par contre, la cause d’une CCA en l’absence de pathologie troncale reste inconnue. Aucun génotype n’a été identifié et un caractère héréditaire est peu vraisemblable (rarissimes familles avec une prévalence élevée de CCA).
Classification
Les CCA regroupent de nombreux types anatomiques (2). La grande majorité concerne une connexion dans l’artère controlatérale ou le sinus controlatéral, beaucoup plus rarement dans l’aorte tubulaire ou le sinus non coronaire. Les connexions ectopiques dans l’artère pulmonaire sont exceptionnelles.
La gravité potentielle d’une CCA dépend du trajet initial ectopique en fonction des troncs artériels.
Les trajets prépulmonaires et rétroaortiques sont facilement reconnaissables.
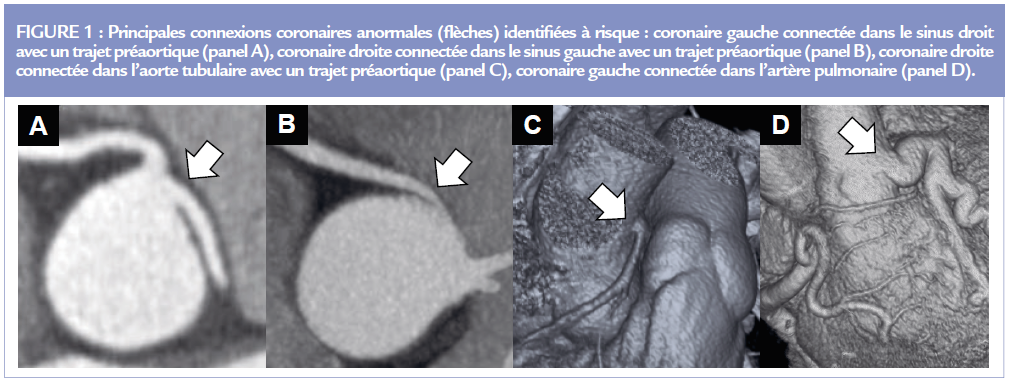
Les trajets préaortiques, appelés aussi interartériels, et rétropulmonaires restent parfois une source de confusion dans la littérature et dans la pratique. Une erreur diagnostique peut avoir des conséquences importantes (non reconnaissance ou diagnostic à tort d’une forme à risque). Malgré une imagerie multimodale, des erreurs de classification ne sont pas rares (3). Il peut exister un phénotype anatomique dominant selon les artères coronaires. Le trajet est quasi exclusivement rétroaortique pour l’artère circonflexe (Cx) et très majoritairement préaortique pour l’artère coronaire droite. Alors que pour le tronc commun et l’artère interventriculaire antérieure (IVA), les quatre trajets précédemment décrits sont possibles, en sachant que le trajet préaortique est le plus rare.
Définition des formes à risque
Les CAA pouvant être associées aux situations suivantes sont classées à risque : angor ou équivalent, lipothymie, syncope, insuffisance cardiaque, ischémie myocardique documentée, tachycardie ou fibrillation ventriculaire, arrêt cardiaque récupéré, et mort subite.
Jusqu’à présent seules les CCA avec un trajet préaortique, appelé aussi interartériel, et celles avec une connexion pulmonaire sont reconnues à risque (4) (Figure 1). Si toutes les CCA avec un trajet prépulmonaire ou rétroaortique peuvent être classées sans risque, le caractère bénin de certaines CCA avec un trajet rétropulmonaire est parfois discuté. Cette identification doit être rigoureuse en faisant appel si besoin à un centre expert.
Prévalence
La prévalence angiographique des CCA (à risque et non à risque) est proche de 0.5 % avec la coronarographie et de 1% avec le scanner coronaire (2). L’artère Cx est la plus concernée (50% des cas) versus 30% pour la coronaire droite et 20% pour le tronc commun ou l’artère IVA.
Une revue de 100.000 scanners coronaires a rapporté une prévalence de CCA avec trajet préaortique de 0.03 % pour la coronaire gauche et 0.32% pour la coronaire droite (5). Chez près de 5.000 adolescents candidats à une pratique sportive, une imagerie par résonance magnétique a identifié (2) CCA gauches et 17 CCA droites à risque, soit une prévalence respective de 0.04 et 0.32 %6. Ainsi la fréquence des CCA à risque serait de 0.3% à la naissance avec un ratio initial CCA droites/CCA gauches proche de 10. La prévalence des CCA droites est donc plus élevée (3/1000) que celle de la cardiomyopathie hypertrophique (2/1000), alors que la prévalence des CCA gauches (0.4/1000) est proche de celle de la dysplasie arythmogène ventriculaire droite, deux cardiopathies structurelles à risque de MS.
Imagerie
L’imagerie cardiaque est primordiale pour la classification et la prise en charge des CCA. Mode diagnostique fréquent chez l’adulte, la coronarographie n’est plus considérée comme le gold standard pour classer une ANOCOR. Le scanner coronaire est devenu l’examen de référence lorsqu’une forme à risque est suspectée ou qu’un trajet initial ectopique est incertain. Le scanner est particulièrement utile pour distinguer deux trajets : le trajet préaortique et le trajet rétropulmonaire (Figure 2).
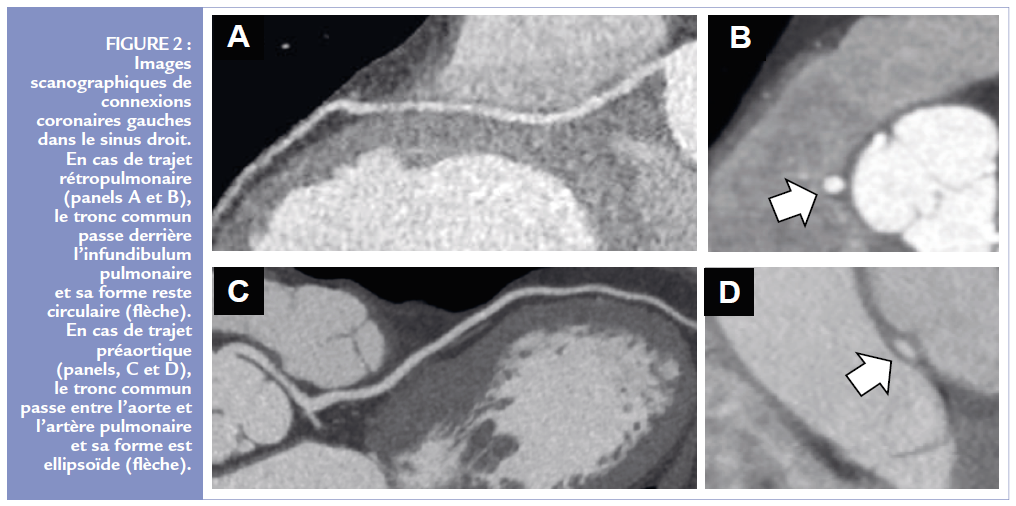
Le scanner peut analyser la forme de l’ostium et une éventuelle déformation du trajet ectopique initial. Une forme en fente (petit axe <50% du grand axe) et une réduction de calibre >50% évoquent un passage intramural aortique.
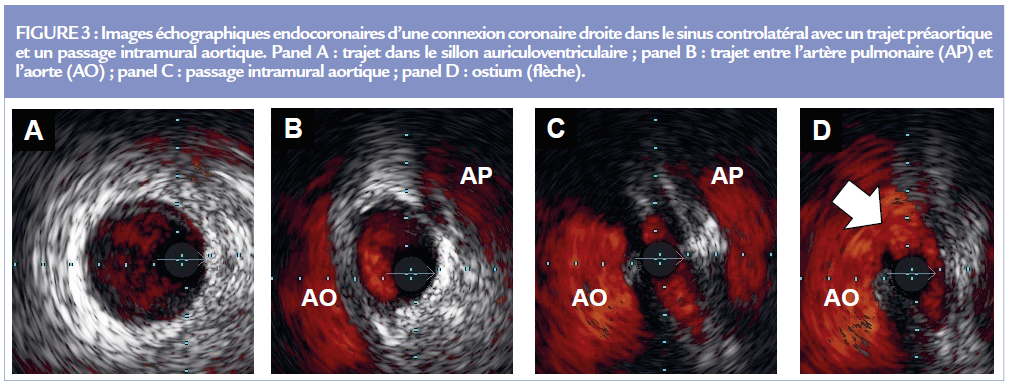
En visualisant les parois aortique et coronaire, l’échographie endocoronaire est le meilleur outil actuel pour infirmer ou confirmer ce dernier 7. Cette imagerie aide à la compréhension d’une déformation artérielle. En cas de trajet préaortique, la coronaire ectopique doit s’adapter à un espace interartériel restreint, avec une forme ovalaire lorsque l’artère est au contact de l’aorte.
En cas de passage intramural, l’ostium a une forme en fente avec un grand axe > au grand axe de référence et un petit axe 2.0 mm (Figure 3).
La réduction de surface peut varier entre 20 et 70%. L’échocardiographie et l’imagerie par résonance magnétique se prêtent mal à l’analyse des CCA chez l’adulte.
Circonstances de découverte
Tous les symptômes cardiaques peuvent être concernés et plus particulièrement s’ils sont liés à un effort physique sportif chez l’adolescent et l’adulte jeune. La MS peut être le mode de révélation d’une CCA, mais reste rare dans une population adulte, moins de 5% des cas dans la cohorte ANOCOR de près de 500 patients (8). Après l’âge de 50 ans, une symptomatologie ischémique est possible. Un syndrome coronarien aigu avec sus-décalage ST est exceptionnel. Une découverte fortuite est fréquente en raison de la prévalence des CCA.
Ischémie myocardique
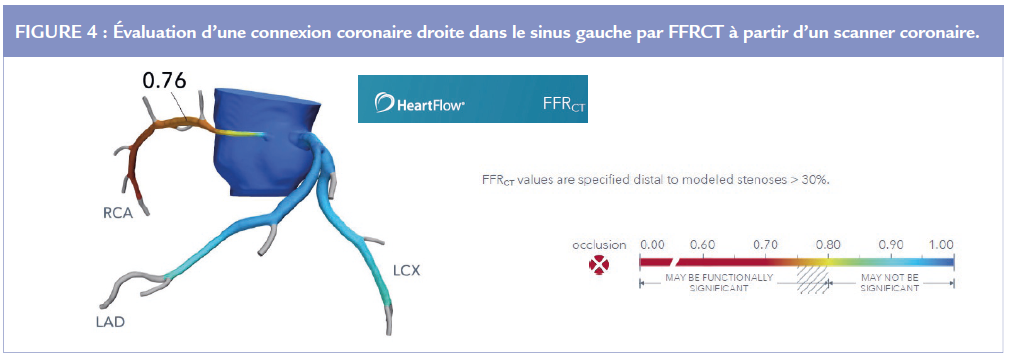
La difficulté d’induire une ischémie myocardique est bien connue, même en cas de CCA à risque et symptomatique. La réduction de surface artérielle généralement <70% peut expliquer les résultats des tests fonctionnels habituels. L’évaluation physiologique invasive reste limitée avec une valeur de Fractional Flow Reserve (FFR) rarement < 0.80, et avec une incertitude sur la valeur-seuil. La mesure de la FFR à partir du scanner est en cours d’évaluation (Figure 4). L’interprétation d’une ischémie myocardique doit tenir compte d’une éventuelle maladie coronaire associée.
Une prévalence élevée d’athérome est suggérée au niveau des trajets rétroaortiques, en particulier pour l’artère Cx, alors qu’un trajet préaortique avec passage intramural semble être protégé du risque d’athérome.
Troubles du rythme ventriculaire et mort subite
La chaîne de réanimation permet désormais de récupérer certains arrêts cardiaques et de préciser la cause de la MS. Il s’agit d’une fibrillation ventriculaire dont les mécanismes restent mal élucidés (9). L’ischémie myocardique est forcément suspectée comme un substrat potentiel. L’hypothèse de changements morphologiques de l’ostium lors d’un effort physique intense est souvent évoquée mais n’a jamais été prouvée. Un spasme coronaire ou une thrombose coronaire n’ont jamais été documentés au décours d’un arrêt cardiaque récupéré. Une ischémie myocardique aiguë ou une séquelle d’infarctus transmural sont généralement absentes. Bien qu’il s’agisse d’un arrêt cardiaque rythmique, les CCA sont rarement explorées sur le plan rythmologique.
Évaluation des risques
Le risque de MS est bien entendu le plus important à considérer. Une CCA identifiée à risque signifie que le patient concerné est exposé au risque de MS, mais sa probabilité de survenue est très faible en valeur absolue. Des estimations de l’incidence annuelle de MS sont de l’ordre de 0.1 % pour les CCA gauches et de 0.005 % pour les CCA droites. Ces estimations ont été faites à partir de populations sélectionnées (adolescents et jeunes adultes), exposées au risque de MS sur une vingtaine d’années lors d’une pratique sportive intensive (10). Ces incidences sont particulièrement faibles par rapport aux autres cardiopathies congénitales incriminées dans la MS.
Comme la majorité des CCA à risque ne provoquera pas de MS, il est primordial d’identifier des facteurs ou des marqueurs de risque accru. À ce jour, seuls une CCA gauche, un jeune âge et une pratique sportive intensive ont été identifiés (9). Une symptomatologie d’effort (surtout lipothymie ou syncope), et bien entendu un arrêt cardiaque récupéré doivent être pris en considération. Le sur-risque des CCA gauches est mal expliqué. La plupart des MS se produisent entre 10 et 30 ans, bien que des cas aient été décrits chez des individus plus âgés (2).
Les CCA sont une des causes les plus fréquentes de MS chez l’athlète, et celles où le lien avec l’effort physique est le plus net (11). Les MS rapportées concernent surtout les sports de haute intensité (basket-ball, course à pied, cyclisme, football). Des performances sportives de haut niveau ne sont pas incompatibles avec une CCA à risque. Chez les sportifs de plus de 35 ans, une CCA est très rarement la cause d’une MS. A ce jour, il n’a pas été identifié clairement de marqueurs anatomiques de sur-risque pour les CCA droites.
Recommandations et management
Les recommandations actuellement existantes sont nord-américaines et elles ne sont pas adossées à des études contrôlées randomisées (4). Curieusement l’âge intervient peu dans la décision. Les symptômes dits ischémiques sont ceux associés à une ischémie myocardique documentée ou à une arythmie ventriculaire. Les recommandations sur l’activité sportive sont celles de l’AHA/ACC sur la qualification des athlètes ayant une cardiopathie congénitale (12). Il n’existe pas, à ce jour, de recommandations européennes.
Le management est parfois difficile chez l’adulte pour les CCA à risque (13). Les pratiques sont assez hétérogènes, expliquées par des connaissances encore limitées sur l’histoire naturelle ou corrigée des CCA. Le rapport bénéfices/risques de la chirurgie n’a pas encore été clairement évalué pour toutes les CCA. En cas d’arrêt cardiaque récupéré ou de CCA gauche symptomatique, une correction est indiquée. En prévention primaire, nous ne disposons pas d’un score stratifiant le risque individuel de MS. Une même forme anatomique peut être responsable d’une MS précoce ou être parfaitement tolérée jusqu’à un âge avancé. Chez le jeune adulte (30 ans) généralement peu symptomatique, l’objectif thérapeutique est la prévention de la MS, alors que dans une population plus âgée, c’est la correction d’une symptomatologie ischémique.
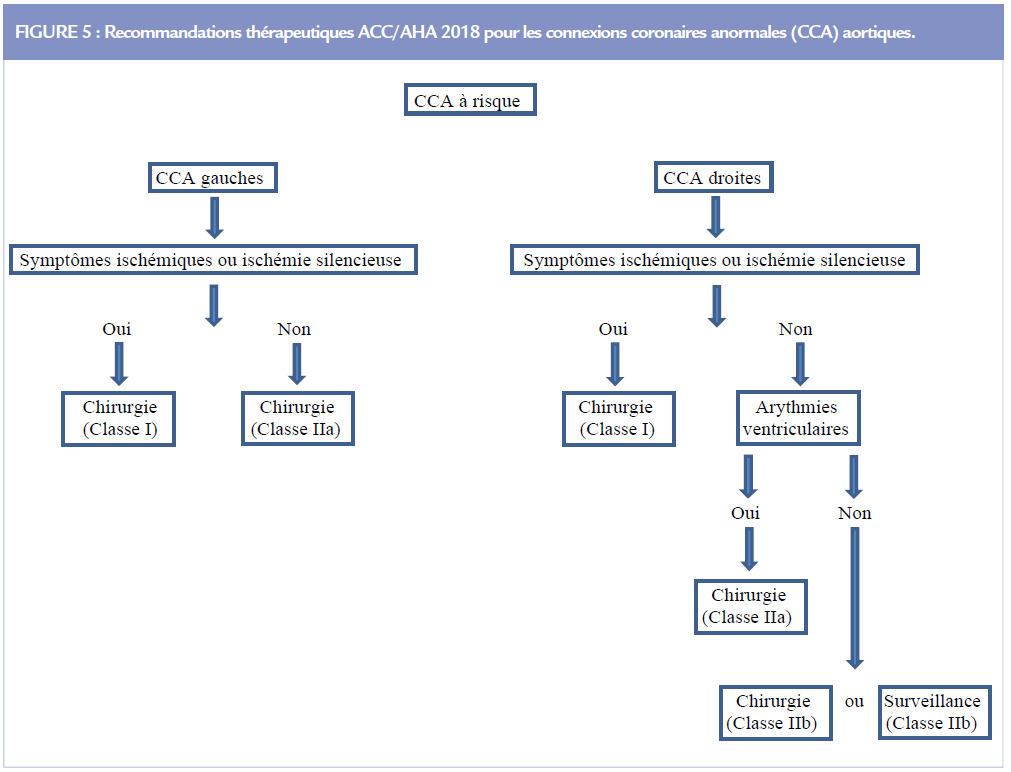
On note plusieurs changements significatifs dans les recommandations 2018 ACC/AHA (4) (Figure 5). L’indication chirurgicale est passée de la classe I à la classe II pour les CCA gauches asymptomatiques ou sans ischémie silencieuse. Une chirurgie ou une surveillance peuvent être proposées (classe IIb) pour une CCA droite asymptomatique ou sans ischémie silencieuse. Bien que des indications larges de correction soient parfois prônées, assez peu de patients sont opérés. L’absence de données contrôlées, l’estimation individuelle difficile des risques et la morbidité chirurgicale sont des facteurs explicatifs. La revascularisation par pontage sans une ligature coronaire est déconseillée par risque d’involution du greffon artériel.
Deux approches chirurgicales dominent : l’exérèse de la bandelette aortique intramurale (unroofing) et la création d’un nouvel ostium avec un patch d’élargissement.
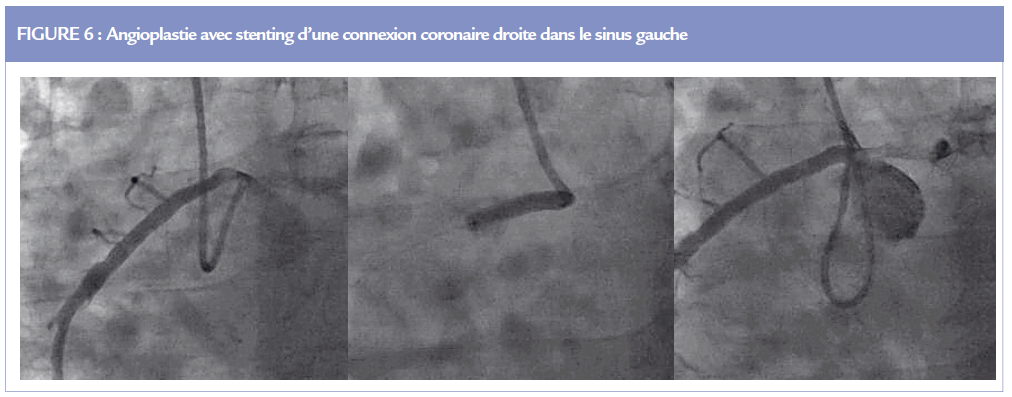
En cas de symptomatologie ischémique, la place de l’angioplastie coronaire mérite d’être évaluée chez l’adulte >30 ans, car un stenting (Figure 6) est possible sans risque majeur péri procédural (14). L’angioplastie est citée comme une alternative chez les patients adultes à haut risque chirurgical (15).
De manière empirique, un traitement bétabloquant est parfois proposé. Un DAI est rarement discuté en prévention secondaire, notamment après une correction chirurgicale. Une surveillance seule peut être une stratégie initiale acceptable selon le contexte. En l’état de nos connaissances actuelles, il est préférable que la décision de corriger ou de ne pas corriger une CCA soit celle d’une équipe multidisciplinaire spécialisée.
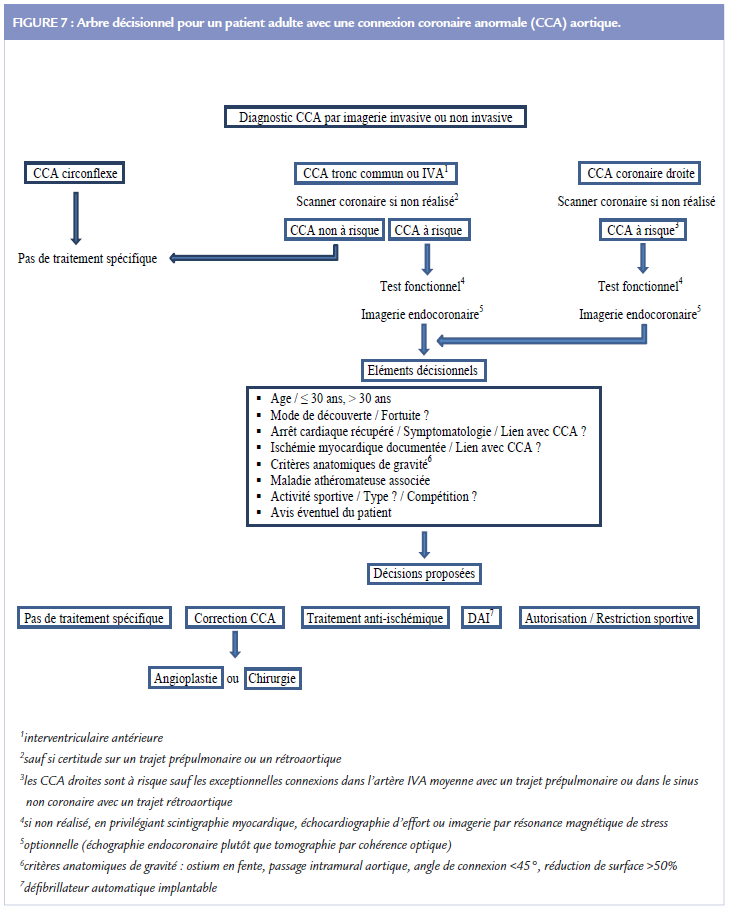
L’arbre décisionnel actuellement utilisé au cours des réunions multidisciplinaires du groupe ANOCOR est présenté (Figure 7).
Pratique sportive et dépistage
Si les bienfaits cardiovasculaires du sport sont connus, le risque de MS est majoré chez le jeune athlète en activité. La MS du sportif liée à une CCA est toujours vécue dramatiquement. La question se pose sur la restriction sportive pour certaines CCA non corrigées et sur le dépistage des CCA à risque.
Une décision délicate concerne les CCA droites asymptomatiques et sans ischémie silencieuse, avec désormais une autorisation possible de tout sport en compétition (12). Il s’agit d’un changement notable de paradigme. Le jeune patient ainsi que son entourage familial et sportif doivent être informés des décisions prises en soulignant nos incertitudes. Lorsqu’une activité sportive intense est autorisée avec une CCA non corrigée, une information sur les signes fonctionnels alarmants, la conduite à tenir en cas d’arrêt cardiaque et l’intérêt d’un défibrillateur semi-automatique proche doivent être rappelés.
Si le dépistage d’une cardiopathie à risque de MS est admis pour une aptitude à la pratique sportive, ses modalités restent débattues. Les recommandations européennes préconisent un ECG systématique, non contributif pour le diagnostic d’une CCA, au contraire de l’échocardiogramme requis en France uniquement pour les sportifs de haut niveau et espoirs (environ 15 000 individus). La recherche des connexions coronaires doit être systématique lors d’un échocardiogramme programmé pour une aptitude à la pratique sportive. Le bénéfice d’un dépistage à large échelle (environ 200.000 jeunes âgés de 12 ans et licenciés en France dans un sport à composante dynamique élevée) reste à évaluer. Dans cette population cible, 80 CCA gauches et 650 CCA droites seraient présentes.
Perspectives
Les connaissances actuelles sur les CCA et les niveaux de preuve des recommandations actuelles montrent de nombreuses lacunes à combler. La construction d’un modèle pour stratifier le risque individuel de MS est un des objectifs majeurs. Les mécanismes conduisant à une fibrillation ventriculaire méritent une analyse rythmologique plus approfondie. Les résultats de la correction chirurgicale à moyen et long terme doivent être mieux connus. La place du traitement interventionnel reste à préciser. La conduite à tenir vis à vis des activités sportives intensives doit être évaluée. La prévalence angiographique des CCA est proche de 1% dont un tiers est identifié à risque, mais une minorité présentera une symptomatologie ischémique et une infime partie succombera d’une mort rythmique. La mise en commun sous forme d’un registre national des CCA à risque avec leurs particularités anatomiques, cliniques et thérapeutiques pourrait nous aider à identifier certains phénotypes particulièrement exposés.
Liens d’intérêts : les auteurs déclarent n’avoir aucun lien d’intérêt avec ce travail.
Pierre Aubry (1), Xavier Halna du Fretay (2), Patrick Dupouy (3), Jean-Michel Juliard (1),
pour le groupe ANOCOR (*).
(1) Département de cardiologie, Groupe Hospitalier Bichat-Claude-Bernard, Assistance Publique-Hôpitaux de Paris, 75018 Paris.
(2) Unité Cardiologique de la Reine Blanche, Pôle Santé Oréliance, 45770 Saran.
(3) Unité d’Imagerie Cardiovasculaire Interventionnelle, Hôpital Privé d’Antony, 92160 Antony.
(*) Groupe ANOCOR : groupe de travail multidisciplinaire sur les anomalies coronaires congénitales.
Correspondance : Pierre Aubry
Département de Cardiologie, Groupe Hospitalier Bichat-Claude-Bernard, Assistance Publique-Hôpitaux de Paris,
46 rue Henri Huchard, 75018 Paris.
Email : pcaubry@yahoo.fr
Téléphone : 01 40 25 86 65
Fax : 01 40 25 88 65
RÉFÉRENCES
1. Pérez-Pomares JM, de la Pompa JL, Franco D, Henderson D, Ho SY, Houyel L, et al. Congenital coronary arteries anomalies: a bridge from embryology to anatomy and pathophysiology-a position statement of the development, anatomy and pathology ESC Working Group. Cardiovascular Research 2016;109:204-16.
2. Aubry P, Halna du Fretay X, Calvert PA, Dupouy P, Hayfi l F, Laissy JP, et al. Proximal anomalous connections of coronary arteries in adults. In: Rao PS, editor. Congenital heart disease: selected aspects. Intech 2012, http://www.intechopen.com/books/congenital-heart-disease-selected- aspects/proximal-anomalous-connections.
3. Koutsoukis A, Halna du Fretay X, Dupouy P, Ou P, Laissy JP, Juliard JM, et al. Interobserver variability in the classifi cation of congenital coronary abnormalities: a substudy of the anomalous connections of the coronary arteries registry. Congenit Heart Dis 2017;12:726-32.
4. Stout KK, Daniels CJ, Aboulhosn JA, Bozkurt B, Broberg CS, Colman JM, et al. 2018 AHA/ACC Guideline for the Management of Adults With Congenital Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2018,doi:10.1016/j.jacc.2018.08.1029.
5. Cheezum MK, Liberthson RR, Shah NR, Villines TC, O’Gara PT, Lanszberg MJ, et al. Anomalous aortic origin of a coronary artery from the inappropriate sinus of valsalva. J Am Coll Cardiol 2017;69:1592–608.
6. Angelini P, Cheong BY, Lenge De Rosen VV, Lopez A, Uribe C, Masso AH, et al. High-risk cardiovascular conditions in sports-related sudden death: prevalence in 5,169 schoolchildren via cardiac magnetic resonance. Tex Heart Inst J 2018;45:205-13.
7. Angelini P, Uribe C. Anatomic spectrum of left coronary artery anomalies and associated mechanisms of coronary insuffi ciency. Catheter Cardiovasc Interv 2018, doi: 10.1002/ccd.27656.
8. Aubry P, Halna du Fretay X, Dupouy P, Leurent G, Godin M, Belle L, et al. Anomalous connections of the coronary arteries: a prospective observational cohort of 472 adults. The ANOCOR registry. Eur Heart J 2015;36 (suppl 1):1138.
9. Aubry P, Halna du Fretay X, Degrell P, Waldmann V, Karam N, Marijon E. Sudden cardiac death and anomalous connections of the coronary arteries: what is known and what is unknown? Ann Cardiol Angeiol 2017;66:309-18.
10. Penalver JM, Mosac RS, Weitz W, Phoon CKL. Anomalous aortic origin of coronary arteries from the opposite sinus: a critical appraisal of risk. BMC Cardiovascular Disorders 2012;12:83.
11. Harmon KG, Drezner JA, Wilson MG, Sharma S. Incidence of sudden cardiac death in athletes: a state-of-the-art review. Br J Sports Med 2014:48:1185-92.
12. Van Hare GF, Ackerman MJ, Evangelista JA, Kovacs RJ, Myerburg RJ, Shafer KM, et al. Eligibility and disqualifi cation recommendations for competitive athletes with cardiovascular abnormalities: task force 4: congenital heart disease. J Am Coll Cardiol 2015;66:2372-84.
13. Mery CM. Decision making in anomalous aortic origin of a coronary artery. Congenit Heart Dis 2017;12:630-2.
14. Degrell P, Halna Du Fretay X, Dupouy P, Barragan P, Nejjari M, Dugauquier C, et al. Anomalous connection of the right coronary artery with interarterial course: preliminary prospective experience of stenting in a selected adult population. J Am Coll Cardiol 2017;70 (Suppl. B):B139-40.
15. Brothers JA, Frommelt MA, Jaquiss RBD, Myerburg RJ, Fraser CD, Tweddell JS. Expert consensus guidelines: anomalous aortic origin of a coronary artery. J Thorac Cardiovasc Surg 2017;153:1440-57.
