PIONEER 6 Peptide Innovation for Early Diabetes Treatment
Contexte et hypothèse
La FDA demande que tout nouveau médicament du diabète fasse la démonstration de sa sécurité d’emploi dans des études de morbi-mortalité, dessinées en premier comme des essais de non-infériorité face à un placebo. Plusieurs agonistes du récepteur GLP1 (aGLP1) administrés par voie sous-cutanée ont non seulement démontré cette non-infériorité, mais parfois aussi une supériorité sur les événements cardiovasculaires. Le sémaglutide est un aGLP1 jusqu’ici utilisé en une injection hebdomadaire ; il a été évalué dans l’étude SUSTAIN 6 chez des patients diabétiques de type 2 avec une maladie cardiovasculaire avérée ou une atteinte rénale et a montré une réduction de 26 % des événements cardiovasculaires. Une forme orale du sémaglutide a été développée et fait l’objet de l’étude PIONEER 6, destinée à démontrer sa sécurité d’emploi.
Critères d’inclusion et d’exclusion
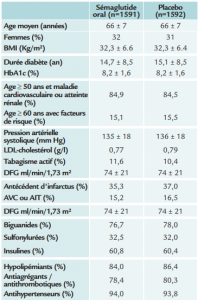
Patients diabétiques de type 2, ayant au moins 50 ans et une maladie cardiovasculaire documentée ou une atteinte rénale, ou au moins 60 ans avec des facteurs de risque associés. Les patients traités par aGLP1, inhibiteurs de la DPP4 ou pramlintide étaient exclus, de même que ceux ayant une insuffisance cardiaque NYHA 4, ou ayant eu un syndrome coronaire aigu, un AVC ou un AIT dans les 60 jours précédant le screening. Les patients pour lesquels une intervention de revascularisation artérielle (coronaire, carotide ou périphérique) était prévue, les patients dialysés ou ayant une insuffisance rénale sévère (DFG <30) ou ceux traités pour des complications oculaires ne pouvaient être inclus.
Plan d’étude et traitements étudiés
Etude randomisée en double aveugle sémaglutide (un comprimé par jour, avec la dose cible de 14 mg) contre placebo. Stratification sur les critères d’inclusion (maladie cardiovasculaire
avérée ou atteinte rénale, facteurs de risque seulement). Il était recommandé de prendre le traitement d’étude le matin à jeun, dans 120 ml d’eau, au moins 30 minutes avant toute autre
forme d’alimentation, avec une titration progressive jusqu’à la dose de 14 mg, qui pouvait être réduite par la suite en cas de mauvaise tolérance digestive.
Critères de jugement
Critères de jugement principal : mortalité cardiovasculaire
(incluant les décès de cause inconnue), infarctus du
myocarde, accident vasculaire cérébral non fatals.
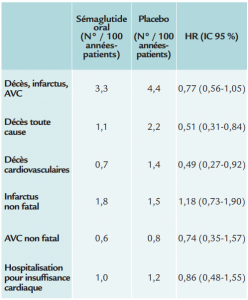
Critères secondaires :
• critère principal + hospitalisation pour syndrome coronaire aigu ou insuffisance cardiaque
• décès toute cause, infarctus du myocarde ou accident vasculaire cérébral
• composantes individuelles du critère principal
Taille de l’échantillon et hypothèses statistiques
Hypothèse de non-infériorité par rapport au placebo, avec borne supérieure de l’intervalle de confiance de risque à 95 % fixée à 1,8 en comparaison du placebo. Recrutement guidé par le nombre d’événements du critère principal, avec cible de 122 événements. Toutes les analyses ont été faites sur l’ensemble de la population randomisée, par un modèle de Cox stratifié, avec le groupe de traitement comme covariable fixe. L’hypothèse première était une hypothèse de non infériorité ; sous réserve de la non-infériorité, la supériorité du traitement était testée ensuite.
Population
Randomisation de 3183 patients, dans 21 pays et 214 centres entre janvier et août 2017. Délai de suivi médian 15,6 mois (de 4 à 20 mois).
Résultats
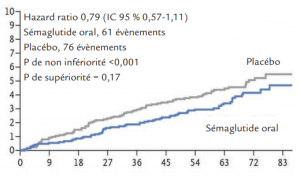
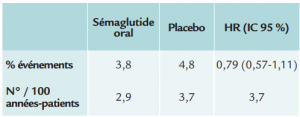
- Critère de jugement principal :
(décès cardiovasculaire, incluant les décès de cause
inconnue, infarctus ou AVC):
Critères secondaires
- Analyses de sous-groupes
Les analyses de sous-groupes trouvent une interaction (P=0,05) avec l’âge, avec une efficacité meilleure du sémaglutide oral sur le critère principal pour les sujets âgés de 50 à 64 ans (HR 0,51, IC 95 % 0,29-0,90), et une absence d’effet chez les patients de 65 ans et plus (HR 1,04, IC 95 % 0,68-1,59).
- Effets hémodynamiques et métaboliques
La pression artérielle systolique diminue plus dans le groupe sémaglutide (- 2,6 mm Hg par rapport au placebo) ; la fréquence cardiaque augmente, avec une différence de 3,9 battements par minute par rapport au placebo. On observe une perte de poids de plus de 4 Kg dans le groupe sémaglutide, contre moins d’un Kg dans le groupe placebo. Le cholestérol total, le LDL et les
triglycérides diminuent plus dans le groupe sémaglutide. Le contrôle de l’HbA1c est meilleur dans le groupe sémaglutide (- 1,0 %) que dans le groupe placebo (-0,3 %).
- Tolérance et effets secondaires
Des événements indésirables graves sont observés chez 18,9 % des patients du groupe sémaglutide, et 22,5 % des patients sous placebo. L’arrêt définitif du traitement est plus fréquent
dans le groupe sémaglutide (11,6 % versus 6,5 %), essentiellement en raison d’une mauvaise tolérance digestive. Des hypoglycémies sévères sont notées chez 1,4 % et 0,8 % des patients, respectivement.
Conclusion
Le sémaglutide par voie orale est donc non inférieur au placebo dans cette population de patients diabétiques de type 2, confirmant la bonne tolérance cardiovasculaire du traitement. Les effets secondaires les plus communs sont liés à une intolérance gastro-intestinale. Enfin, il y a moins de décès et moins de décès cardiovasculaires chez les patients recevant le sémaglutide, mais le plan d’analyse statistique choisi ne permet pas de conclure définitivement à cet égard.
Nicolas Danchin
