L’insuffisance mitrale (IM) est fréquemment rencontrée chez les patients insuffisants cardiaques (IC), et se définit comme fonctionnelle (ou secondaire) en présence d’une valve structurellement normale. Elle peut revêtir un caractère dynamique (majoration ou diminution) en fonction des variations de la taille et de la géométrie du ventricule gauche, mais aussi des conditions de charge qui vont modifier les contraintes imposées aux feuillets valvulaires et réduire les forces de fermeture. Chez certains patients, l’augmentation de l’IM induite par l’exercice va contribuer à la limitation de la capacité d’effort et s’accompagner d’un pronostic plus défavorable. Cette IM dynamique est donc une entité à part qui prend toute sa valeur dans l’évaluation d’un IC restant symptomatique malgré un traitement optimal. En effet, l’intensification de la prise en charge d’une IC réfractaire doit en partie se concentrer sur l’optimisation de l’importance de cette fuite, que ce soit par une prise en charge médicamenteuse ou interventionnelle.
Fuite mitrale fonctionnelle
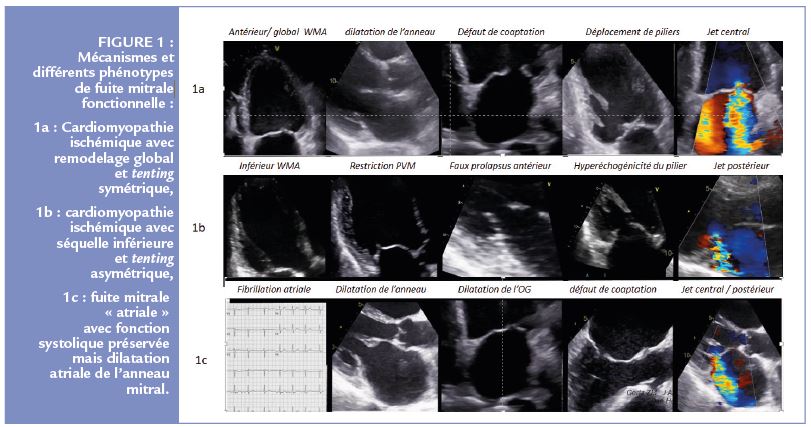
La fuite mitrale fonctionnelle est liée à un déséquilibre entre l’augmentation des forces de traction (secondaire à la dilatation du ventricule gauche et de l’anneau mitral) et la diminution des forces de fermeture (secondaire à la baisse de la contractilité et à l’asynchronisme) le plus souvent lié à une dysfonction ventriculaire gauche (FEVG<40%) (1). Cependant, un certain nombre de patients pourront avoir une fonction ventriculaire normale avec des modifications isolées de la géométrie mitrale liées principalement au remodelage de l’OG et de l’anneau mitral (fuite mitrale « atriale ») (2) Figure 1. Le point commun, et ce quel que soit le niveau de fonction VG ou la cardiomyopathie sous-jacente, est l’augmentation des contraintes sur l’appareil valvulaire et sous valvulaire mitral avec traction de la valve mitrale. Ce tenting va entraîner une coaptation incomplète des feuillets mitraux et donc une fuite. L’interaction entre la valve mitrale, le ventricule gauche et l’anneau mitral permet d’expliquer son caractère potentiellement dynamique au cours du temps et au cours d’un même cycle cardiaque. (3)
Concept du caractère dynamique d’une fuite mitrale
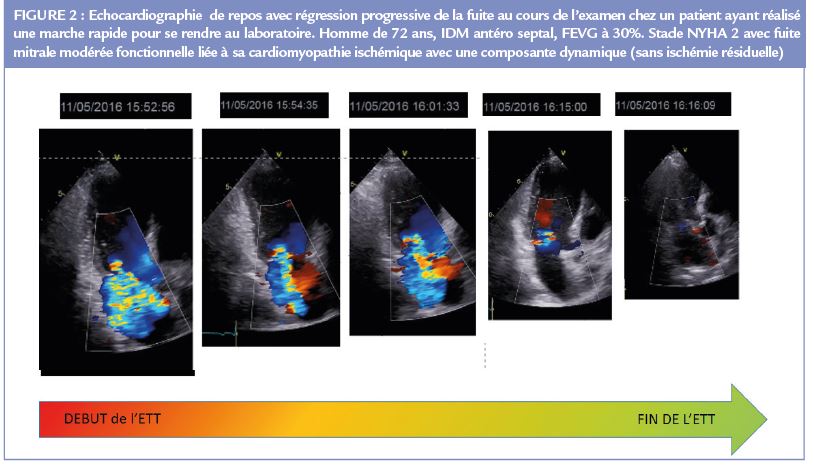
Pour bien comprendre et illustrer ce concept, il faut accepter qu’un patient, en fonction des conditions de charge et de son état de volémie, va pouvoir
présenter une fuite dont le degré de sévérité va varier d’une évaluation à une autre, voire même au cours d’une même échocardiographie (Figure 2).
Parmi les différents mécanismes pouvant aggraver cette fuite, il faut en premier lieu écarter une ischémie myocardique induisant des troubles de la cinétique segmentaire et une diminution de la FEVG. Ce type de fuite souvent nommée «ischémique» est à différencier des fuites fonctionnelles uniquement liées à des modifications géométriques (post infarctus chez des patients stables sur le plan coronaire). D’autres situations peuvent conduire à une aggravation de la fuite mitrale comme une surcharge volémique (ex : patient dialysé), une modification de la contractilité (ex : fibrillation atriale), une majoration de l’asynchronisme, ou tout autre mécanisme augmentant la post charge (3). On comprend ainsi que chez l’IC, au cours d’une décompensation, de façon contemporaine à une aggravation de sa dysfonction systolique/diastolique, on va observer une aggravation de la fuite mitrale, qui secondairement après déplétion peut redevenir non significative (3).
Comment identifier une IM dynamique ?
L’échocardiographie d’effort, en position semi-assise, est la méthode de choix pour l’étude de cette composante dynamique. Il n’est pas nécessaire d’atteindre la fréquence maximale théorique et le seuil ischémique, mais au contraire de s’astreindre à obtenir des images de bonne qualité notamment lors de paliers intermédiaires ou de la survenue de symptômes. Les méthodes de la PISA par l’étude de la zone de convergence et la mesure des débits par doppler vont permettre d’étudier les variations du degré de la fuite induites à l’effort mais également la fonction cardiaque et le niveau des pressions pulmonaires. Au cours de l’effort, on va donc successivement évaluer les modifications de contractilité globale et régionale et de la géométrie de l’appareil valvulaire (« surface sous la tente » et dilatation de l’anneau). Cela s’accompagne souvent d’un asynchronisme d’effort et d’une chute du débit aortique
avec augmentation de la pression systolique artérielle pulmonaire. Enfin il va être possible d’évaluer l’évolution de la fuite mitrale à l’effort avec la quantification de la surface de l’orifice régurgitant (SOR) et de la fraction de régurgitation. Chez certains sujets, la surface de l’orifice régurgitant diminue à l’effort, chez d’autres, elle varie peu ou bien elle augmente significativement. Le degré de régurgitation mitrale au repos ne permet pas de prédire les modifications induites par l’effort.
Conséquences cliniques et pronostiques
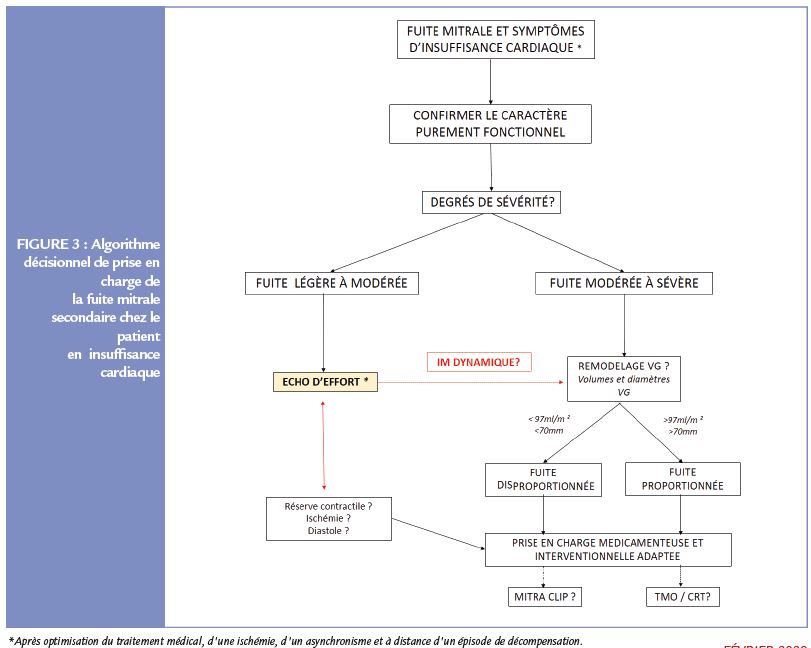
L’identification d’une aggravation de la fuite à l’effort va permettre de la quantifier et de comprendre la part de la limitation fonctionnelle et la diminution de la tolérance à l’effort liée à cette fuite. Une augmentation significative du degré de la régurgitation à l’effort (augmentation de la SOR > 13mm²) est associée à un excès de mortalité et à la survenue d’épisodes de décompensation cardiaque nécessitant une hospitalisation (4). De plus, plusieurs travaux dans l’insuffisance cardiaque aiguë ont montré l’importance de l’aggravation d’une fuite mitrale en phase aiguë sur la prédiction et le risque de survenue d’évènements cardiovasculaires ou de nouvelle poussée d’insuffisance cardiaque (5). Chez ces patients, qui à distance d’une décompensation auront une fuite peu sévère, mais resteront symptomatiques sans autre cause évidente, il va falloir se poser la question de démasquer une IM dynamique et discuter
une évaluation à l’effort (Figure 3).
Impact thérapeutique
La prise en charge de ces patients reste difficile et le traitement médical est souvent décevant. Les vasodilatateurs, les diurétiques, et les inhibiteurs
du système rénine angiotensine, déchargent ou entraînent un remodelage inverse du ventricule gauche, et s’accompagnent d’une diminution du volume
régurgité par l‘intermédiaire essentiellement d’une réduction de la SOR. La stimulation biventriculaire (resynchronisation myocardique) est une approche
intéressante, qui permet de réduire à la fois la sévérité de l’insuffisance mitrale au repos et son caractère dynamique. Cette thérapeutique n’est justifiée que s’il existe un asynchronisme intraventriculaire. La chirurgie de revascularisation ou de remplacement valvulaire mitrale isolée semble également inefficace (6). L’authentification et le diagnostic positif de fuite mitrale dite dynamique en rapport avec les symptômes du patient et son pronostic devraient faire discuter d’une thérapeutique spécifique. Pour ce qui est du traitement interventionnel percutané, les résultats discordants des études Mitra FR et Coapt ont clairement permis de démontrer que certains patients, à niveau de FEVG et de fraction de régurgitation équivalent, pouvaient avoir une fuite dite proportionnée ou non à leur degré de dilatation cavitaire (7). Ainsi, certains patients avec une fuite dite disproportionnée, c’est-à-dire avec une
fuite le plus souvent sévère (SOR > à 0,4cm²) et avec un remodelage VG modérément important (Volume télédiastolique < 97ml/m²), pourraient bénéficier d’une intervention spécifique sur la fuite (resynchronisation, plastie, mitraClip). Cependant comme discuté plus haut dans cet algorithme de prise en charge un certain nombre de patients auront une fuite mitrale n’atteignant pas les seuils de sévérité au repos 8, mais pourraient cependant bénéficier, en raison de son caractère dynamique et d’une réserve contractile, d’une prise en charge spécifique.
Conclusion
La fuite mitrale dynamique est souvent sous-estimée et doit être systématiquement recherchée chez un patient insuffisant cardiaque restant symptomatique sous traitement, que la fraction d’éjection soit préservée ou altérée. Ceci est d’autant plus vrai qu’il existe une fuite mitrale même légère, des modifications géométriques de l’appareil mitral et/ou des antécédents de fuite significative lors de décompensations antérieures. Les options et alternatives thérapeutiques (médicamenteuses et interventionnelles) d’optimisation de cette fuite se multiplient mais ne seront bénéfiques que pour certains groupes de patients. L’identification précise des répondeurs potentiels est en lien avec l’importance du remodelage ventriculaire et surtout avec les mécanismes
conduisant à l’évolutivité de cette fuite.
Olivier Huttin, Christine Selton-Suty, Clément Venner, Laura Filippetti, Yves Juillière, CHU Nancy
L’auteur principal déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
RÉFÉRENCES
1. Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure: pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol. 2015 Mar 31;65(12):1231–48.
2. Kagiyama N, Mondillo S, Yoshida K, Mandoli GE, Cameli M. Subtypes of Atrial Functional Mitral Regurgitation: Imaging Insights Into Their Mechanisms and Therapeutic Implications. JACC CardiovascImaging. 2019 Aug 8;
3. Bertrand PB, Schwammenthal E, Levine RA, Vandervoort PM. Exercise Dynamics in Secondary Mitral Regurgitation: Pathophysiology and Therapeutic Implications. Circulation. 2017 Jan 17;135(3):297–314.
4. Lancellotti P, Troisfontaines P, Toussaint A-C, Pierard LA. Prognostic importance of exercise-induced changes in mitral regurgitation in patients with chronic ischemic left ventricular dysfunction. Circulation. 2003 Oct 7;108(14):1713–7.
5. Kajimoto K, Sato N, Takano T, investigators of the Acute Decompensated Heart Failure Syndromes (ATTEND) registry. Functional mitral regurgitation at discharge and outcomes in patients hospitalized for acute decompensated heart failure with a preserved or reduced ejection fraction. Eur J HeartFail. 2016 ; 18 (8) : 1051–9.
6. Enriquez-Sarano M, Michelena HI, Grigioni F. Treatment of Functional Mitral Regurgitation. Circulation. 2019 May 14;139(20):2289–91.
7. Pibarot P, Delgado V, Bax JJ. MITRA-FR vs. COAPT: lessons from two trials with diametrically opposed results. Eur Heart J Cardiovasc Imaging. 2019 Jun 1;20(6):620–4.
8. Tozzi P. The future of functional mitral regurgitation treatment. Eur Heart J. 2019 Jul 14;40(27):2215–7.