Nous résumerons ici le travail d’un groupe d’experts de la Société Française d’Anesthésie-Réanimation et de la Société Francophone du Diabète (SFAR et SFD) auquel nous avons participé et qui a abouti à la publication d’articles résultant des données de la littérature, d’un accord professionnel (1,2) et de fiches pratiques disponibles sur les sites de ces sociétés savantes. De nombreux points devraient être utiles aux cardiologues et diabétologues consultés en prévision d’une anesthésie générale chez un patient diabétique.
Introduction
Un diabète connu ou méconnu affecte 20 % des patients hospitalisés en chirurgie générale et même 40 % de ceux devant avoir une chirurgie cardio-vasculaire. Des complications micro ou macrovasculaires peuvent être présentes et trop de patients encore ont un diabète découvert au stade de complications majeures (infarctus du myocarde, accident vasculaire cérébral, altération
de la vision, insuffisance rénale). Ces complications peuvent d’ailleurs être le motif de la consultation anesthésique en vue d’une chirurgie.
En plus de ses objectifs habituels, la consultation pré-anesthésique est une opportunité pour dépister un diabète et ses complications et évaluer l’équilibre glycémique. Elle pourra conduire à une adaptation thérapeutique si nécessaire et une éducation thérapeutique. Un bilan pré-opératoire complet permettra d’éviter les déséquilibres glycémiques péri-opératoires qui accroissent la morbi-mortalité et allongent la durée de séjour à l’hôpital. Une collaboration multidisciplinaire est donc recommandée, impliquant l’anesthésiste, le diabétologue et le cardiologue.
L’évaluation pré-opératoire
Cette évaluation constitue une partie fondamentale et spécifique de la prise en charge du patient diabétique et il convient de rechercher les éléments qui peuvent modifier les décisions et attitudes anesthésiques en péri-opératoire.
-
Hyperglycémie de stress ou dysglycémie pré-existante méconnue
Dans une étude portant sur plus de 40 000 patients hospitalisés dont 19 % avaient un diabète connu, la glycémie dosée en péri-opératoire chez 47% d’entre eux dépassait 1,80 g/L (10 mmol/l) chez 40% des diabétiques et 6% des patients sans diabète connu (3). La découverte d’une hyperglycémie en période péri-opératoire ne permet pas de distinguer un diabète préexistant et méconnu avant la chirurgie d’une hyperglycémie de stress. Au contraire le taux d’HbA1c, qui reflète l’équilibre glycémique des 8-12 dernières semaines, permet cette distinction. En effet une HbA1c 6,5% est un critère diagnostique de diabète dans certains pays et identifie 1/3 de plus de patients diabétiques non diagnostiqués par rapport à une glycémie à jeun 1,26 g/l (7 mmol/l). Cependant, le dosage de l’HbA1c n’est pas recommandé en pratique courante pour le dépistage du diabète en France en raison de son coût.
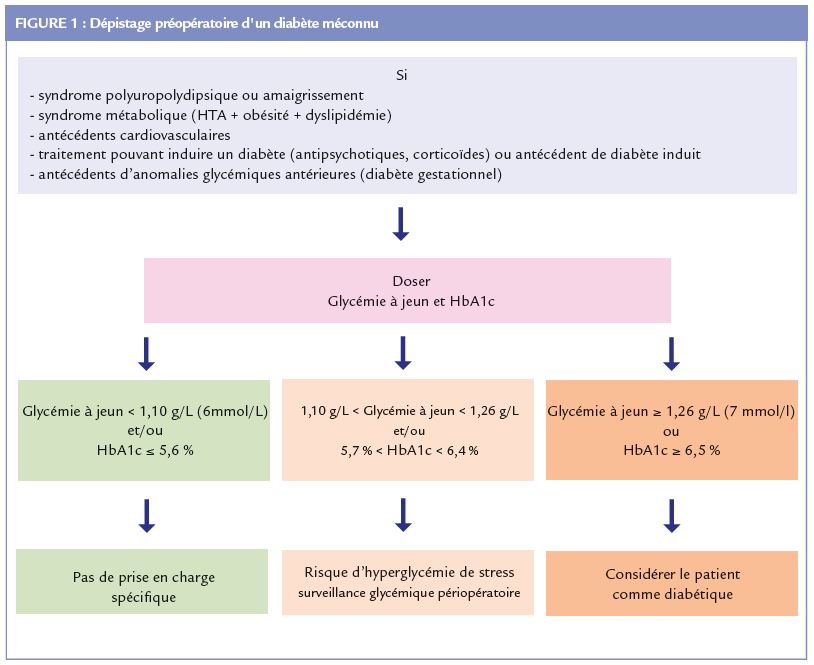
Le groupe d’experts SFAR-SFD a proposé que le dépistage pré-opératoire soit réalisé s’il existe des signes de diabète (syndrome cardinal) et chez des sujets à très haut risque de dysglycémie :
syndrome métabolique, antécédents familiaux de diabète, antécédent de syndrome coronarien aigu ou d’AVC, traitement diabétogène, antécédent de diabète gestationnel ou d’hyperglycémie transitoire. Le dépistage par glycémie à jeun et HbA1c est suggéré (Figure 1), en cohérence avec les recommandations françaises (SFD-SFC) pour la prise en charge des patients présentant
un syndrome coronarien aigu qui préconisent l’utilisation de l’HbA1c comme critère diagnostique des dysglycémies (4) .
-
Évaluation de l’équilibre glycémique pré-opératoire
Le déséquilibre glycémique est fréquent en périopératoire en raison d’une insulino-résistance périphérique favorisée par de nombreux facteurs
tels que le stress, le jeûne, l’hypo- ou l’hyperthermie, l’hypoxie cellulaire, le sepsis, le traumatisme mais aussi l’utilisation de catécholamines, de glucocorticoïdes… et ce d’autant plus que le déséquilibre glycémique existait en pré-opératoire. Plusieurs études ont montré une corrélation entre la glycémie à l’admission (> 11 mmol/l) et la morbi-mortalité post-opératoire (5,6), ainsi qu’un risque dix fois plus important de complications lorsqu’il existait un déséquilibre glycémique avant une chirurgie (7).
Le dosage de l’HbA1c est un paramètre intéressant en pré-opératoire car sa valeur permet d’estimer l’équilibre glycémique des trois derniers mois. Plusieurs
études ont montré que chez le patient diabétique, il existe une morbi-mortalité plus importante et un risque augmenté de complications cardio-vasculaires et d’infections post-opératoires (8,9). Ainsi, il est intéressant de doser l’HbA1c lors de la consultation chirurgicale ou anesthésique. Des valeurs extrêmes d’HbA1c doivent faire envisager des ajustements thérapeutiques (renforcement quand elle est supérieure à 8% ou allègement quand elle est inférieure à 6%) par le médecin généraliste ou le diabétologue en préopératoire ou lors de la consultation d’anesthésie afin de diminuer le risque de déséquilibre glycémique
péri-opératoire 10. Des valeurs encore plus extrêmes (< 5% ou > 9%) doivent même faire discuter le report de la chirurgie si elle n’est pas urgente et permettre une prise en charge diabétologique pré-opératoire (10).
Recherche des complications spécifiques du diabète
Si la recherche et la prise en charge des complications micro et macrovasculaires du diabète incombent au diabétologue, il est important pour l’anesthésiste
en pré-opératoire d’évaluer les complications qui peuvent avoir une influence et faire modifier sa prise en charge.
La gastroparésie
Cette complication spécifique du diabète est la manifestation la plus fréquente de la dysautonomie digestive. Elle concerne 30 à 50% des patients avec un
diabète de type 1 ou 2 et affecte des patients ayant le plus souvent d’autres atteintes neuropathiques. Elle se définit par une vidange gastrique retardée
en l’absence d’obstruction mécanique. Elle doit être suspectée en consultation d’anesthésie par la recherche de signes cliniques tels que les douleurs
abdominales, les sensations de ballonnements, les vomissements, une sensation de satiété précoce ou une lenteur à la digestion (11).
L’examen diagnostique de référence de la gastroparésie est la scintigraphie gastrique avec un repas calibré, de préférence solide, marqué au technetium 99m. D’autres examens peuvent être proposés comme le test respiratoire à l’acide octanoïque marqué au carbone 13.
En consultation d’anesthésie, la gastroparésie doit être suspectée dans la mesure où elle crée un risque de stase (estomac plein) et d’inhalation à l’induction anesthésique. Lors de cette consultation l’interrogatoire doit en rechercher les manifestations cliniques et si elles sont présentes, on peut s’aider de l’échographie qui permet, par la mesure de l’aire antrale, de distinguer si l’estomac est plein (12). Dans le doute, une induction anesthésique type « estomac
plein » doit être réalisée. L’érythromycine et le métoclopramide qui accélèrent la motilité gastrique peuvent être utilisés.
Les atteintes cardiaques du diabète
On considère que 75% des diabétiques décèdent des complications de l’athérosclérose et la maladie coronaire représente la cause principale de décès. Tandis que les complications de l’athérosclérose diminuent grâce au contrôle plus précoce et énergique des facteurs de risque cardiovasculaire, plusieurs
études épidémiologiques indiquent que l’insuffisance cardiaque progresse dans cette population.
- La maladie coronaire
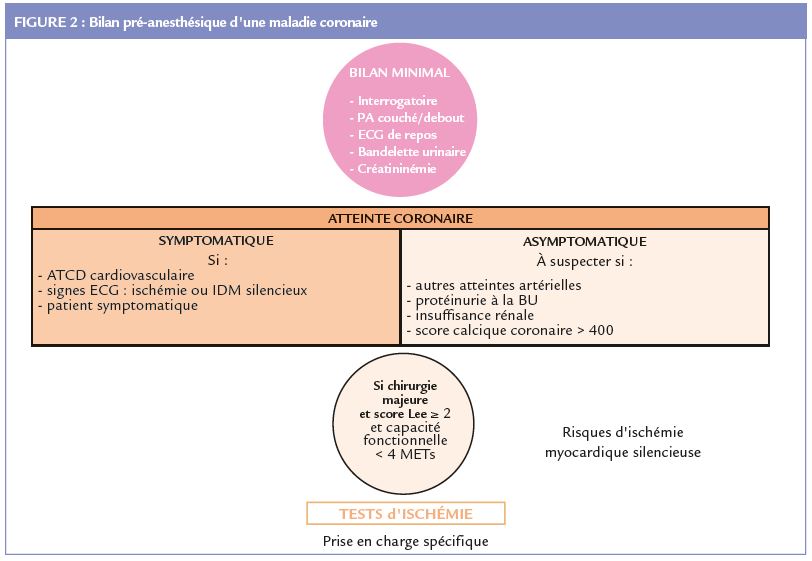
Elle se distingue chez le patient diabétique par sa sévérité plus importante et surtout le fait qu’elle puisse être asymptomatique. L’ischémie myocardique silencieuse (IMS) est présente chez 30 à 50% des diabétiques de type 2 asymptomatiques, sans antécédent cardiologique mais ayant d’autres facteurs de risque cardiovasculaire (13), avec toutefois une prévalence en nette diminution dans des séries récentes. L’IMS a une valeur pronostique péjorative (14,15). Elle est dépistée par la réalisation de tests de provocation (épreuve d’effort, scintigraphie myocardique couplée à l’effort et/ou à l’administration de dipyridamole, échographie de stress voire imagerie par résonance magnétique de stress). Elle est associée à la présence de sténoses coronaires significatives dans 30 à 70% des cas si une coronarographie est réalisée (13). Lors de la consultation d’anesthésie d’un patient diabétique, il est indiqué de faire un bilan cardiovasculaire minimal plus ou moins complété par certaines explorations (Figure 2).- L’interrogatoire et l’examen clinique recherchent des antécédents cardiovasculaires, en particulier l’existence d’une maladie coronaire et d’une éventuelle revascularisation, un antécédent d’accident vasculaire cérébral, la présence d’une hypertension artérielle, des douleurs thoraciques, des signes évocateurs d’insuffisance cardiaque, de troubles du rythme cardiaque, d’une artérite des membres inférieurs, des symptômes évocateurs d’hypotension orthostatique ou post-prandiale et des épisodes d’hypoglycémies graves non ressenties. Les traitements en cours sont
spécifiés. - Les résultats des explorations antérieures sont examinés : dernier ECG disponible, échocardiogramme, échodopplers artériels, explorations à la recherche d’une IMS.
- Une ischémie critique des membres inférieurs est écartée.
- Un ECG de repos est refait si le dernier date de plusieurs mois, à la recherche de signes suggestifs d’ischémie, d’une arythmie, d’un intervalle QT long.
- L’interrogatoire et l’examen clinique recherchent des antécédents cardiovasculaires, en particulier l’existence d’une maladie coronaire et d’une éventuelle revascularisation, un antécédent d’accident vasculaire cérébral, la présence d’une hypertension artérielle, des douleurs thoraciques, des signes évocateurs d’insuffisance cardiaque, de troubles du rythme cardiaque, d’une artérite des membres inférieurs, des symptômes évocateurs d’hypotension orthostatique ou post-prandiale et des épisodes d’hypoglycémies graves non ressenties. Les traitements en cours sont
En pré-opératoire, la détection de la maladie coronaire doit être réservée aux patients à risque cardiovasculaire très élevé, en particulier en présence d’autres atteintes artérielles, d’une macroprotéinurie, d’une insuffisance rénale (DFG < 30 ml/mn/1,73m2) et lorsque le score de calcifications coronaires est > 400 unités Agaston (16). La recherche d’une IMS est préconisée en cas de chirurgie majeure programmée si le score de Lee est ≥ 2 et la capacité fonctionnelle < 4 équivalents métaboliques (METs). Le patient sera alors adressé à un cardiologue en vue d’une prise en charge spécifique et de la réalisation de tests d’ischémie (Figure 2). Les modalités de prise en charge du patient ayant une maladie coronaire connue qui doit être opéré
en chirurgie non cardiaque sont décrites dans les recommandations formalisées d’experts SFAR/SFC en 2011 17 et il n’y a pas de spécificité pour le patient diabétique.
- L’insuffisance cardiaque
Le risque d’insuffisance cardiaque congestive est 2 à 3 fois plus élevé chez les diabétiques. L’âge, l’ancienneté du diabète, la maladie coronaire, l’arythmie par fibrillation auriculaire et la présence d’une albuminurie ou d’une insuffisance rénale sont associés à une augmentation du risque d’insuffisance cardiaque (18). La cardiomyopathie diabétique constitue une entité clinique bien établie et une cause authentifiée d’insuffisance cardiaque. Elle doit être
évoquée en cas d’insuffisance cardiaque survenant chez un patient indemne d’hypertension, de maladie coronaire ou de valvulopathie susceptibles de l’expliquer (19). S’il existe des signes évocateurs d’une insuffisance cardiaque, un dosage du BNP ou du pro-BNP, ou d’emblée un échocardiogramme, peuvent être prescrits.
- La neuropathie autonome cardiaque (NAC)
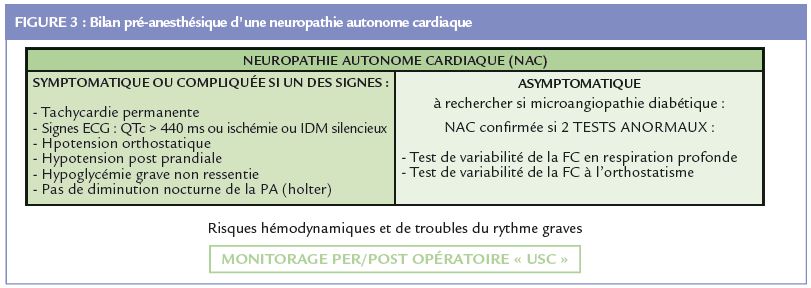
La NAC s’exprime rarement par des symptômes cliniques : tachycardie permanente, hypotension orthostatique (qui est toutefois souvent d’origine iatrogène), hypotension post-prandiale ou hypoglycémies sévères non ressenties, ou un intervalle QTc > 440 ms (Figure 3).
Ces symptômes témoignent d’une NAC sévère avec altération sympathique. Au stade infraclinique, la NAC est détectée par des anomalies des variations de la fréquence cardiaque (FC) au cours d’épreuves standardisées qui évaluent essentiellement le contrôle vagal. A ce stade la NAC est reconnue comme
la complication la plus fréquente du diabète, et sa prévalence augmente avec l’ancienneté de la maladie et le déséquilibre glycémique 20. Une NAC confirmée ou sévère défi nie par deux ou trois épreuves standardisées anormales affecte 20% des patients diabétiques. Les risques liés à la NAC sont l’infarctus du myocarde indolore, découvert sur un ECG systématique, une augmentation de la morbi-mortalité cardio-vasculaire et notamment du risque de mort subite secondaire à des troubles graves du rythme cardiaque (21, 22).
Les épreuves standardisées consistent à analyser les variations de FC au cours de la respiration profonde (à 6 cycles en une minute), lors du passage en orthostatisme ou d’une épreuve de Valsalva (22). Elles sont effectuées usuellement avec un électrocardiographe simple ou plus rapidement en utilisant un logiciel, et doivent être interprétées selon l’âge (réduction physiologique des variations de FC avec l’âge). Il existe une interaction entre anesthésie et
dysautonomie telle qu’une NAC accroît le risque d’instabilité hémodynamique péri-opératoire.
En effet, ce risque est renforcé chez les patients diabétiques ayant une variabilité respiratoire de FC pré-opératoire diminuée (23,24) et le recours périopératoire à un support vasopresseur a été trouvé corrélé à la sévérité de la NAC (25,26).
La réalisation d’épreuves autonomes cardiaques simples paraît utile pour identifier les patients à risque d’instabilité hémodynamique péri-opératoire et de complications cardiovasculaires même en l’absence de signes cliniques de NAC (Figure 3) (22,25). Ce dépistage qui devrait s’appuyer au minimum sur l’analyse des variations de FC au cours d’une épreuve de respiration profonde peut être réalisé dans les services de diabétologie, par l’anesthésiste ou au cabinet du cardiologue. En pratique cela prend moins de 5 minutes (pour réaliser le test et l’interpréter). En outre les patients diabétiques dysautonomiques sont également exposés à une diminution de la réponse ventilatoire à l’hypoxémie et à l’hypercapnie 27 et à une hypothermie peropératoire (28). Chez ces patients, un monitorage continu de la pression artérielle et de l’index cardiaque est recommandé (29).
Évaluation de la fonction rénale et recherche d’une néphropathie pré-existante
La néphropathie diabétique est une des complications microvasculaires les plus fréquentes de la maladie diabétique. Elle survient chez 30% des diabétiques de type 1 et environ 20% des diabétiques de type 2 (30). Le diabète est un facteur de risque indépendant de survenue d’insuffisance rénale aiguë en période périopératoire. Celle-ci peut se développer en dehors de toute dysfonction rénale préalable ou sur une maladie rénale chronique diabétique. L’évaluation du rapport albuminurie/créatininurie et du débit de filtration glomérulaire est donc indispensable pour la chirurgie majeure, en urgence ou si le patient présente un déséquilibre glycémique important.
La prise en charge péri-opératoire de la maladie rénale chronique diabétique n’a rien de spécifique. Cependant, il convient de porter une attention particulière à l’administration d’agents ou médicaments néphrotoxiques en péri-opératoire et d’optimiser l’hémodynamique en visant un objectif de pression artérielle moyenne entre 60 et 70 mmHg et de plus de 70 mmHg si le patient est hypertendu, pour maintenir la pression de perfusion rénale.
Pour atteindre cet objectif, il est recommandé de faire appel à un monitorage hémodynamique permettant d’évaluer le volume d’éjection systolique pour guider le remplissage vasculaire et l’administration de vasopresseurs en cas de chirurgie à risque d’instabilité hémodynamique (chirurgie hémorragique, chirurgie majeure ou en urgence) (31). Toutes les autres stratégies n’ont rien de spécifique et doivent obéir aux recommandations de prise en charge de l’insuffi sance rénale aiguë (31). Les modalités d’administration des agents anesthésiques doivent tenir compte des modifications pharmacocinétiques
et pharmacodynamiques résultant d’une dysfonction rénale chronique si celle-ci est présente, sans spécificité particulière en rapport avec le diabète.
La gestion de la glycémie en pré-opératoire
L’hospitalisation et particulièrement l’acte chirurgical et ses agressions associées induisent un état de stress responsable d’une hyperglycémie péri-opératoire qui résulte de l’insulino-résistance périphérique. Celle-ci dépend du type de chirurgie, de l’agressivité du geste et de sa durée (32) et contribue à l’altération du pronostic notamment en favorisant la libération d’acides gras libres délétères pour le myocarde, en augmentant le catabolisme des protéines et en allongeant ainsi le délai de cicatrisation.
L’hyperglycémie (> 1,80 g/l ou 10 mmol/l) en période péri-opératoire augmente la morbidité (7,33) (en particulier les infections) et la mortalité (34,35). Sa prise en charge est maintenant admise et le bénéfice passe par la diminution de la glycémie. Ainsi en période péri-opératoire, un contrôle glycémique compris entre 0,90 et 1,80 g/l (5 à 10 mmol/l) permet d’éviter les hypoglycémies. Le contrôle de la glycémie doit débuter en pré-opératoire et se poursuivre au cours des premiers jours post-opératoires (1). A son arrivée à l’hôpital pour l’intervention chirurgicale programmée, si un déséquilibre glycémique est présent, il convient de mesurer le rapport bénéfice-risque à pratiquer l’intervention dans de telles conditions.
- Lorsque le diabète est déséquilibré (8% < HbA1c < 9% et/ou glycémie > 10 mmol/l), on propose de réaliser la chirurgie et de prendre en charge cette hyperglycémie par des injections SC d’insuline rapide en pré-opératoire puis par une insulinothérapie IVSE au bloc opératoire qui sera relayée par une insulinothérapie de type basal-bolus si besoin en post-opératoire (2).
- Lorsque le diabète est très déséquilibré (HbA1c > 9% et/ou glycémie > 16,5 mmol/l) et que la chirurgie n’est pas urgente, il est licite de différer la chirurgie de quelques jours ou semaines lorsque l’indication chirurgicale le permet (10).
- Si la chirurgie est urgente, il convient de prendre en charge de façon plus agressive cette hyperglycémie. Un traitement par insulinothérapie IVSE peut être débuté et la chirurgie est différée de quelques heures le temps d’obtenir des niveaux glycémiques autour de 10-12 mmol/l.
Gaelle Cheisson, Service d’Anesthésie Réanimation Médecine péri-opératoire, Hôpital de Bicêtre. APHP, Université Paris Saclay
Paul Valensi, Service d’endocrinologie-diabétologie nutrition, hôpital Jean Verdier, APHP, CINFO, CRNH-IdF, Université Paris Nord, Sorbonne Paris Cité, Bondy
Les auteurs déclarent ne pas avoir de liens d’intérêts en rapport avec cet article.
RÉFÉRENCES
1. Cosson E, Catargi B, Cheisson G, Jacqueminet S, Ichai C, Leguerrier AM, Ouattara A, Tauveron I, Bismuth E, Benhamou D, Valensi P. Practical management of diabetes patients before, during and after surgery: A joint French diabetology and anaesthesiology position statement. Diabetes Metab 2018;44:200-216.
2. Cheisson G, Jacqueminet S, Cosson E, Ichai C, Leguerrier AM, Nicolescu-Catargi B, Ouattara A, Tauveron I, Valensi P, Benhamou D. Perioperative management of adult diabetic patients. Postoperative period. Anaesth Crit Care Pain Med 2018;37 Suppl 1: S27-S30.
3. Kotagal M, Symons RG, Hirsch IB, Umpierrez GE, Dellinger EP, Farrokhi ET, Flum DR; SCOAPCERTAIN Collaborative. Perioperative hyperglycemia and risk of adverse events among patients with and without diabetes. Ann Surg 2015;261: 97-103.
4. Verges B, Avignon A, Bonnet F et al. Consensus statement on the care of the hyperglycaemic/diabetic patient during and in the immediate follow-up of acute coronary syndrome. Diabetes Metab 2012;38: 113-27.
5. Desai SP, Henry LL, Holmes SD, Hunt SL, Martin CT, Hebsur S, Ad N. Strict versus liberal target range for perioperative glucose in patients undergoing coronary artery bypass grafting: a prospective randomized controlled trial. J Thor Cardiovasc Surg 2012;143: 318-25.
6. Bhamidipati CM, LaPar DJ, Stukenborg GJ, Morrison CC, Kern JA, Kron IL, Ailawadi G. Superiority of moderate control of hyperglycemia to tight control in patients undergoing coronary artery bypass grafting. J Thor Cardiovasc Surg 2011;141:543-51.
7. Fish LH, Weaver TW, Moore AL, Steel LG. Value of postoperative blood glucose in predicting complications and length of stay after coronary artery bypass grafting. Am J Cardiol 2003;92:74-6.
8. Gruenbaum SE, Toscani L, Fomberstein KM, Ruskin KJ, Dai F, Qeva E, Rosa G, Meng L, Bilotta F. Severe Intraoperative Hyperglycemia Is Independently Associated With Postoperative Composite Infection After Craniotomy: An Observational Study. Anesth Analg 2017;125:556-561.
9. Sato H, Carvalho G, Sato T, Lattermann R, Matsukawa T, Schricker T. The association of preoperative glycemic control, intraoperative insulin sensitivity, and outcomes after cardiac surgery. J Clin Endocrinol Metab 2010;95:4338-44.
10. Cheisson G, Jacqueminet S, Cosson E, Ichai C, Leguerrier AM, Nicolescu-Catargi B, Ouattara A, Tauveron I, Valensi P, Benhamou D. Perioperative management of adult diabetic patients. Preoperative period. Anaesth Crit Care Pain Med 2018;37 Suppl 1:S9-S19.
11. Kempler P, Amarenco G, Freeman R, Frontoni S, Horowitz M, Stevens M, Low P, Pop-Busui R, Tahrani AA, Tesfaye S, Várkonyi T, Ziegler D, Valensi P; Toronto Consensus Panel on Diabetic Neuropathy. Management strategies for gastrointestinal, erectile, bladder, and sudomotor dysfunction in patients with diabetes. Diabetes Metab Res Rev 2011;27:665-77.
12. Bouvet L, Mazoit JX, Chassard D, Allaouchiche B, Boselli E, Benhamou D. Clinical assessment of the ultrasonographic measurement of antral area for estimating preoperative gastric content and volume. Anesthesiology 2011;114:1086-92.
13. Valensi P, Cosson E. It is not yet the time to stop screening diabetic patients for silent myocardial ischaemia. Diabetes Metab 2010;36:91-6.
14. Valensi P, Pariès J, Brulport-Cerisier V, Torremocha F, Sachs RN, Vanzetto G, Cosson E, Lormeau B, Attali JR, Maréchaud R, Estour B, Halimi S. Predictive value of silent myocardial ischemia for cardiac events in diabetic patients: infl uence of age in a French multicenter study. Diabetes Care 2005;28:2722-7.
15. Young LH, Wackers FJ, Chyun DA et al. Cardiac outcomes after screening for asymptomatic coronary artery disease in patients with type 2 diabetes: the DIAD study: a randomized controlled trial. JAMA 2009;301:1547-55.
16. Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020;41:255-323.
17. Perioperative assessment of cardiac risk patient in non-cardiac surgery. Ann Fr Anesthésie Réanimation 2011;30: e5-29.
18. Berg DD, Wiviott SD, Scirica BM et al. Heart Failure Risk Stratifi cation and Effi cacy of Sodium-Glucose Cotransporter-2 Inhibitors in Patients With Type 2 Diabetes Mellitus. Circulation 2019;140:1569-1577.
19. Valensi P, Meune C. Congestive heart failure caused by silent ischemia and silent myocardial infarction : Diagnostic challenge in type 2 diabetes. Herz 2019;44:210-217.
20. Valensi P, Paries J, Attali JR, French Group for Research and Study of Diabetic Neuropathy. Cardiac autonomic neuropathy in diabetic patients: infl uence of diabetes duration, obesity, and microangiopathic complications–the French multicenter study. Metabolism 2003;52:815-20.
21. Valensi P, Sachs RN, Harfouche B, Lormeau B, Paries J, Cosson E, Paycha F, Leutenegger M, Attali JR. Predictive value of cardiac autonomic neuropathy in diabetic patients with or without silent myocardial ischemia. Diabetes Care 2001; 24:339-43.
22. Spallone V, Ziegler D, Freeman R, Bernardi L, Frontoni S, Pop-Busui R, Stevens M, Kempler P, Hilsted J, Tesfaye S, Low P, Valensi P; Toronto Consensus Panel on Diabetic Neuropathy. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev 2011;27:639-53.
23. Knüttgen D, Trojan S, Weber M, Wolf M, Wappler F. Pre-operative measurement of heart rate variability in diabetics: a method to estimate blood pressure stability during anaesthesia induction. Der Anaesthesist 2005;54:442-9.
24. Huang CJ, Kuok CH, Kuo TB, Hsu YW, Tsai PS. Pre-operative measurement of heart rate variability predicts hypotension during general anesthesia. Acta Anaesthesiol Scand 2006;50:542-8.
25. Lankhorst S, Keet SW, Bulte CS, Boer C. The impact of autonomic dysfunction on peri-operative cardiovascular complications. Anaesthesia 2015;70:336-43.
26. Burgos LG, Ebert TJ, Asiddao C, Turner LA, Pattison CZ, Wang-Cheng R, Kampine JP. Increased
intraoperative cardiovascular morbidity in diabetics with autonomic neuropathy. Anesthesiology 1989;70:591-7.
27. Sobotka PA, Liss HP, Vinik AI. Impaired hypoxic ventilatory drive in diabetic patients with autonomic neuropathy. J Clin Endocrinol Metab 1986;62:658-63.
28. Kitamura A, Hoshino T, Kon T, Ogawa R. Patients with diabetic neuropathy are at risk of a greater intraoperative reduction in core temperature. Anesthesiology 2000;92: 1311-8.
29. Kadoi Y. Anesthetic considerations in diabetic patients. Part I: preoperative considerations of patients with diabetes mellitus. J Anesth 2010; 24:739-47.
30. Martínez-Castelao A, Navarro-González JF, Górriz JL, de Alvaro F. The Concept and the Epidemiology of Diabetic Nephropathy Have Changed in Recent Years. J Clin Med 2015;4:1207-16.
31. Ichai C, Vinsonneau C, Souweine B, et al. Acute kidney injury in the perioperative period and in intensive care units (excluding renal replacement therapies). Anaesthesia Crit Care Pain Med 2016;35:151-65.
32. Bagry HS, Raghavendran S, Carli F, Metabolic syndrome and insulin resistance: perioperative considerations. Anesthesiology 2008;108:506-23.
33. Doenst T, Wijeysundera D, Karkouti K, Zechner C, Maganti M, Rao V, Borger MA. Hyperglycemia during cardiopulmonary bypass is an independent risk factor for mortality in patients undergoing cardiac surgery. J Thor Cardiovasc Surg 2005;130: 1144.
34. van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M,Vlasselaers D, Ferdinande P, Lauwers P, Bouillon R. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345:1359-67.
35. Furnary AP, Gao G, Grunkemeier GL, Wu Y, Zerr KJ, Bookin SO, Floten HS, Starr A.
Continuous insulin infusion reduces mortality in patients with diabetes undergoing coronary artery
bypass grafting. J Thor Cardiovasc Surg 2003;125:1007-21.