
L’insuffisance rénale chronique (IRC) est une problématique importante de santé publique en France. Selon les données du registre REIN 2016, 84 683 personnes avaient une IRC de stade G5 traitée par dialyse (D) ou transplantation (T)1 .
Les données épidémiologiques concernant les stades précoces (G1 à G2), le plus souvent asymptomatiques, sont moins bien connues du fait d’un dépistage non systématique en population générale. Le registre nordaméricain NHANES de 2007 à 2012 retrouve une prévalence de 7,2% de la maladie rénale chronique (MRC, stade G1 à 2) et de 6,55% de l’IRC de stade G3 à 5, soit une prévalence totale de 13,75%2 . En Europe, la prévalence de l’insuffisance rénale chronique (stades G3-G5) est estimée entre 8 et 10% avec une augmentation exponentielle avec l’âge. Dans l’étude du Consortium CKD3 , la prévalence de l’IRC de stades G3- G5 est plus élevée dans les populations à haut risque cardio-vasculaire (14,6 vs. 6,3%). Les maladies cardiovasculaires sont fréquentes chez les patients avec une IRC, et y représentent 50% des causes de décès4 . Inversement, l’IRC constitue un facteur de risque cardiovasculaire indépendant, dès le stade G3. L’étroite interrelation entre systèmes cardio-vasculaire et rénal est illustrée par le large spectre des syndromes cardio-rénaux et réno-cardiaques, notamment de type 2 et 4. Cette interrelation entraîne un cercle vicieux accélérant l’altération des fonctions cardiaque et rénale. La présente revue se propose d’évaluer plus en détail ce lien entre l’IRC et le pronostic cardiovasculaire.
Définition et évaluation de la fonction rénale en milieu cardiologique
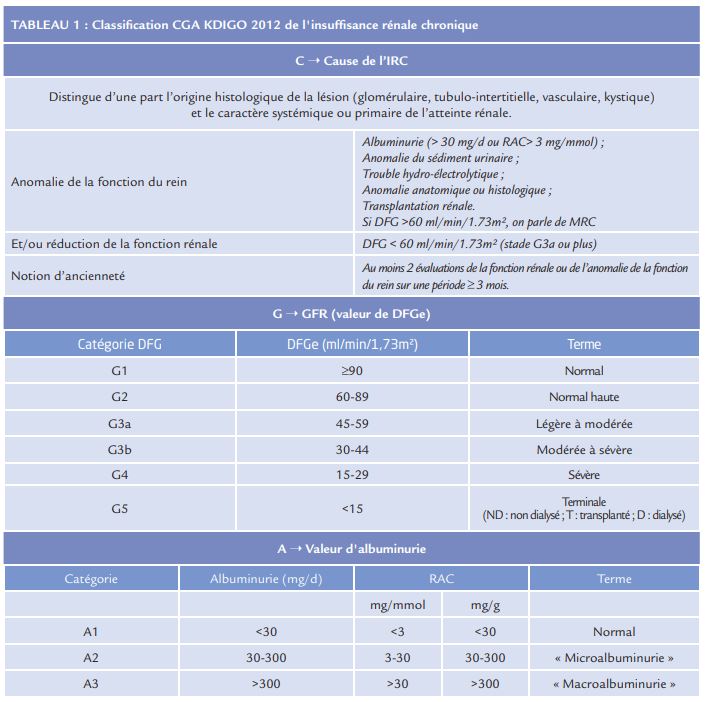
La définition de l’IRC repose sur la classification CGA proposée par les KDIGO en 2012 (Tableau 1). Selon les recommandations de l’HAS et des KDIGO, la quasi-totalité des patients suivis en cardiologie nécessite un dépistage de l’insuffisance rénale, comprenant un dosage de la créatinine plasmatique pour l’estimation du DFG et la mesure du rapport albumine/créatinine
(RAC) sur un échantillon urinaire. L’évaluation du degré d’IRC se fait en routine par une estimation du débit de filtration glomérulaire (DFGe) à partir de la créatinine plasmatique. La relation entre l’IRC et morbi-mortalité cardiovasculaire est évaluée via le DFGe et non par le dosage isolé de la créatinine plasmatique. En accord avec les recommandations internationales, l’HAS recommande l’équation CKDEPI (DFGeCKD-EPI), exprimée en ml/min/1,73m², pour l’évaluation de la fonction rénale à visée de dépistage et de suivi de l’IRC. Paradoxalement, l’HAS préconise toujours la formule de Cockcroft pour l’adaptation des médicaments à la fonction rénale arguant que c’est la formule utilisée pour les RCP5 . Outre le risque de mauvaise interprétation lorsque les résultats des 2 formules sont très différents (plus de 30% des cas), cette recommandation n’est pas fondée car, d’une part la majorité des libellés de RCP ne mentionnent pas le Cockcroft mais d’autres critères mal précisés d’évaluation de la fonction rénale, et, d’autre part, le dosage enzymatique de la créatinine plasmatique, utilisé en France depuis 2012, sous-estime de 10 à 15% la créatinine colorimétrique utilisée par Cockcroft pour établir son équation6-8, 10. Il faut préférer la position de l’Agence Européenne du Médicament (EMA 20169 ) qui recommande le recours au DFGe désindexé (idéalement DFGeCKD-EPI) pour les adaptations de posologie, éventuellement associé à la mesure directe du DFG (51Cr-EDTA, 99mTc-DTPA, Iohexol) dans les situations difficiles. Cette problématique est centrale en cardiologie car près de 63% des médicaments à visée cardiovasculaire10 sont à adapter à la fonction rénale. D’autres écueils existent concernant l’évaluation de la fonction rénale chez le patient en milieu cardiologique :
- Les poids extrêmes rendent inexacte la forme indexée (ml/min/1,73m²) habituelle des formules de DFGe. Il convient dans ces cas-là de réaliser une désindexation à la surface corporelle (DFGe x SC/1,73, en ml/min).
- L’âge > 70 ans (formule DFGeCKD-EPI mal validée après 75 ans) où la formule BIS1 11 est plus exacte.
Au cours de l’insuffisance cardiaque, l’estimation du DFG à partir de la créatinine peut être mise en défaut en raison de l’hémodilution, de l’amyotrophie, de l’inflammation chronique. L’estimation du DFG à partir de la cystatine C est alors une alternative, de même que pour les patients avec une insuffisance rénale modérée (stade G3) sans albuminurie (A1). Le dosage de la cystatine C n’est pas remboursé en France et l’estimation du DFG doit faire appel à la formule validée CKD-EPIcys12. La mesure du DFG (principalement par la clairance de l’iohexol) est plus coûteuse mais peut être utile dans les situations où la connaissance du DFG vrai est importante. L’HAS et la SFNDT préconisent une mesure du DFG chez les patients âgés de plus de 75 ans, les patients de poids extrêmes ou dénutris, les patients ayant une alimentation pauvre en protides (régimes végétariens, traitements conservateurs de l’IRC, etc…). Les recommandations KDIGO élargissent la mesure du DFG à toute situation où le DFGe ne semble pas suffisamment fiable : médicaments à marge thérapeutique étroite, insuffisance cardiaque ou syndromes œdémateux, patient obèse ou anorexique, personne âgée, don d’organe, indications du traitement de suppléance rénale et transplantation d’organes.
Relation entre IRC et pronostic cardiovasculaire
Au stade G5
Au cours des dernières décennies, la morbi-mortalité cardiovasculaire a diminué dans la population générale, cette relation n’est cependant pas retrouvée chez les patients au stade de suppléance rénale (REIN 2017). Les décès d’origine cardiovasculaire sont la 1ère cause de mortalité (23%) chez le patient débutant un traitement de suppléance, bien loin devant la pathologie rénale en elle-même (0,4%). La prévalence des maladies cardiovasculaire chez ces patients est assez bien connue à partir du registre national REIN (REIN 2017). A l’initiation du traitement de suppléance, 47% des patients incidents ont un diabète et 60% ont au moins une comorbidité cardiovasculaire associée (pathologie coronarienne, insuffisance cardiaque, trouble du rythme, artériopathie chronique oblitérante des membres inférieurs, anévrisme de l’aorte abdominale, AVC), 25% sont obèses et 43% sont tabagiques (dont 10% de tabagisme actif). Ces prévalences sont bien supérieures à celles de la population générale. Aux USA, l’étude HEMO13 retrouve une prévalence des maladies cardiovasculaires de l’ordre de 80% chez des patients hémodialysés prévalents.
Aux stades pré-suppléance, G1 à G4
Aux stades moins avancés de l’IRC, il existe aussi un excès de risque cardiovasculaire, à tel point que la plupart des patients avec une IRC modérée ont une probabilité plus forte de décéder d’une maladie cardio-vasculaire que de débuter un traitement de suppléance14, 15. Schématiquement, le risque cardiovasculaire excède le risque rénal dans tous les cas sauf chez les sujets de moins de 55 ans, avec un DFGe < 30 ml/min/1,73 et une protéinurie abondante14.
L’étude HOPE16, évaluant 9 297 patients à très haut risque
cardio-vasculaire (RCV), dont 3 394 avec un DFGe < 65 ml/min/1,73m², retrouvait une incidence d’événements combinés (décès, infarctus du myocarde, AVC) significativement plus élevée chez les patients ayant une IRC stade G3 (55 vs 36 évènements ‰ patients/années). Le risque cardiaque était proportionnel à l’augmentation de la créatinine plasmatique et indépendant de tous les autres facteurs de risque cardiovasculaires (FDRCV) et du traitement.
L’étude VALIANT17, a évalué 14 527 patients à haut RCV, parmi lesquelles 33% avaient un DFGe < 60 ml/ min/1,73m² (créatininémie maximale à 221 µmol/L). Plus le DFGe était abaissé, plus ces patients avaient une prévalence importante de FDRCV et de maladie cardiovasculaire, contrastant avec un moindre recours à un traitement cardiologique optimal. Au cours du suivi, la diminution du DFGe de 10 ml/min/1,73/ m² augmente de 10% le risque de décès ou de nouvel évènement cardio-vasculaire.
Cet accroissement de 10-15% du risque par palier de diminution du DFGe de 10 ml/min/1,73/m² est également retrouvé dans les registres NordAméricains18, notamment la Cardiovascular Health Study et la Kaiser Permanente, mais également Européens19. L’augmentation du risque débute aux premiers stades de l’IRC (dès DFG < 75 ml/min/1,73m² et/ou un rapport albumine/créatinine urinaire > 5 mg/g15), et s’accentue pour un DFGe < 45 ml/min/1,73m² (RR ajusté de mortalité et d’évènement cardiovasculaire passant respectivement de 1,2 et 1,4 à 1,8 et 2 entre les stades G3a et G3b), indépendamment de l’HTA ou du diabète15. Ceci se traduit par une perte d’espérance de vie en lien avec les maladies cardiovasculaires d’autant plus importante que le patient est jeune et qu’il a un DFGe abaissé, et/ou une albuminurie élevée15.
La relation précoce entre les évènements cardiovasculaires et le DFGe, dès le stade G2, est illustrée par le registre NHANES20 (Tableau 2), ou encore l’étude de la Kaiser Permanente chez 1,1 million d’individus21.
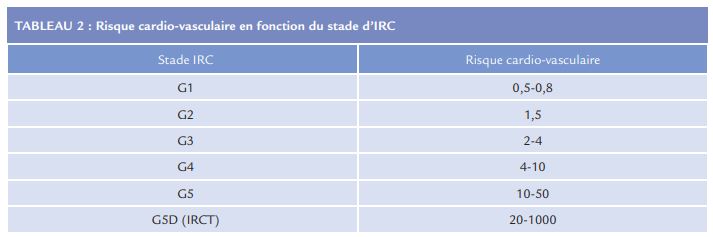
Cette étude objective un excès de risque d’évènement cardiovasculaire de 43% en cas d’IRC de stade G3b et jusqu’à 343% en cas d’IRC de stade G5 comparé à un
groupe témoin avec un DFG normal. Dans une méta-analyse chez 40 000 patients atteints d’insuffisance cardiaque, l’IRC représente un facteur de risque majeur, au même titre que l’âge, la FEVG, la présence d’un diabète de type 2, ou le stade NYHA22. Le ratio albuminurie/créatininurie est également associé à un risque accru d’insuffisance cardiaque23. L’ensemble de ces éléments doit amener à considérer le patient avec une IRC comme ayant un RCV élevé (stade G3) ou très élevé (stades G4-G5).
Hypothèses physiopathologiques
La relation entre IRC et complications cardiovasculaires est complexe et multifactorielle. Cette relation est liée en partie à la haute prévalence de FRCV partagés (diabète, HTA, dyslipidémie) responsables d’athérome et d’artériosclérose. Parmi les patients incidents avec une IRC de stade G5D, 23% ont une néphropathie vasculaire hypertensive et 24-47% une néphropathie diabétique. L’association précoce entre fonction rénale, albuminurie et le RCV étant indépendante des autres FDRCV15, 18-23, il existe d’autre facteurs de risque spécifiques à l’IRC24 (Tableau 3) ou à la transplantation rénale (hypercholestérolémie, hypercoagulabilité, HTA, immunosuppresseurs).
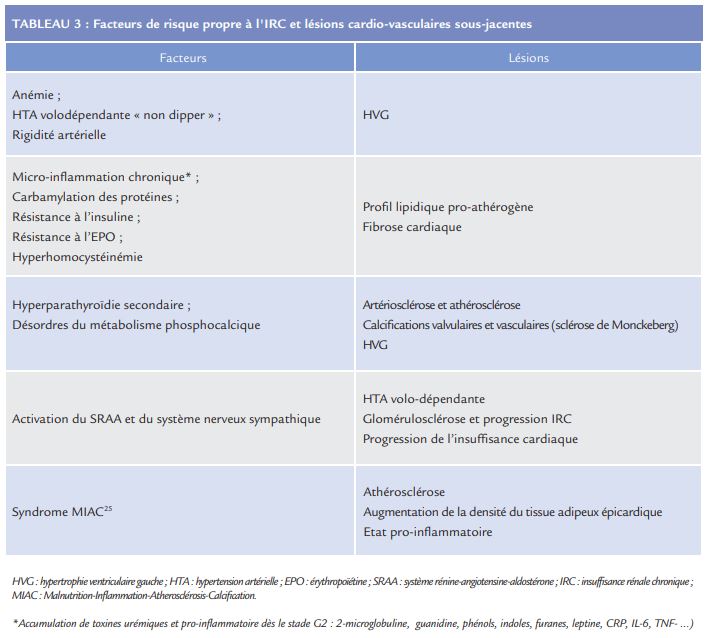
Ces facteurs expliquent au moins en partie l’importante mortalité chez ces patients, par mort subite et insuffisance cardiaque. Il est également noté une prévalence accrue d’arythmies cardiaques par fibrillation auriculaire, de tachycardies ventriculaires et de morts subites, notamment chez les patients au stade de suppléance (G5D). Outre le terrain cardiovasculaire sous-jacent, les variations volémiques et ioniques rapides induites par l’hémodialyse entraînent une dysfonction mécanique et électrique des cardiomyocytes expliquant ces orages rythmiques. Un autre facteur à prendre en compte est le nihilisme thérapeutique chez ces patients17, 26-29 soit par crainte de la iatrogénie (produits de contraste, IEC/ARA2, procédure de revascularisation) soit par crainte d’un surdosage du fait de l’altération de la fonction rénale (diurétiques, HBPM, anticoagulants directs, anti-arythmiques, etc.). Dans l’étude de la cohorte Alberta30, le risque d’événement coronarien des patients avec une IRC est légèrement inférieur à celui des patients ayant déjà présenté un syndrome coronarien aigu (prévention secondaire) mais est supérieur à celui des patients diabétiques sans atteinte rénale. En revanche, la mortalité des patients avec une IRC est plus du double de celle des patients ayant déjà présenté un évènement coronarien aigu. L’association de l’âge et du diabète à l’insuffisance rénale chronique sont les deux facteurs influençant le plus le risque coronarien.
Impact thérapeutique
L’association forte réciproque entre RCV et fonction rénale implique une prise en charge des FRCV classiques mais également des facteurs de risque propres à l’IRC (Tableau 4). Les cibles de contrôle correspondent à celle d’un RCV élevé (intensification tensionnelle, statine, cibles glycémiques) et parfois sont spécifiques à l’IRC (correction de l’anémie et de l’hyperphosphatémie). Les règles classiques de néphroprotection (contrôle de la protéinurie par des bloqueurs du système rénine-angiotensine-aldostérone, de la rétention sodée par les diurétiques), sont également de rigueur. En pratique, une collaboration étroite entre le cardiologue et le néphrologue est nécessaire pour optimiser la prise en charge de ces patients. Le recours aux équations de risque comme aide à la décision.
Le recours aux équations de risque comme aide à la décision
Bien qu’une dysfonction même modérée de la fonction rénale augmente le RCV de façon équivalente au diabète, aucune équation pour l’évaluation du RCV n’inclut la fonction rénale dans ses paramètres. Chia et al47 ont montré que l’intégration du DFGe au score de Framingham permet de reclasser les patients à risque coronarien moyen vers un risque élevé mais ne change pas fondamentalement la classification des patients à risque faible ou déjà élevé. L’utilisation de l’équation de score de risque rénal (KFRE)48, à partir du stade G3, permet d’évaluer la probabilité à 2 et 5 ans d’évoluer vers un traitement de suppléance. L’équation du Consortium CKD (kdigo.org/ equation), publiée plus récemment, est une aide précieuse pour affiner les risques respectifs de décès, d’événements cardiovasculaires ou d’évolution vers l’IRC terminale à 2 et 4 ans3 .
Elle permet également une analyse individualisée de la survie compétitive entre le décès d’origine rénale, cardiovasculaire et toute cause, avec un impact direct sur la prise en charge et les mesures thérapeutiques à prioriser, y compris l’indication du traitement de suppléance. Par exemple, à partir de 85 ans le risque de décès cardiovasculaire dépasse le plus souvent celui de débuter un traitement de suppléance14. Dans ces conditions, il n’est pas nécessaire de préparer futilement le patient à une technique de suppléance.
Conclusion
Le DFGe est un index de santé cardiovasculaire, en termes épidémiologiques, au niveau de la population, mais aussi chez chaque patient au niveau individuel. L’intrication fréquente des maladies cardiovasculaires et rénales est bidirectionnelle et affecte défavorablement le pronostic. Les équations de risque permettent d’affiner les risques compétitifs chez ces patients et d’adapter en conséquence les stratégies de prise en charge.
Nicolas Keller, Eric Prinz, Thierry Hannedouche – Service de néphrologie et dialyse,
Nouvel Hôpital Civil, Strasbourg, France
L’auteur déclare ne pas avoir de liens d’intérêts en relation avec cet article.
RÉFÉRENCES
1. R.E.I.N. (Réseau Epidémiologique et Information en Néphrologie) – Agence de la biomédecine [Internet]. 2012 [cité 20 mai 2018]. Disponible sur: https://www.agence-biomedecine.fr/Le-programme-REIN
2. U.S.R.D.S. (United States Renal Data System) 2014 [Internet]. [cité 20 mai 2018]. Disponible sur: https://www.usrds.org/2014/download/V1_Ch_01_GenPop_14.pdf
3. Eckardt KU, Bansal N, Coresh J, et al. Conference participants. Improving the prognosis of patients with severely decreased glomerular fi ltration rate (CKD G4+): conclusion from KDIGO controversies
conference. Kidney Int 2018; 93: 1281-1292.
4. Heywood JT, et al. ADHERE Scientifi c advisory committee and investigators. High prevalence of renal dysfunction and its impact on outcome in 118.465 patients hospitalized with acute decompensated
heart failure: a report from the Adhere database. J Card Fail 2007; 13 : 422-430
5. HAS (Haute Autorité de SAnté) – évaluation du débit de fi ltration glomérulaire et du dosage de la créatininémie dans le diagnostic de la maladie rénale chronique de l’adulte. [Internet]. [cité 20
mai 2018]. Disponible sur: https://www.has-sante.fr/portail/upload/docs/application/pdf/2012-10/evaluation_du_debit_de_fi ltration_glomerulaire_et_du_dosage_de_la_creatininemie_dans_le_
diagnostic_de_la_maladie_renale_chronique_chez_ladulte_-_fi che_buts.pdf
6. Stevens LA, Nolin TD, Richardson MM, Feldman HI, Lewis JB, Rodby R, et al. Comparison of drug dosing recommendations based on measured GFR and kidney function estimating equations. Am
J Kidney Dis Off J Natl Kidney Found. 2009; 54:33-42.
7. Naud J, Michaud J, Beauchemin S, Hébert M-J, Roger M, Lefrancois S, et al. Effects of chronic renal failure on kidney drug transporters and cytochrome P450 in rats. Drug Metab Dispos Biol Fate
Chem. 2011; 39:1363-9.
8. Delanaye P, et al. Adaptation posologique des médicaments et fonction rénale : quel(s) estimateur(s) faut-il choisir ? Néphrol Ther. 2015; 12 :18-31
9. EMA (European Medicines Agency) – Guideline on the evaluation of the pharmacokinetics of medicinal products in patients with decreased renal function. [Internet]. [cité 21 mai 2018]. Disponible sur :
http://www.ema.europa.eu/docs/en_GB/document_library/Scientifi c_guideline/2016/02/WC500200841.pdf
10. Keller N, Ruppert M, Fourtage M, Hannedouche T. Médicaments du système cardiovasculaire et fonction rénale : vers une nécessité d’uniformiser les adaptations posologiques ? Néphrologie et
thérapeutique. 2019 ; 15 : 97-103.
11. Schaeffner ES, et al. Two novel equations to estimate kidney function in persons aged 70 years or older. Ann Intern Med 2012; 157:471-81
12. Shlipak MG, Coresh J, Gansevoort RT. Cystatin C versus creatinine for kidney function-based risk. N Engl J Med 2013; 19.
13. Foley RN, et al. The prognosis importance of left ventricular geometry in uremic cardiomyopathy. J Am Soc Nephrol 1995; 5 : 2024-31
14. O’Hare AM, et al. Age affects outcomes in chronic kidney disease. J Am Soc Nephrol 2007; 18: 20758-65.
15. Gansevoort RT, et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms and prevention. Lancet 2013; 382 : 339-52
16. Heart Outcomes Prevention Evaluation Study Investigators. Effects of angiotension-converting-enzyme inhibitor, ramipril, on cardiovascular events in high risk patients. N Engl J Med 2000; 342 : 145-53
17. Anavekar NS, et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med 2004; 351: 1285-95.
18. Stevens LA, et al. Prevalence of CKD and comorbid illness in elderly patients in the US; results from the KEEP. AM J Kidney Dis 2010; 55 : S23-33
19. Van Biesen W, et al. The glomerular fi ltration rate in an apparently healthy population and its relation with cardiovascular mortality during 10 years. Eur Heart J 2007; 28: 478-83.
20. Garg AX. Moderate renal insuffi ciency and the risk of cardiovascular mortality : result from the NHANES I. Kidney Int 2002;61 : 1486-94
21. Go AS, et al. CKD and the risks of death, cardiovascular events, and hospitalization. N Engl J Med (2004); 351: 1296-1305.
22. Pocock SJ, et al. Meta-analysis global group in chronic heart failure (MAGGIC). Predicting survival in heart failure: a risk score based on 39.372 patients from 30 studies. Eur Heart J 2013; 34: 1404-1413.
23. Waheed S, et al. Combined association of albuminuria and Cystatin C-based estimated GFR with mortality, coronary heart disease, and heart failure outcomes: the ARIC study. Am J Kidney Dis 2012; 60:207-2016.
24. Di Lullo L, et al. Chronic kidney disease and cardiovascular complications. Heart Fail Rev 2015; 20: 259-72.
25. Ref Stenvinkel P, et al. Malnutrition, infl ammation and atherosclérosis in peritoneal dialysis patients. Perit Dial Int 2001; 21 :157-162.
26. Szummer K, et al. SWEDEHEART. Relation between renal function, presentation, use of therapies and in-hospital complications in acute coronary syndrome: data from the SWEDEHEART register.
J Intern Med 2010; 268:40-49.
27. Asim M et al. Management of acute coronary syndrome in patients with CKD: if we don’t risk anything, we risk even more. Nephron Clin Pract 2011;119:c133-36
28. Ashrith G, et al. Short and long-term outcomes of coronary artery bypass grafting or drug-eluting stent implantation for multivessel coronary artery disease in patients with CKD. Am J Cardiol 2010; 106: 348-53.
29. Fow CS, et al. Use of evidence-based therapies in short-outcomes on ST-segment elevation myocardial infarction in patients with CKD; a report from the national cardiovascular data acute coronary
treatment and intervention outcomes network registry. Circulation 2010; 121: 357-65.
30. Tonelli M, et al. Alberta Kidney Disease Network. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study. Lancet 2012; 380: 807-14.
31. Cheung Ak, et al. SPRINT Research Group. Effects of intensive BP control in CKD. J Am Soc Nephrol 2017; 28: 2812-23.
32. Jafar, et al. Angiotensin-converting enzyme inhibitor and progression of nondiabétic renal disease. A meta-analysis of patient-level data. Ann Intern Med 2001;135:73-87 De ZeeuW D. CKD
Treatment: time to alter the focus to albuminuria? Adv Chronic Kidney Dis. 2011;18:222-23.
33. Brenner BM, et al. Effect of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy avec le Losartan. N. Engl J Med 2001; 345 :861-9.
34. Lewis EJ, et al. Renoprotective effect of the angiotensin-receptor antagonist Irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345 :851-60
35. Lesogor A, et al. Interaction between baseline and early worsening of renal function and effi cacy of renin-angiotensin-aldosterone system blockade in patients with heart failure: insights from the ValHeFT study. Eur J Heart Fail 2013; 15 :1236-44.
36. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the cooperative north Scandinavian enalapril survival study. N. Engl J. Med 1987; 316:1429-1435.
37. Mach F, et al. ESC Scientifi c Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias : lipid modifi cation to reduce cardiovascular risk. Eur Heart J 2020; 41: 111-188.
38. Baigent C, et al. SHARP Investigators. The effects of lowering LDLc with simvastatin plus ezetimibe in patients with chronic kidney disease: a randomized placebo-controlled trial. Lancet 2011; 377: 2181-92.
39. Ridker PM, et al. JUPITER Trial Study Group. Baseline characteristics of participants in the JUPITER trial, a randomized placebo-controlled primary prevention with statin therapy among individuals
with low low-density lipoprotein cholesterol and elevated high sensitivity C-reactive protein. Am J Cardiol 2007; 100: 1659-64.
40. Wanner C, et al. 4-D Trial. Atorvastatin in patient with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005; 353 :238-248.
41. Fellstrom BC, et al. AURORA Trial. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med 2009; 360: 1395-1407.
42. Drueke TB, et al. Normalisation of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med 2006; 355:2071-2084.
43. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney Int Suppmts 2012; 2.
44. EVOLVE Trial investigator. Effects of cinacalcet on cardiovascular disease in patients undergoing dialysis. N Engl J Med 2012; 367: 2482-2494.
45. Di Lullo, et al. Progression of cardiac valve calcifi cation and decline of renal function in CKD patients. J Nephrol 2013; 26: 739-744.
46. Palmer SC, et al. Effects of antiplatelet therapy on mortality and cardiovascular and bleeding outcomes in persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern med
2012; 156: 445-59.
47. Chia YC, et al. Use of chronic kidney disease to enhance prediction of cardiovascular risk in those at medium risk. PLoS One 2015; 10.
48. Tangri N, et al. Multinational assessment of accuracy of equations for predicting risk of kidney failure: a meta-analysis. JAMA 2016; 315: 164-74.
49. KDIGO. (Kidney Disease Improving Global Outcomes) – Site KDIGO [Internet]. 2020 [cité 28 février 2020]. Disponible sur: https://www.kdigo.org/guidelines/
