
Triglycérides et risque cardiovasculaire : où en est-on ?
Alors que l’hypertriglycéridémie sévère est une cause bien établie de pancréatite, la participation d’une élévation modérée des triglycérides (TG) dans le risque cardiovasculaire a été longtemps l’objet de nombreuses controverses.
En effet, même si une hypertriglycéridémie est très fréquente chez les patients avec maladie cardiovasculaire athéromateuse, il a été difficile d’établir un lien de causalité pour de nombreuses raisons incluant la grande variabilité du paramètre TG et le fait que les associations entre TG élevés et risque cardiovasculaire trouvées en analyses univariées souvent disparaissaient après ajustement multivarié. De plus une élévation des TG est souvent présente chez les patients qui ont d’autres facteurs de risque fréquents comme le diabète de type 2, l’obésité abdominale et l’insulinorésistance, circonstances où TG élevés sont associés classiquement avec une baisse du taux de HDL-cholestérol (HDL-C) et la présence de LDL petites et denses athérogènes, si bien que l’élévation des TG a été pendant longtemps considérée comme un simple marqueur. Enfin, l’explication physiopathologique du rôle des TG dans le risque d’athérosclérose restait mal définie.
Ces dernières années, de nombreuses avancées, tant sur le plan physiopathologique que sur le plan de données épidémiologiques, génétiques et enfin issues d’essais cliniques ont remis à l’honneur les TG, ou plutôt les lipoprotéines riches en TG (LP-riches-TG) et cet article se propose de résumer de façon succincte les connaissances récentes sur la régulation de ces LP-riches-TG et les arguments en faveur d’un rôle dans le risque des maladies cardiovasculaires liées à l’athérosclérose.
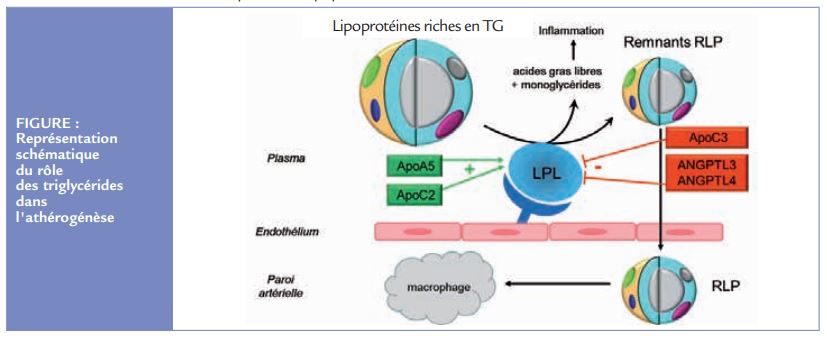
Les LP-riches-TG qui regroupent les lipoprotéines de très basse densité (VLDL) et les chylomicrons synthétisés et sécrétés respectivement par le foie et l’entérocyte sont des particules le plus souvent trop larges pour franchir l’endothélium vasculaire. Mais ces LP-riches-TG s’hydrolysent sous l’influence de la lipoprotéine lipase (LPL) et ce sont les remnants (RLP) générés par cette hydrolyse qui participent au développement de l’athérosclérose par leur possibilité de pénétrer dans l’intima artériel avec de plus, lors de l’hydrolyse, libération d’acides gras libres et de monoglycérides qui induisent une inflammation vasculaire 1 (Figure).
De nombreux facteurs interviennent dans le métabolisme des LP-riches-TG et dans la régulation de l’activité de la LPL : alors que les apolipoprotéines C2 et A5 favorisent l’activité LPL, à l’opposé l’apolipoprotéine C3 et les protéines secrétées de la famille des angiopoietin-like ANGPTL3 et ANGPTL4 sont des inhibiteurs de l’activité LPL1,2 (Figure). Des données génétiques récentes décrites ultérieurement illustrent bien le rôle de ces régulateurs de l’activité LPL.
Un excès de LP-riches-TG intervient donc dans le processus d’athérosclérose essentiellement d’une part par l’induction d’une l’inflammation et d’autre part par le contenu en cholestérol des remnants athérogènes (RLP-C). Mais le dosage du RLP-C n’est pas réalisable en pratique quotidienne. Par contre cette notion est en faveur de l’utilisation du paramètre non-HDL-cholestérol (non-HDL-C) qui correspond à la somme du LDL-C et du RLP-C, pour évaluer l’ensemble des lipoprotéines athérogènes et qui est aisément calculé : Non-HDL-C = cholestérol total – HDL-C
LP-riches-TG et athérosclérose : arguments épidémiologiques
Une association entre élévation des TG à jeun ou non à jeun et risque de maladie cardiovasculaire liée à l’athérosclérose a été mise en évidence dans de nombreuses études et métaanalyses, mais le fait qu’après ajustement pour le nonHDL-C, cette association était amoindrie ou disparaissait, a= parfois conduit à conclure que la mesure des TG n’apportait pas d’information complémentaire, alors que justement dans le non-HDL-C, on tient compte des remnants. De fait, le rôle du RPL-C dans le risque d’athérosclérose a été bien établi à partir de plusieurs études épidémiologiques 1,3. Ainsi dans les études de Copenhague, des taux élevés de RLP-C évalués non à jeun sont associés au risque cardiovasculaire et également à la mortalité de toute cause, indépendamment de la réduction du taux de HDL-C. De plus, dans des données danoises récentes, chez plus de 58 000 individus âgés de 40 à 65 ans, en prévention primaire, sans diabète, le risque cardiovasculaire des patients non éligibles à un traitement par statine a été évalué en fonction du taux de TG non à jeun : 7% de la population avait un taux de TG ≥ 3 mmol/l (2,64 g/l) avec un risque d’évènement cardiovasculaire majeur environ 2 fois plus important par rapport à ceux avec TG < 3 mmol/l 4.
Mais chez les patients éligibles à un traitement par statine, ce traitement est recommandé en 1ère intention même en présence d’une élévation modérée des TG et il était donc important d’avoir des arguments en faveur d’un risque résiduel lié à un excès de LP-riches-TG chez des patients traités par statine.
LP-riches-TG et athérosclérose : arguments venant des essais de prévention cardiovasculaire avec les statines
Plusieurs analyses complémentaires d’essais de prévention par les statines (en général analyses post-hoc) montrent que le taux de TG est un prédicteur du risque cardiovasculaire résiduel5 : dans PROVE-IT les patients avec TG ≥ 1,50 g/l ont un risque cardiovasculaire augmenté de 27% par rapport à ceux avec TG < 1,50 g/l, avec des données comparables dans une analyse poolée des essais TNT et IDEAL. Le même type de conclusion émerge d’essais réalisés chez des patients avec syndrome coronaire aigu traités par statine dans MIRACL et Dal-Outcomes. Dans une analyse complémentaire de l’étude TNT, le taux de RLP-C est directement associé à une augmentation du risque d’évènements cardiovasculaires dans le groupe atorvastatine 10 mg. Le bénéfice de la forte dose d’atorvastatine (80 mg) est par ailleurs plus important lorsque le RLP-C est élevé. Toutes ces données militent en faveur de l’utilisation du non-HDL-C comme objectif secondaire lorsqu’il existe une élévation des TG comme indiqué dans les recommandations récentes6. De fait, dans une méta-analyse de 8 essais utilisant des statines, le risque cardiovasculaire résiduel chez les patients traités par statine et atteignant un LDL-C < 1,0 g/l est significativement plus élevé (+32%) chez les patients avec un non-HDL-C ≥ 1,30 g/l par rapport à ceux avec non-HDL-C < 1,30 g/l. Enfin, au-delà des essais randomisés, plusieurs études de cohortes récentes ont également retrouvé des associations entre élévation des TG et risque cardiovasculaire, souvent en se focalisant sur les individus qui correspondent aux critères d’inclusion de l’étude REDUCE-IT, premier essai randomisé réalisé chez des patients avec TG élevés et LDL-C contrôlé sous traitement par statine. Ainsi, dans la cohorte CANHEART, chez des patients en prévention secondaire, et par comparaison aux individus avec TG < 1,0 mmol/l (0,89 g/l), une augmentation des TG est associée avec un risque progressivement accru d’évènements cardiovasculaires liés à l’athérosclérose 7.
Mais les évidences pour un rôle causal des LP-richesTG proviennent surtout de données génétiques.
LP-riches-TG et athérosclérose : arguments provenant d’études génétiques
Dès 2013, à partir de données génétiques issues des études de Copenhague, il avait été rapporté qu’une augmentation de 1 mmol/l (0,39 g/l) de RLP-C était associée à un risque de maladie cardiovasculaire ischémique 2,8 fois plus important, indépendamment d’une réduction du HDL-C, élément en faveur d’un rôle causal du RLP-C dans le processus d’athérosclérose1.
Les études génétiques réalisées sur les régulateurs clés de l’activité LPL confirment ce rôle causal : des mutations « perte de fonction » de l’apoA5 sont associées à une augmentation des LPL-riches-TG et du risque d’infarctus du myocarde (IDM). A l’opposé des mutations « perte de fonction » de l’apoC3 ou des protéines ANGPTL3 et ANGPTL4 sont associées à une diminution du taux LPL riches-TG et du risque d’IDM, ce qui milite en faveur du développement d’inhibiteurs de l’apoC3 et des ANGPTL3 ou ANGPTL4 pour réduire le risque cardiovasculaire. Enfin, deux études ont évalué l’effet simultané d’allèles abaissant le LDL-C et activant la LPL8,9. Les allèles activant la LPL réduisent effectivement les TG, le risque coronaire et le risque de diabète. Surtout lorsqu’il existe simultanément des allèles abaissant les taux de LDL-C et de TG, l’effet apparait additif sur le plan de la prévention de la maladie coronaire, autre argument suggérant que le risque résiduel observé sous traitement par statine chez des patients avec TG élevés devrait pouvoir être réduit en agissant sur les LP-riches-TG.
Approches thérapeutiques pour réduire le risque cardiovasculaire associé aux TG
Les mesures d’hygiène de vie, incluant la diététique, l’exercice physique, la réduction de la consommation d’alcool et la perte de poids si nécessaire sont les principes de base fondamentaux dans la prise en charge d’une élévation des TG. Au-delà de ces mesures hygiéno-diététiques, peu de stratégies thérapeutiques médicamenteuses sont validées en prévention cardiovasculaire car un seul essai, REDUCEIT, a été spécifiquement réalisé chez des patients traités par statine avec élévation résiduelle des TG 10.
Effectivement dans l’étude REDUCE-IT, l’apport de 4 g/ jour d’icosapent-ethyl (qui correspond à l’EPA purifié) chez des patients soit en prévention secondaire, soit avec diabète et un autre facteur de risque, traités par statine, ayant des TG entre 1,50 et 5,0 g/l, a permis de réduire significativement les évènements cardiovasculaires majeurs avec un bénéfice qui n’apparait d’ailleurs pas lié uniquement à l’évolution favorable des TG. L’utilisation d’EPA à la dose de 4 g/jour est indiquée dans les recommandations européennes 6 , mais ce dérivé n’est pas encore disponible en France. Dans ces mêmes recommandations, il est proposé d’associer le fénofibrate (ou le bézafibrate) à un traitement par statine chez des patients à haut risque cardiovasculaire pour lesquels persiste une augmentation des TG et donc du nonHDL-C. Cette proposition est issue d’une analyse préspécifiée de sous-groupes de l’étude ACCORD-Lipid, mais nous manquons d’études spécifiques pour valider définitivement l’utilisation d’un fibrate. En tout cas le gemfibrozil ne pourra pas être utilisé en association avec une statine en raison d’une interaction médicamenteuse avec risque de rhabdomyolyse. Un nouveau dérivé, le pémafibrate, modulateur sélectif des PPARα, est en cours d’évaluation dans l’étude de prévention PROMINENT chez des patients diabétiques, traités par statine et ayant des TG élevés associés à un HDL-C bas. Enfin, d’autres approches thérapeutiques plus spécifiques et suggérées par les données génétiques sont en développement, comme un inhibiteur de l’apoC3 ou un inhibiteur de ANGPTL3 2.
Mais ces stratégies devront être validées par des études de prévention cardiovasculaire.
Conclusion
De nombreux arguments épidémiologiques et génétiques récents sont en faveur d’un rôle athérogène lié à un excès de LP-riches-TG. Le rôle athérogène est beaucoup plus dépendant du contenu en cholestérol des produits d’hydrolyse de ces lipoprotéines (ou remnants) que du taux de TG en lui-même. Les LP-riches-TG participent également de façon importante au processus inflammatoire. Plusieurs stratégies thérapeutiques sont en cours de développement pour essayer de réduire le risque cardiovasculaire résiduel lié à un excès de LP-riches-TG chez des patients traités par statine. Pour l’instant seule l’étude REDUCE-IT a montré un effet bénéfique en prévention cardiovasculaire par l’utilisation d’une forme particulière d’acides gras oméga-3 (EPA) à forte dose.
Michel Farnier
Equipe PEC2, EA 7460, Université de Bourgogne Franche-Comté, et Service de Cardiologie, CHU Dijon Bourgogne, Dijon
Le docteur Michel Farnier déclare avoir reçu des honoraires en tant qu’investigateur, expert scientifique et/ou conférencier de la part des firmes suivantes : Abbott, Akcea/Ionis, Amarin, Amgen, Daïchi-Sankyo, Kowa, Merck and Co, Mylan, Pfizer, Sanofi/Regeneron et Servier
RÉFÉRENCES
1. Nordestgaard BG. Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: new insights from epidemiology, genetics, and biology. Circ Res 2016; 118: 547-63.
2. Laufs U, Parhofer KG, Ginsberg HN, Hegele RA. Clinical review on triglycerides. Eur Heart J 2020; 41: 99-109.
3. Sandesara PB, Virani SS, Fazio S, Shapiro MD. The forgotten lipids: triglycerides, remnant cholesterol, and atherosclerotic cardiovascular disease risk. Endocr Rev 2019; 40: 537-57.
4. Madsen CM, Varbo A, Nordestgaard BG. Unmet need for primary prevention in individuals with hypertriglyceridaemia not eligible for statin therapy according to European Society of Cardiology/European Atherosclerosis Society guidelines: a contemporary population-based study. Eur Heart J 2018; 39: 610-9.
5. Vallejo-Vaz AJ, Corral P, Schreier L, Ray KK. Triglycerides and residual risk. Curr Opin Endocrinol Diabetes Obes 2020; 27: 95-103.
6. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41: 111-88.
7. Lawler PR, Kotrri G, Koh M, Goodman SG, Farkouh ME, Lee DS, et al. Real-world risk of cardiovascular outcomes associated with hypertriglyceridaemia among individuals with atherosclerotic cardiovascular disease and potential eligibility for emerging therapies. Eur Heart J 2020; 41: 86-94.
8. Ference BA, Kastelein JJP, Ray KK, Ginsberg HN, Chapman MJ, Packard CJ, et al. Association of triglyceride-lowering LPL variants and LDL-C-lowering LDLR variants with risk of coronary heart disease. JAMA 2019; 321: 364-73.
9. Lotta LA, Stewart ID, Sharp SJ, Day FR, Burgess S, Luan J, et al. Association of genetically enhanced lipoprotein lipase-mediated lipolysis and low-density lipoprotein cholesterol-lowering alleles with risk of coronary disease and type 2 diabetes. JAMA Cardiol 2018; 3: 957-66.
10. Bhatt DL, Steg PG, Miller M, Brinton EA, Jacobson TA, Ketchum SB, et al.; REDUCE-IT Investigators. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med. 2019; 380: 11-22.
