
Lipoprotéine(a) : que faut-il savoir ?
Découverte il y a plus de 50 ans, la lipoprotéine(a) ou Lp(a) connait un regain d’intérêt ces dernières années depuis que des données épidémiologiques et génétiques ont mieux précisé le risque associé à un excès de Lp(a) et surtout en raison d’espoirs thérapeutiques récents pour agir sur ce paramètre jusqu’alors non accessible par les moyens thérapeutiques hormis l’aphérèse.
Une prévalence élevée, mais méconnue
La prévalence de taux élevés de Lp(a) est importante en population générale et ce paramètre est en fait le facteur de risque cardiovasculaire monogénique le plus fréquent. En prenant la norme habituelle d’un laboratoire (Lp(a) < 30 mg/dl ou 75 nmol/l), 20 à 30% de la population est au-delà de ce seuil1 . Dans une large population américaine1 , 10% des individus avait un taux > 90 mg/dl et 1% > 180 mg/dl. Dans un travail récent évaluant la prévalence chez des patients hospitalisés pour infarctus du myocarde (IDM), les 10% des patients au-delà du 90° percentile (> 80 mg/dl) étaient caractérisés par une maladie coronaire plus extensive2. Ainsi, alors que la prévalence est plus importante que l’hypercholestérolémie familiale (HF) hétérozygote, peu d’attention clinique a été jusqu’alors portée à ce paramètre par comparaison aux efforts accomplis pour identifier et traiter les patients avec HF.
Une structure moléculaire spécifique complexe
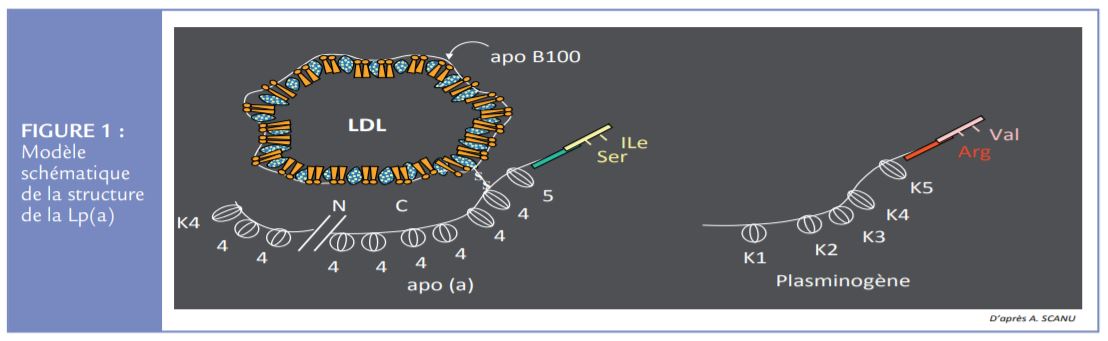
Les particules Lp(a) correspondent à l’assemblage de 2 composants majeurs et distincts : d’une part une
structure voisine d’une particule LDL contenant une seule molécule d’apolipoprotéine B (apoB100) et d’autre
part une protéine spécifique, l’apolipoprotéine(a) ou apo(a), glycoprotéine liée de façon covalente par
un pont disulfide à la molécule d’apoB. La Lp(a) est une lipoprotéine riche en cholestérol, contenant en termes de masse entre 30 et 45% de cholestérol. La structure de l’apo(a) évoque celle du plasminogène, mais alors que le plasminogène est composé de 5 kringles et d’un domaine protéase actif, l’apo(a) ne contient pas les kringles K-I, K-II et K-III, avec un nombre variable de kringle K-IV-2, une copie de K-V et une protéase inactive. En raison du nombre variable de kringle K-IV-2 (entre 2 et 40), il existe plusieurs isoformes possibles pour la Lp(a). L’apo(a) varie ainsi en taille et en poids moléculaire, mais le diamètre global de la lipoprotéine reste comparable à une LDL (< 70 nm), ce qui permet à la Lp(a) de franchir la barrière endothéliale. Enfin la Lp(a) contient une proportion importante de phospholipides oxydés3 . (Figure 1)
Un métabolisme encore discuté Environ 90% des taux circulants de Lp(a) sont hérités et déterminés très fortement génétiquement par un seul gène, le gène LPA. De ce fait le taux est stable, peu influencé par l’âge, le sexe et les changements dans le mode de vie comme l’alimentation par exemple. Par contre, il existe de fortes variations interethniques, avec des taux en moyenne plus élevés chez les sujets noirs que chez les caucasiens. On observe une corrélation inverse entre le taux de Lp(a) et le nombre de domaines K-IV-2 présents sur le gène LPA : moins il y a de K-IV-2, plus le taux de Lp(a) est élevée dans le sang 3
. L’apo(a) est synthétisée presque exclusivement dans le foie, mais son métabolisme et en particulier les mécanismes par lesquels la Lp(a) est éliminée du plasma reste l’objet de controverses. Il semble toutefois que la voie du LDL-récepteur soit peu impliquée, un argument étant l’absence d’effet des statines sur le taux circulant de Lp(a). Parmi les différents mécanismes évoqués pour le catabolisme, l’élimination rénale joue un rôle important 3.
Un risque de mieux en mieux établi
Schématiquement, la Lp(a) contribue au risque cardiovasculaire par les 3 principaux mécanismes suivants :
• un rôle pro-athérogène par la partie proche d’une LDL avec importance du contenu en cholestérol de la Lp(a),
• un rôle pro-coagulant et anti-fi brinolytique lié à la protéine apo(a), rôle qui est encore discuté,
• et enfin un effet pro-inflammatoire majeur essentiellement en relation avec le contenu en phospholipides oxydés.
Plusieurs études observationnelles incluant des métaanalyses récentes ont suggéré une association entre élévation de la Lp(a) et risque d’IDM, d’accident vasculaire cérébral (AVC) ischémique et de sténose de la valve aortique3,4. Mais ce sont surtout des données génétiques qui militent en faveur d’un rôle causal pour les maladies cardiovasculaires athéromateuses 3,5. En cas de Lp(a) très élevée, le risque d’AVC et de maladie thrombotique veineuse a été parfois observé dès l’âge pédiatrique.
Une mesure peu répandue
En raison de l’hétérogénéité de structure de la Lp(a), la mesure est loin d’être standardisée et peut être rendue soit en masse (mg/dl), soit en concentration de particules (nmol/l). Alors que la norme de laboratoire est souvent indiquée < 30 mg/dl, le taux en général considéré comme facteur de risque est un taux > 50 mg/dl (0,50 g/l) 6,7. Ce taux de 50 mg/dl est issu d’analyses dans lesquelles le risque cardiovasculaire augmente significativement après ajustement multivarié uniquement au-delà de cette valeur et le risque est graduellement accru. Chez des patients sous statine, le hazard ratio est de l’ordre de 1,5 pour des individus avec Lp(a) ≥ 50 mg/dl versus < 50 mg/dl1. Il est admis que la présence d’un taux très élevé (> 180 mg/dl ou > 430 nmol/l) induit un risque d’athérosclérose comparable à celui associé à une HF hétérozygote6
. De plus une HF avec Lp(a) élevée a un risque cardiovasculaire majoré de façon très significative.
Un élément important est à connaitre pour la pratique quotidienne : le LDL-cholestérol (LDL-C) obtenu dans un bilan lipidique standard inclut le cholestérol contenu dans la Lp(a). De ce fait, le taux de LDL-C doit être corrigé pour les patients avec Lp(a) élevée et disposer d’un LDL-C corrigé est important tant pour apprécier l’effi cacité d’un traitement hypolipémiant, que pour suspecter une HF hétérozygote. Le taux de LDL-C corrigé est en général calculé de façon conservatrice comme suit : LDL-C corr = LDL-C – 0,3 Lp(a) [Lp(a) exprimée en masse]
Un dosage utile dans quelles circonstances ?
Le dosage de Lp(a), malheureusement non remboursé en France actuellement, devrait être demandé :
• une fois chez tout sujet adulte pour identifier ceux avec des taux très élevés, comme cela est indiqué dans les recommandations européennes récentes 6 , et un seul dosage suffit,
• chez des patients sélectionnés avec maladie athérosclérotique inexpliquée par les facteurs de risque traditionnels, ou avec des antécédents familiaux d’athérosclérose prématurée, ou de sténose aortique prématurée,
• chez les patients avec HF hétérozygote pour lesquels un taux élevé est un facteur aggravant majeur,
• et enfin chez des individus avec épisodes récurrents thrombotiques non expliqués. La découverte d’un taux élevé de Lp(a) peut conduire à reclasser les patients dans un niveau de risque supérieur et la notion d’un taux très élevé doit déclencher un dépistage en cascade dans la famille et pour un patient en prévention primaire, la surveillance de la valve aortique et la réalisation d’un score calcique coronaire.
Une absence ou une faible efficacité des traitements hypolipémiants disponibles
Non seulement les traitements hypolipémiants oraux n’abaissent pas le taux de Lp(a), mais il a même été rapporté qu’un traitement par statine induit une dégradation de ce paramètre, élévation modeste (environ 10% en moyenne) dont la significativité clinique est loin d’être établie et qui ne remet pas en cause le bénéfice d’une statine induit par la baisse majeure du LDL-C8.
Seuls les inhibiteurs de PCSK9 induisent une baisse modérée (de l’ordre de 20 à 25%) dont le mécanisme est encore loin d’être consensuel (diminution de la synthèse ou augmentation du catabolisme ?). La significativité clinique de cette baisse reste également à confirmer. En tout cas, à partir de données génétiques, il semble qu’il faille une baisse majeure des taux circulants de Lp(a) pour engendrer un bénéfice cardiovasculaire équivalent à ce qui est observé lors d’un traitement par statine par baisse du LDL-C. C’est la raison pour laquelle il sera nécessaire de sélectionner des patients avec Lp(a) très élevée pour démontrer un bénéfice cardiovasculaire à abaisser ce paramètre par des inhibiteurs spécifiques de la synthèse de Lp(a) comme des oligonucléotides antisens (pelacarsen) ou des ARN interférents (olpasiran). Dans une étude de phase 2 récente, une diminution dose-dépendante de Lp(a) (jusqu’à 80% de réduction des taux circulants) a été obtenue par l’oligonucléotide antisens dirigé vers l’hépatocyte AKCEA-APO(a)-LRX (pelacarsen) chez des individus sélectionnés avec Lp(a) > 60 mg/dl.
Dans l’attente de pouvoir disposer de ces thérapeutiques spécifiques, et en présence d’un taux de Lp(a) franchement augmenté, l’attitude actuelle est de réduire au maximum tous les autres facteurs de risque et en particulier d’abaisser le plus possible le taux de LDL-C (en veillant à le corriger par une estimation du cholestérol contenu dans la Lp(a)). La seule thérapeutique spécifique remboursée dans certains pays est l’aphérèse et de nombreux patients en prévention secondaire avec Lp(a) augmentée sont traités par aphérèse en Allemagne. Une question reste également débattue, c’est l’intérêt ou non d’introduire un traitement par aspirine chez des patients en prévention primaire avec élévation franche de la Lp(a). Alors qu’en prévention primaire, de façon générale, il est admis que le rapport risque/bénéfice n’est pas favorable, des données post-hoc de la Women’s Health Study suggèrent un bénéfice de l’aspirine en prévention primaire chez les femmes avec élévation de Lp(a) 10. Des études complémentaires sont nécessaires, et dans l’attente, une proposition raisonnable est de réserver l’aspirine aux sujets qui ont une athérosclérose infra-clinique documentée (score calcique coronaire positif) ou chez ceux avec une forte histoire familiale de maladie cardiovasculaire prématurée.
Michel Farnier,
Équipe PEC2, EA 7460, Université de Bourgogne Franche-Comté, et Service de Cardiologie, CHU Dijon Bourgogne, Dijon
Le docteur Michel Farnier déclare avoir reçu des honoraires en tant qu’investigateur, expert scientifique et/ou conférencier de la part des firmes suivantes : Abbott, Akcea/Ionis, Amarin, Amgen, Daïchi-Sankyo, Kowa, Merck and Co, Mylan, Pfizer, Sanofi/Regeneron et Servier.
