
Études cardiovasculaires dans le diabète de type 2 : Réfléchir autrement (Cardiovascular studies in type 2 diabetes: Think differently)
Le diabète demeure une situation à haut risque cardiovasculaire pour les patients qui en sont atteints. Ce constat a conduit à une nouvelle stratégie depuis plus de 10 ans, celle des grands essais thérapeutiques d’événements cardiovasculaires, destinés avant tout à vérifier la sécurité d’emploi de molécules qui seront amenées à être prescrites sur le long terme aux populations diabétiques de type 2 en particulier. Quelles leçons pouvons-nous en tirer aujourd’hui, et quelles sont les prochaines étapes en cours d’action et de réflexion ?
Rappel succinct des objectifs de la Food and Drug Administration (FDA)
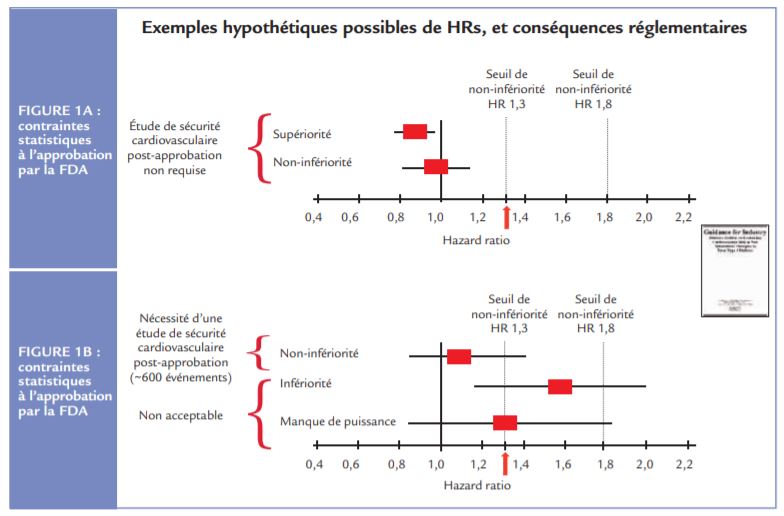
Depuis 2008, la Food and Drug Administration (FDA) impose des règles pour tout nouveau médicament arrivant sur le marché, et destiné à être utilisé dans le traitement du diabète. Il a alors été décidé que chaque nouveau médicament antidiabétique approuvé depuis 2008, y compris certaines nouvelles formulations d’insuline, aurait un essai de morbi-mortalité (cardiovascular outcome trial, CVOT) dédié1 . En résumé, la FDA a requis en complément de l’évaluation du « hazard ratio », une borne supérieure pour l’estimation du rapport de risque (en analyse bilatérale, avec un intervalle de confiance à 95%) (Figures 1 A et B), en définissant comme un critère principal de jugement, un critère composite d’évaluation cardiovasculaire (souvent le MACE pour Major Adverse Cardiovascular Events, regroupant les décès cardiovasculaires, les infarctus et AVC non mortels).
L’histoire récente du diabète de type 2 dominée par les preuves apportées par les études de morbi-mortalité
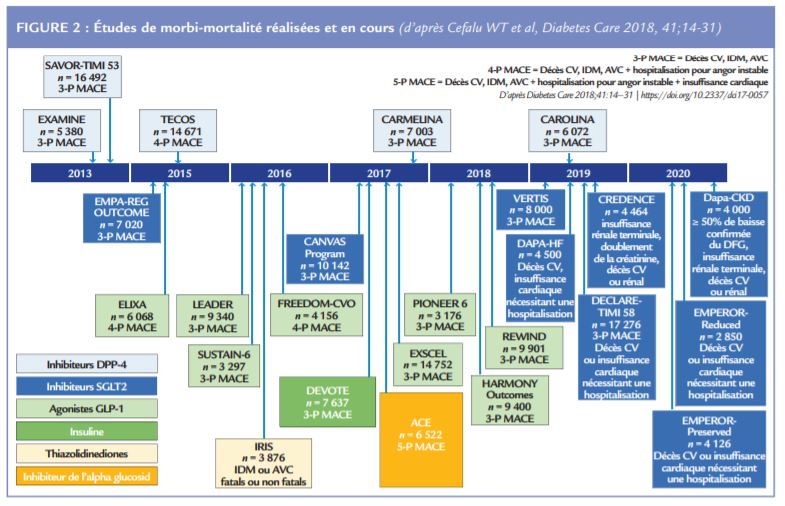
Sur les 10 dernières années, de nombreuses études de sécurité cardiovasculaire ont été conduites qu’il s’agisse des premiers essais avec les inhibiteurs de la dipeptidylpeptidase de type 4 (iDPP-4), des agonistes du récepteur au GLP1 (GLP1-RAs), des insulines d’action lente de deuxième génération (études ORIGIN pour la glargine et DEVOTE pour la degludec), ou des molécules plus récentes comme les inhibiteurs du co-transporteur glucose-sodium de type 2 (iSGLT2 ou gliflozines). Au total, une vingtaine de CVOTs ont été publiées, d’autres sont en cours ou ont été abandonnées (Figure 2)2.
De manière rassurante, dans la majorité de cas, les essais destinés à montrer la sécurité d’emploi de ces nouvelles molécules antidiabétiques, se sont révélés neutres (ce qui sous-entend que la non infériorité a été démontrée sur le critère de jugement principal), répondant ainsi à la question posée par la FDA en 2008. Même les sulfamides incriminés d’un risque potentiellement délétère sur le plan cardiovasculaire ont en partie été innocentés dans la récente étude CAROLINA de comparaison à la linagliptine, inibiteur de la DPP-4, première étude randomisée et contrôlée versus comparateur actif (sulfamide hypoglycémiant glimépiride). Pour certaines molécules, les résultats ont été positifs avec la démonstration d’une protection cardiovasculaire et rénale chez des patients à haut ou très haut risque cardiovasculaire et/ou cardio-rénal (supériorité testée et démontrée après vérification du critère de non infériorité) notamment avec des molécules comme les GLP1-RAs (études LEADER, SUSTAIN-6, REWIND, HARMONY Outcomes) 3-6 ou les iSGLT2 (études EMPA-REG Outcome, CANVAS, DECLARE-TIMI 58, CREDENCE)7-10. En revanche, dans certaines études, des signaux d’alerte ont été mis en évidence, notamment dans l’étude SAVORTIMI 11, au cours de laquelle l’incidence des épisodes d’insuffisance cardiaque a été retrouvée significativement plus élevée dans le groupe saxagliptine comparativement au groupe placebo, sans qu’aucune explication n’ait pu être donnée sur cette différence observée très précocement dans le suivi de l’étude. Une même tendance, mais non significative, a aussi été observée avec l’alogliptine dans l’essai EXAMINE 12. Une attention particulière a donc été attirée sur des effets et des différences auparavant insoupçonnés entre les inhibiteurs de la DPP-4, qui bloquent le clivage de nombreux peptides circulants et peuvent ainsi avoir divers effets en aval (bénins ou nocifs) autres que la réduction de la clairance et l’augmentation plasmatique des niveaux physiologiques de GLP-113. Plus largement, concernant la classe des incrétines (iDPP4 et AR-GLP1), la question du risque de pancréatite aiguë et de carcinome pancréatique a fait l’objet consécutivement d’inquiétudes14,15, de débats sur des données controversées 16 amenant les agences réglementaires de la FDA et EMA à prendre une position et à ré-analyser objectivement et en toute indépendance des milliers de données expérimentales, animales et d’essais cliniques 17. Il en est de même pour les critères de sécurité comme le sur-risque potentiel de carcinome thyroïdien 18, suspecté à partir de modèles animaux, mais qui n’a été confirmé par la suite chez l’homme.
Les enseignements et conséquences parfois inattendus des études de morbi-mortalité
Ces CVOTs bien conçus et correctement conduits ont fourni des informations précieuses au-delà de leur objectif principal de sécurité CV. Les preuves du bénéfice CV et rénal de l’empagliflozine, de la canagliflozine, de la dapagliflozine pour les iSGLT2, du liraglutide, du sémaglutide, de l’albiglutide et du dulaglutide pour les GLP1-RA par rapport au placebo, complétées par des données provenant d’autres études randomisées ou de vraie vie, ont incité les experts et sociétés savantes à reconsidérer les directives voire les recommandations de traitement pour le diabète de type 219,20,21. L’ensemble de ces données ont pour but de modifier la pratique clinique afin de réduire les événements CV et les décès parmi les personnes dont
les caractéristiques sont proches ou similaires à celles inclues dans ces essais.
D’autres informations tirées des CVOTs proviennent de critères secondaires ou de composants individuels du critère primaire composite, considérés comme moins robustes statistiquement mais néanmoins d’importance potentielle. C’est le cas du signal positif observé sur la mortalité cardiovasculaire liée aux épisodes d’insuffisance cardiaque, dans les études conduites avec les iSGLT2, conduisant ainsi les firmes pharmaceutiques à développer une nouvelle stratégie d’étude, comme dans DAPA-HF22 où l’attention a porté en critère principal de jugement sur le problème urgent de la prise en charge de l’insuffisance cardiaque congestive (ICC), qui affecte les personnes âgées atteintes de diabète plus fréquemment que l’infarctus du myocarde, et qui avait déjà été identifiée comme une préoccupation réelle au cours de l’étude SAVORTIMI. D’autres essais sont en cours chez des patients identifiés avec une insuffisance cardiaque à fraction d’éjection diminuée < à 40% (EMPEROR avec l’empagliflozine). Des études de vraie vie avaient préalablement observé cet effet protecteur des iSGLT2 sur le risque de développer une insuffisance cardiaque 23,24. Ces essais ont permis dans le même temps de mettre en évidence des effets protecteurs rénaux, aboutissant au développement d’essais spécifiques de protection rénale dans des populations à risque indépendamment de la présence ou non d’un diabète 10,25.
Limites méthodologiques et pratiques des études de morbi-mortalité
Bien que tous ces essais aient fourni des informations très précieuses, la question reste controversée de savoir si ces informations justifient l’investissement actuel de temps et de ressources. Il est donc logique de s’interroger aujourd’hui sur la poursuite de tels essais ou de la modification des critères de réalisation de ces études de sécurité cardiovasculaire. La raison en est simple : disposant aujourd’hui de molécules dont la protection cardiovasculaire est démontrée, il est de moins en moins éthique de proposer à des patients d’intégrer des essais sur de très longues périodes de temps (comme les études ORIGIN 26 ou REWIND 5 avec des suivis de plus de 5 années chez des patients à risque cardiovasculaire modéré à élevé) en comparaison d’un placebo, plaçant alors les patients du groupe placebo dans une situation de perte de chance vis-à-vis des stratégies ayant fait la preuve de leur efficacité sur la protection cardiovasculaire ou rénale.
Plusieurs limites des CVOTs sont à ce jour bien identifiées : manque de transposabilité des études et résultats à ceux observés dans la « vraie vie » que ce soit pour les GLP-1 RA comme pour les iSGLT2 (études Real World Evidence ou RWEs)27,28, calendrier trop court pour évaluer les avantages potentiels, mais aussi calendrier trop court pour évaluer les dommages éventuels sur la sécurité d’emploi, la conception des essais avec un groupe contrôlé par un placebo uniquement, etc… Concernant spécifiquement la représentativité des populations incluses dans les CVOTs, les résultats ne peuvent être extrapolés que sur un très faible pourcentage de la population amenée à bénéficier du traitement à l’étude, si on se réfère par exemple aux critères d’inclusion et d’exclusion définis dans quatre essais principaux que sont EXSCEL, LEADER, REWIND et SUSTAIN-6, avec une représentativité respective de 15,9%, 2,9%, 42,6% et 13,0%, donc très faible à l’exception de REWIND, et encore 27. Pour les iSGLT2, basée sur 4 études de cohortes de patients diabétiques de type 2,
la représentativité des patients inclus dans les études CANVAS, DECLARE-TIMI, EMPAREG-OUTCOMES et
VERTIS n’est en définitive que de 36,4%, 49,5%, 17% et 19% respectivement 28.
Par ailleurs, la conception actuelle d’un CVOT présente de sérieuses limites d’interprétation en lien avec l’histoire naturelle du diabète et des maladies cardiovasculaires Étant donné que les organismes de réglementation, les sociétés pharmaceutiques, les systèmes de santé et, dans de nombreux cas aussi, les personnes atteintes de diabète ont des préoccupations qui répondent à des délais relativement courts, les CVOTs actuels ne traitent le plus souvent que de résultats à court terme, et pas de ceux qui surviennent cinq ans après le début du traitement. Or, plusieurs éléments de preuve plaident en faveur de l’importance d’un suivi à plus long terme, comme les études DCCT/EDIC (pour le diabète de type 1)29, UKPDS à long terme 30 ou encore VADT (pour le diabète de type 2)31, études négatives sur les 5 premières années de suivi, et dont les bénéfices n’ont été observés qu’après plus de 10 années. De ces résultats est d’ailleurs né le concept « d’héritage » ou de « mémoire glycémique » dont les substrats physiopathologiques n’ont cependant pas été démontrés formellement à ce jour 32.
Ainsi, des différences dans la durée des essais, comme dans le niveau de risque cardiovasculaire absolu des populations recrutées à l’inclusion, et enfin le critère de jugement principal (MACE-3P, MACE-4P ou co-primary end-point) 33,34, pourraient avoir affecté les résultats et par conséquent les conclusions des études. Enfin, l’utilisation de critère tel que le NNT (number needed to treat) pour comparer entre eux (à tort) les essais de CVOTs, est une méthode statistique souvent mal utilisée, et qui devrait s’appliquer également aux effets secondaires et à la sécurité des produits, et pas seulement au nombre d’événements cliniques cardiovasculaires significatifs évités35,36,37.
Réfléchir autrement pour le futur des études de sécurité vasculaire
Les possibilités d’amélioration des CVOTs sont jugées multiples et peuvent se résumer de la manière suivante : impliquer des populations à faible risque et plus diversifiées, effectuer un suivi à plus long terme, utiliser des comparateurs actifs. Il existe en effet plusieurs problèmes avec la conception actuelle des CVOTs. Tout d’abord, le contrôle glycémique est rarement comparable entre les deux groupes (exemple de l’étude SUSTAIN-6)4 , le groupe du médicament à l’étude ayant généralement des valeurs d’HbA1c plus faibles, du moins dans les premiers mois ou premières années, lorsque le groupe placebo n’a pas encore bénéficié d’une intensification du traitement. De telles différences ont été suspectées de contribuer à une partie des avantages CV observés pour le groupe expérimental38. De récents travaux de médiation démontrent d’ailleurs que l’amélioration de l’HbA1c participerait du moins en partie à la réduction des évènements du critère composite cardiovasculaire dans les essais cliniques de grande envergure. Dans les essais effectués avec les AR-GLP 1, la baisse brutale de l’HbA1c parfois observée dans le groupe expérimental contribue également à la survenue ou l’aggravation d’une rétinopathie diabétique 39. A l’inverse, la molécule GLP1 est innocentée dans ce processus d’aggravation de la rétinopathie diabétique40. Deuxièmement, certains médicaments utilisés plus fréquemment dans les groupes de comparaison peuvent eux-mêmes avoir des effets CV protecteurs (exemple de l’étude EXSCEL avec une sur-représentation des prescription d’iSGLT2 dans le groupe placebo)41. Troisièmement, à l’avenir, il sera difficile voire impossible, pour des raisons éthiques, de restreindre l’utilisation dans les CVOTs de médicaments dont il a été démontré qu’ils avaient des effets bénéfiques sur le plan cardiovasculaire.
D’autres pistes d’amélioration doivent être recherchées.
Définir des conceptions innovantes d’études basées plus sur la stratégie thérapeutique plutôt que sur une molécule en particulier, établir des définitions normalisées d’événements : en particulier, les stratégies et définitions utilisées pour identifier les événements tels que la pancréatite aiguë, le cancer du pancréas, la progression de la rétinopathie ou encore l’aggravation de la fonction rénale varient considérablement au sein des différentes CVOTs réalisées jusqu’à aujourd’hui. La modification des critères d’évaluation des essais est également à prendre en compte. Les critères d’évaluation, de même que les critères d’inclusion dans les études évoluent pour être le plus en phase avec les populations susceptibles de tirer le bénéfice maximum d’une molécule et/ou d’une stratégie thérapeutique. Pour preuve, sur l’année 2019-2020, les essais conduits avec des molécules initialement destinées à améliorer le contrôle glycémique, ont été testées chez des patients diabétiques de type 2, mais aussi non diabétiques, présentant des altérations du débit de filtration rénale et des critères forts et sévères d’insuffisance cardiaque, pour démontrer toute la puissance de la classe des médicaments iSGLT2, dans la protection cardiovasculaire et rénale (DAPAHF, EMPEROR-reduced, et DAPA-CKD). C’est sans doute un virage majeur dans l’approche d’une thérapie personnalisée, et non plus dans une science statistique d’analyse en post-hoc ou exploratoire, qui n’a pour objectif que de donner des pistes de recherche et de développement, mais qui n’est en rien une démonstration scientifique convaincante et robuste. Une alternative consisterait à ajouter des éléments de sécurité en tant que composants du résultat composite principal si les composants de sécurité et d’efficacité inclus peuvent être pondérés de manière appropriée pour refléter leur importance clinique. Un tel point d’analyse combiné refléterait alors le bénéfice clinique net global de l’intervention pour le patient. Enfin, d’autres idées comme la création de bio-banques, d’options sur l’efficacité et le partage des coûts (efficience globale d’une stratégie), l’implication des patients (ou PROs pour Patient Reported Outcomes) devraient être considérées à l’avenir.
Une évolution nécessaire dans la construction des études de sécurité cardiovasculaire et rénale
Un texte est donc en cours de validation et concerne une nouvelle prise de position de la FDA vis-à-vis de la sécurité d’emploi des molécules destinées à contrôler l’équilibre glycémique des patients diabétiques de type 242. Ce guide fournit des recommandations sur la taille et la nature des données de sécurité nécessaires à l’approbation en usage chronique de ces médicaments. Il a été préparé par la Division des produits de métabolisme et d’endocrinologie du Center for Drug Evaluation and Research de la Food and Drug Administration. Il fait suite au constat de la FDA d’une faisabilité précieuse de l’inclusion d’un nombre significativement important de patients souffrant de complications associées au diabète et de comorbidités dans les essais cliniques pour évaluer le profil d’innocuité CV des nouveaux médicaments antidiabétiques. La FDA a ainsi jugé qu’il demeurait toujours utile de disposer de données de sécurité cardiovasculaire avant toute approbation d’un produit, mais que les données de post-commercialisation devaient également être fournies pour juger de la sécurité d’emploi des molécules au-delà du seul contrôle de risque cardiovasculaire. Les médicaments approuvés pour améliorer le contrôle glycémique chez les patients doivent avoir des profils de sécurité bien caractérisés basés sur des études à plus court terme, mais certains problèmes de sécurité ne peuvent être identifiés que dans des études à plus long terme. Pour ces raisons, la base de données de sécurité d’un nouveau médicament antidiabétique pour le diabète de type 2 devrait inclure un nombre important de patients exposés au médicament pendant de plus longues périodes pour confirmer leur sécurité au long cours. Les propositions d’essais cliniques et d’extensions d’essais cliniques contrôlés sont les suivantes :
1) Au moins 4 000 patients-années d’exposition au nouveau médicament dans les essais cliniques de phase
3 (cette exposition au traitement comprend tous les dosages étudiés dans les essais cliniques de phase 3).
2) Au moins 1 500 patients exposés au nouveau médicament pendant au moins 1 an.
3) Au moins 500 patients exposés au nouveau médicament pendant au moins 2 ans.
Il apparait aussi essentiel aux yeux de la FDA d’évaluer l’innocuité de ces nouveaux médicaments dans des populations de patients atteints d’une maladie cardiovasculaire sous-jacente, d’une maladie rénale chronique et chez des patients plus âgés. Ainsi, une proposition d’études selon l’âge, les comorbidités associées et/ou les complications les plus pertinentes de ces populations dans les essais de phase 3 apparait comme suit :
1) Au moins 500 patients atteints d’insuffisance rénale chronique de stade 3/4 exposés au nouveau médicament.
2) Au moins 600 patients atteints d’une maladie cardiovasculaire établie (par exemple, un infarctus du myocarde antérieur, une maladie coronaire documentée, un accident vasculaire cérébral antérieur, une maladie vasculaire périphérique) exposés au nouveau médicament.
3) Au moins 600 patients de plus de 65 ans exposés au nouveau médicament.
Il est également suggéré, du fait de l’exposition chronique des populations de patients diabétiques de type 2 avec des comorbidités nombreuses, que les promoteurs industriels utilisent des méthodes rigoureuses pour la collecte des événements CV et indésirables avant la mise sur le marché d’une nouvelle molécule. L’agence suggère que les situations dans lesquelles la collecte de ces données de sécurité supplémentaires est nécessaire soient identifiées et discutées avant le début des essais de phase 3. Enfin, il est suggéré que les promoteurs industriels intègrent dans leur démarche des comités de surveillance et de sécurité des données pour assurer un suivi indépendant des résultats des essais cliniques.
Quoi qu’il en soit, il semble évident que les standards actuels d’études d’évènements seront à revoir sur plusieurs points comme celui des critères d’évaluation primaires et secondaires, la comparaison du traitement à l’essai à une molécule de référence et non plus à un placebo uniquement, la nécessité d’études face – face ou d’études d’association médicamenteuse ce qui sous-entend une évaluation des stratégies plus que des molécules prises seules à seules. Ce texte n’est pour le moment que provisoire mais il donne à réfléchir sur les exigences qui seront imposées aux firmes pharmaceutiques en termes de sécurité d’emploi des prochaines molécules destinées au traitement chronique du patient diabétique de type 2.
L’auteur déclare ne pas avoir de liens d’intérêts avec cet article.
Bruno Guerci
Service Endocrinologie, Diabétologie et Nutrition CHRU de Nancy & Université de Lorraine
RÉFÉRENCES
11. U.S. Food and Drug Administration. Guidance for industry: diabetes mellitus-evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes [Internet]. Available from www.fda.gov/downloads/Drugs/ GuidanceComplianceRegulatoryInformation/ Guidances/ucm071627.pdf.
2. Cefalu WT et al. Diabetes Care 2018;41:14–31
3. Marso SP et al. N Engl J Med. 2016;375:311-22.
4. Marso SP et al. N Engl J Med. 2016;375:1834-44.
5. Gerstein HC et al. Lancet. 2019;394:121-30.
6. Hernandez AF et al. Lancet. 2018;392:1519-29.
7. Zinman B et al. N Engl J Med. 2015;373:2117-28.
8. Wiviott SD et al. N Engl J Med. 2019;380:347-57
9. Neal B et al. N Engl J Med. 2017;377:644-57.
10. Perkovic V et al.N Engl J Med. 2019;380:2295-2306.
11. Scirica BM et al. N Engl J Med. 2013;369(14):1317-26
12. White WB et al. N Engl J Med. 2013;369(14):1327-35
13. Scheen AJ. Diabetes Obes Metab 2010;12(8):648-58.
14. Elashoff M, Gastroenterology. 2011;141(1):150-6
15. Butler PC, et al. Diabetes Care 2013; 36:2118–2125
16. Giorda et al. Lancet Diabetes Endocrinol 2014; 2: 111–15
17. Egan AG et al. N Engl J Med 2014;370:794-7
18. Bjerre Knudsen et al. Endocrinology 2010;151:1473–86
19. Davies MJ et al. Diabetes Care 2018;41(12):2669-701.
20. Buse JB et al. Diabetes Care 2020;43(2):487-93.
21. Cosentino F et al. Eur Heart J 2020;41(2):255-323.
22. McMurray JJV et al.. N Engl J Med. 2019;381:1995-2008.
23. Kosiborod M et al. Circulation. 2017;136(3):249-259
24. Kosiborod M et al. J Am Coll Cardiol. 2018;71(23):2628-2639
25. Heerspink HJL et al. N Engl J Med. 2020;383(15):1436-1446
26. ORIGIN Trial Investigators. N Engl J Med. 2012;367(4):319-28.
27. Boye KS et al. Diabetes Obes Metab. 2019;21:1299–1304
28. Castellana M et al Cardiovascular Diabetol 2020;19(1):87.
29. Diabetes Control and Complications Trial (DCCT)/Epidemiology of Diabetes Interventions and Complications (EDIC) Study Research Group. Diabetes Care 2016;39(5):686-93.
30. Holman RR et al. N Engl J Med. 2008;359(15):1577-89
31. Rodney A. et al. N Engl J Med 2015; 372:2197-2206.
32. Khunti K et al. diabetes Obes Metab, 2018;20(6):1337-1341
33. Kristensen SL et al. Lancet Diabetes Endocrinol. 2019;7:776-85.
34. Zelniker TA et al. Circulation. 2019;139:2022-31.
35. Altman DG. BMJ. 1998;317:1309-12.
36. Altman DG et al. BMJ. 1999;319:1492-5.
37. Ludwig L et al. Cardiovasc Diabetol 2020;19:65.
38. Steg G et al. Circulation. 2016 Aug 23;134(8):571-3
39. Bethel MA et al. Diabetes Care. 2020;43(2):446-452
40. Gaborit B et al. J Clin Endocrinol Metab, 2020, 105:e1549–e1560
41. Bethel MA el al. Circulation. 2020;141:1360–1370.
42. Type 2 Diabetes Mellitus: Evaluating the Safety of New Drugs for Improving Glycemic Control Guidance for Industry. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/type-2-diabetes-mellitusevaluating-safety-new-drugs improving-glycemic-control-guidance-industry
