
Le coroscanner dans la prévention cardiovasculaire primaire
Les maladies cardiovasculaires représentent, avec les cancers, l’une des deux principales causes de mortalité dans le monde.1,2 Cela fait de leur prévention un enjeu capital pour réduire la morbi-mortalité qui y est associée ainsi qu’un enjeu économique sociétal.
Introduction
Pour permettre une prévention efficace, il faut d’abord réussir le dépistage des lésions préliminaires. L’Echographie-Doppler est un puissant outil de dépistage puisqu’il permet l’étude des gros vaisseaux et la visualisation de l’athérosclérose au niveau des troncs supra-aortiques, de l’aorte et des membres inférieurs. Le coroscanner est son équivalent sur le plan coronaire, permettant de visualiser des artères millimétriques cardiaques avec une résolution correcte, mais cependant inférieure à celle de la coronarographie. Le coroscanner a ainsi toute sa place dans une stratégie de dépistage et de prévention cardiovasculaire.
La réaction d’athérosclérose
Un bref résumé de la réaction athéroscléreuse est nécessaire pour bien comprendre l’intérêt d’un dépistage précoce. Cette réaction est longue, prenant habituellement des décennies. Mais le plus important, c’est qu’elle n’est pas linéaire. Ainsi, la rupture de plaque et l’événement aigu qui en résulte, de type infarctus du myocarde, n’est pas un événement de bout de piste. Il ne peut donc pas être prévu par un test d’ischémie puisque la rupture de plaque est un phénomène brutal survenant sur une plaque dite « jeune » dont le taux de sténose est habituellement d’environ 30%3–5. Cette particularité est fondamentale, puisque vouloir utiliser un test d’ischémie en prévention primaire sera aussi efficace que rechercher un virus avec une loupe. L’outil n’est tout simplement pas adapté à l’objectif fixé. Il n’en est pas de même pour un examen d’imagerie visualisant l’intima des artères, comme l’Echo-Doppler pour les grosses artères périphériques et le coroscanner pour les artères coronaires. Il est également utile de rappeler que la réaction d’athérosclérose est plurifactorielle et particulièrement complexe, incomplètement comprise 5–10. A la base de la réaction d’athérosclérose, on retrouve des lipoprotéines circulantes potentiellement athérogènes, comme le LDL-cholestérol (LDL-c), pouvant être transportées à travers les cellules endothéliales par des mécanismes de transcytose et se retrouvant ainsi dans l’intima des artères, notamment dans les zones de faible shear stress (force de cisaillement). Théoriquement, ce phénomène est réversible et la lipoprotéine peut encore être recaptée par la cellule endothéliale. Cependant, dans l’intima, des protéoglycanes sulfatés chargés négativement ont la capacité de se fixer à ce LDL-c ne permettant plus sa sortie de l’intima. A l’état natif, le LDL-c ne possède pas de risque athérogène.
Après sa pénétration dans l’intima, le second événement majeur est la modification de la lipoprotéine LDL-c par une succession de réactions oxydatives, devenant ainsi du LDL-c oxydé, de l’oxLDL. Les mécanismes sont incomplètement connus mais les modifications structurelles du LDL-c seront majeures, à tel point que cet oxLDL deviendra une cible du système immunitaire. Ceci va initier le troisième phénomène majeur de la réaction athéroscléreuse qui est la mise en place d’une réponse immunitaire chronique. Cette réponse immunitaire innée puis adaptative va générer un recrutement pérenne de cellules immunitaires au sein de la plaque athéromateuse avec pour objectif d’éliminer l’oxLDL qui n’est plus considéré comme du soi mais comme une molécule étrangère. La captation puis la dégradation du oxLDL par des cellules immunitaires notamment des macrophages va mener à l’accumulation d’esters de cholestérol à l’intérieur de ces cellules. L’incapacité de ces macrophages à gérer ce surplus d’esters de cholestérol déclenchera leur apoptose, précédée de l’état de cellules dites spumeuses, gorgées d’esters de cholestérol. Cette apoptose libérera le contenu cellulaire dans l’intima et créera un milieu pro-thrombogène d’une part, avec la libération de facteur tissulaire (TF : tissue factor) procoagulant, tout en stimulant la poursuite d’une réaction inflammatoire d’autre part. De ce cercle vicieux naîtra un noyau lipidique et nécrotique contenant débris cellulaires, esters et cristaux de cholestérol. Afin de protéger la couche cellulaire endothéliale d’une destruction certaine par ce noyau nécrotique, la migration des cellules musculaires lisses en provenance de la média en direction de l’intima va permettre leur différenciation phénotypique en myofibroblastes et leur sécrétion de collagène. La chape fibreuse alors sécrétée, protectrice, pourra s’interposer entre le noyau nécrotique et la couche cellulaire endothéliale.
De l’équilibre entre la destruction intimale par la réaction inflammatoire nécrotique et sa protection par la chape fibreuse sécrétée par les myofibroblastes dépendra l’issue de la réaction athéroscléreuse. A noter que le switch ultérieur des myofibroblastes vers un phénotype ostéoblastique permettra la calcification progressive de la plaque athéromateuse, sans que ce phénomène soit bien connu et compris, avec l’hypothèse que la calcification stabilise progressivement la plaque. Une des leçons importantes à retenir de cette physiopathologie est que le LDL-c est nécessaire mais non suffisant pour générer des plaques athéromateuses. C’est pourquoi des patients avec un LDL-c élevé ont parfois des artères normales. Sans oxydation ni inflammation chronique ces patients ne développent pas de plaques athéromateuses. Nous ne savons pas actuellement empêcher l’oxydation des lipoprotéines dans l’intima ni bloquer l’inflammation chronique qui en résulte. Certaines études sur des anti-inflammatoires sont pourtant prometteuses 11–13. Cependant, en faisant diminuer le nombre de lipoprotéines circulantes, que ce soit avec des statines 14–17, de l’ézétimibe 18–20 ou des anti-PCSK-921,22 et demain par des ARN interférents 23,24 on peut ralentir la réaction athéroscléreuse et éviter les événements cardiovasculaires.
L’imagerie vasculaire dans l’athérosclérose
L’athérosclérose concernant les artères de moyen et gros calibre, il faut, pour la détecter, d’abord pouvoir visualiser les artères concernées. L’outil de mesure doit être adapté à la taille du vaisseau et sa résolution suffisante. S’agissant des grosses artères, la résolution spatiale de l’Echo-Doppler est suffisante. L’intérêt est de visualiser la paroi artérielle aussi bien que la lumière. En effet, le premier rôle attribué à la fois au Doppler et au coroscanner a été de mesurer la lumière artérielle pour déterminer le degré de sténose par rapport au segment plus proximal et/ou plus distal de cette artère. Mais il ne faut pas oublier l’autre intérêt majeur qui est celui de la visualisation de la réaction athéromateuse dans la paroi artérielle. C’est ce deuxième rôle qui permettra de mettre en place des mesures de prévention. Pour les artères de moyen calibre comme les artères coronaires, la résolution du coroscanner, inframillimétrique, est un bon outil d’analyse, en attendant que des progrès technologiques ne permettent des résolutions encore supérieures.
Le rôle particulier du coroscanner dans l’imagerie vasculaire coronaire
Le coroscanner permet donc de visualiser à la fois la lumière du vaisseau et sa paroi, donc de rechercher des sténoses coronaires mais également de dépister l’athérosclérose à ses différents stades visibles. Le stade initial comportant des macrophages spumeux et des stries lipidiques n’est pas visualisable. Cependant, dès le stade 2 de l’OMS, celui des plaques athéromateuses non-compliquées, le coroscanner permet de poser le diagnostic d’athérosclérose débutante. Pour le moment, le coroscanner a essentiellement été utilisé comme une « coronarographie non-invasive », sous-tendant l’idée d’une recherche de sténose coronaire. Il sera de plus en plus considéré, tout comme l’Echographie-Doppler, comme un outil de dépistage de l’athérosclérose. Les études ne se sont pas penchées sur son rôle d’outil de dépistage jusqu’à présent mais uniquement sur son rôle dans le bilan de douleurs thoraciques, et non uniquement chez les patients à faible risque de coronaropathie.
Coroscanner et dosimétrie
Le coroscanner possédait il y a une dizaine d’années une dosimétrie importante, proche de celle d’une scintigraphie et donc plus importante qu’une coronarographie. Cela lui a bâti une triste réputation d’examen irradiant et inutile. N’a été retenue que sa valeur prédictive négative, c’est-à-dire qu’un coroscanner visualisant des artères strictement normales sans la moindre plaque ou sténose était considéré fiable pour éviter de réaliser une coronarographie. Mais le coroscanner a énormément évolué en dix ans sur tous les plans. Non-seulement la résolution s’est nettement améliorée, ainsi que ses performances diagnostiques, mais sa dosimétrie a très nettement diminué, surtout depuis la mise en place du mode prospectif. Ce mode « step-and-shoot » permet de n’acquérir qu’un seul segment du cycle cardiaque à chaque déplacement de table, généralement 75% du cycle RR. Cela a fait tellement diminuer la dosimétrie qu’un coroscanner prospectif permet actuellement d’envisager une dosimétrie d’environ 70 mGy.cm soit 1 mSv, voire une dosimétrie moindre. A titre de comparaison, cela correspond à l’irradiation d’une mammographie. Un angioscanner thoracique pour recherche d’embolie pulmonaire est nettement plus irradiant, à environ 5-6 mSv, ce qui n’empêche pas de le prescrire sans arrière-pensée dès que les D-dimères dépassent la norme du laboratoire. En revanche, quand il s’agit du coroscanner, on le considère généralement comme « trop irradiant » malgré l’apport diagnostique important et une dosimétrie moindre. En vérité, l’irradiation n’est plus un sujet en ce qui concerne le coroscanner et sa résolution est suffisante pour identifier l’athérosclérose coronaire. Cette résolution spatiale va encore s’améliorer et tous les constructeurs planchent sur des techniques qui diminueront la dosimétrie en faisant progresser la résolution. Dernier point, plutôt amusant : on peut aujourd’hui être moins irradiant avec un coroscanner prospectif qu’avec un score calcique ! Ironique alors que le score calcique est vanté pour sa faible irradiation.
Le coroscanner dans le bilan des douleurs thoraciques : apports diagnostiques et pronostiques
Le coroscanner est indiqué dans le bilan des douleurs thoraciques par l’ESC25–27. L’étude VERDICT28 l’a testé dans le contexte aigu des SCA (syndrome coronaire aigu) non-ST+. Dans cette étude, pour éliminer une sténose significative, le coroscanner avait : une valeur prédictive négative à 90,9%, une valeur prédictive positive à 87,9%, une sensibilité à 96,5% et une spécificité à 72,4%. La très grande sensibilité est le signe d’un bon examen de dépistage. De façon surprenante, il y avait 33% de patients classés SCA ST- qui n’avaient pas de sténose coronaire significative mais qui avaient tout de même une coronarographie et une prémédication antiagrégante ; peut-être qu’une stratification des patients étiquetés SCA ST- permettrait de déterminer lesquels bénéficieraient d’un coroscanner plutôt que d’une coronarographie, à condition bien évidemment que le scanner soit immédiatement disponible et ce de façon permanente.
Les auteurs de l’étude randomisée prospective RAPIDCCTA29, toujours en cours, ont présenté des résultats préliminaires au congrès de l’AHA de novembre 2020. Il s’agissait de vrais SCA ST- avec troponine positive et ECG modifié dans la plupart des cas. Une minorité (38%) de patients a eu un scanner coronaire parmi lesquels 23% des patients présentaient des artères normales et 29% des plaques athéromateuses sans sténose significative, les 48% restants présentant des sténoses significatives. Le pourcentage de coronarographies a été diminué de 19% dans le groupe coroscanner mais le suivi à un an ne retrouvait pas de différence en termes d’événements cardiovasculaires entre le groupe randomisé coroscanner et le groupe avec prise en charge conventionnelle. Sur les données que nous possédons, il semble qu’il n’y ait pas eu de traitement préventif institué pour les 29% de patients ayant eu un coroscanner mais sans sténose significative.
Mais la cohorte SCOT-HEART reste celle ayant apporté le plus d’informations sur le coroscanner. Celle-ci a dans un premier temps prouvé la valeur diagnostique du coroscanner pour étiqueter l’origine cardiaque ou non d’une douleur thoracique stable 30. Puis, dans un deuxième temps 31, elle a prouvé un bénéfice statistiquement significatif en termes d’événements cardiovasculaires de la prise en charge initiale comportant un coroscanner versus la stratégie classique consistant à réaliser un test d’ischémie chez des patients présentant des douleurs thoraciques stables. La diminution des événements cardiovasculaires était impressionnante à 5 ans : 41% d’infarctus fatals ou non en moins (p=0,004). Comment expliquer cette baisse des infarctus ? La raison en était l’augmentation des thérapies préventives, avec un odds-ratio de 1,4 significatif. Cette étude explique donc non-seulement comment devraient être gérées les douleurs thoraciques non-SCA au 21e siècle, mais également comment devrait être réalisée la prévention cardiovasculaire dorénavant.
Surtout l’étude SCOT-HEART crée un précédent, qui indique clairement que la prise en charge classique des douleurs thoraciques son-SCA, avec réalisation d’un test d’ischémie, est une perte de chance pour le patient. Logiquement donc, en dehors des patients qui passent une coronarographie d’emblée (douleurs très suspectes chez un patient à très haut risque cardiovasculaire avec modifications de l’ECG et/ou élévation de la troponine, un SCA en somme), tous les autres patients devraient bénéficier d’un coroscanner en évaluation primaire de leurs douleurs thoraciques.
Pourquoi est-ce si important ? Pourquoi ne pas se contenter du classique test d’ischémie, dont l’archaïque test d’effort avec ECG en continu, pour évaluer un patient présentant une douleur thoracique ? Simplement parce que l’outil n’est pas adapté. En effet, outre la sensibilité et spécificité qui sont plus élevées pour le coroscanner que pour les tests d’ischémie en ce qui concerne la détection des sténoses coronaires significatives, le coroscanner apportera une information capitale pour la prise en charge du patient : la présence ou l’absence d’athérosclérose coronaire. Le coroscanner visualise la lumière mais aussi la paroi artérielle et donc les plaques athéromateuses éventuelles. A quoi cela nous avance-t-il de visualiser la paroi artérielle s’il n’y a pas de sténose significative au coroscanner ? On se pose souvent uniquement la question de la sténose coronaire, notamment en cas de douleurs thoraciques. La mise en évidence d’une athérosclérose coronaire change pourtant complètement la donne en élevant drastiquement le niveau de risque cardiovasculaire d’un patient. Une épée de Damoclès se trouve donc au-dessus de la tête du patient quand il présente une athérosclérose coronaire même sans sténose significative et nous avons les moyens de renforcer le crin de cheval qui supporte le poids de cette épée. En effet, un traitement hypolipémiant suffisamment ambitieux et bien suivi par le patient, associé aux mesures hygiéno diététiques adaptées, permettra de diminuer la probabilité de survenue d’un événement aigu, de même que le dépistage et le traitement de tous les facteurs de risque associés.
Rappelons-nous que c’est d’ailleurs cette prise en charge modifiée qui explique les résultats de l’étude SCOT-HEART : les patients du groupe coroscanner ont bénéficié d’un surplus de traitement hypolipémiant par rapport aux patients du groupe traité de façon standard. D’autres traitements ont également augmenté comme la prescription d’antiagrégants plaquettaires ou d’antiangineux.
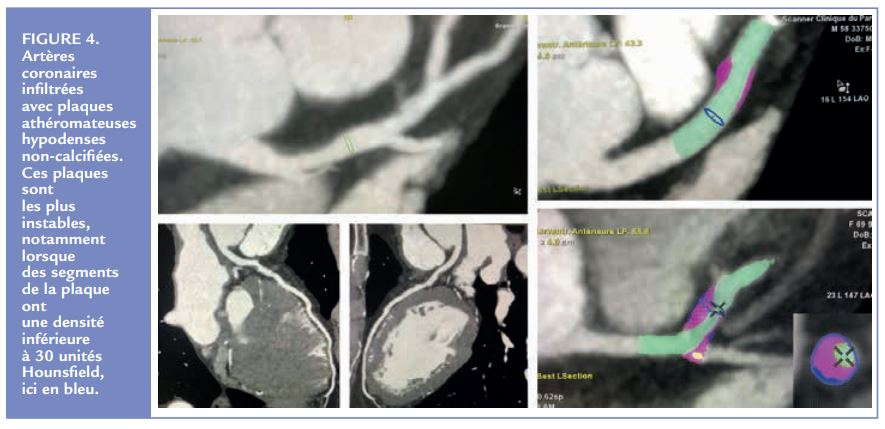
Enfin, un élément de grande importance a été permis par la cohorte SCOT-HEART grâce à une sous-étude particulièrement intéressante 32 permettant d’identifier un très fort facteur prédictif d’infarctus du myocarde fatal ou non : la présence de plaques athéromateuses hypodenses défi nies par une densité inférieure à 30 unités Hounsfield (UH), valeur facilement mesurable et automatisée au scanner. Ce facteur prédictif était plus précis que les facteurs de risque classiques tels que le tabagisme ou le diabète et plus puissant également que le score calcique. Il était même plus important pour le pronostic que le degré de sténose coronaire (ce qui est logique par rapport à la physiopathologie de l’athérosclérose, dont l’évolution n’est pas linéaire). Ainsi, réaliser le coroscanner permet non seulement d’éliminer une sténose coronaire mais également de dépister et stratifier les patients à risque cardiovasculaire élevé ainsi que de guider la stratégie thérapeutique en prévention primaire.
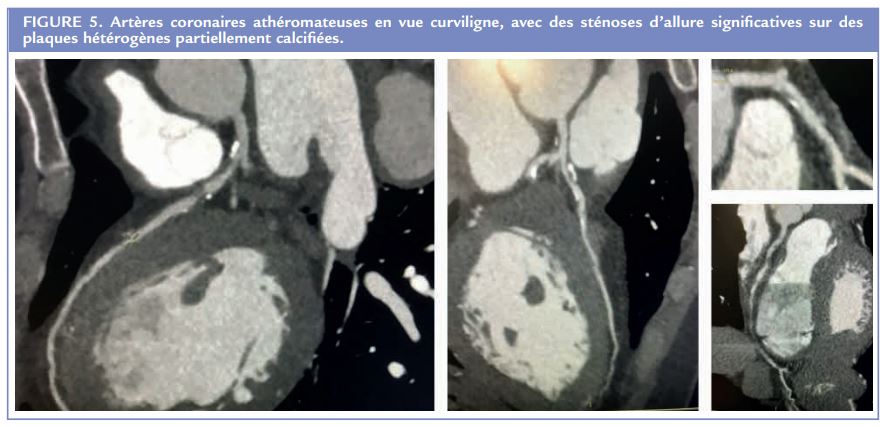
Apport du coroscanner dans la prévention cardiovasculaire primaire
Le coroscanner permet donc de stratifier les patients à risque cardiovasculaire élevé, nécessitant une prise en charge médicamenteuse par hypolipémiant ainsi que le dépistage et le traitement de tous leurs facteurs de risque cardiovasculaire, dépistage qui devrait idéalement être réalisé chez tous nos patients. Il est donc l’outil de prévention cardiovasculaire primaire idéal. Il permet de dépister une maladie grave, potentiellement mortelle et de guider un traitement (hypolipémiant notamment) qui permet de modifier le pronostic du patient. Sa réalisation est simple et rapide ; les sites équipés d’un scanner sont nombreux sur le territoire national et, à partir de 64 barrettes, la réalisation du coroscanner est relativement aisée ; l’acquisition est rapide et n’est ralentie que par la pose d’une voie veineuse selon le capital veineux du patient ; le prix de l’examen est faible et acceptable pour la société ; la pénibilité est modérée pour le patient ; l’irradiation est faible en mode prospectif, équivalente ou inférieure à celle d’une mammographie ; le risque est très faible même s’il n’est pas nul. Le seul examen à risque nul est le score calcique mais l’information apportée est floue et insuffisante.
L’examen présente des limites, comme les patients non coopérants ou ne pouvant tenir une apnée. La fibrillation auriculaire gêne la réalisation de l’examen surtout si elle est rapide. Les fortes calcifi cations rendent ininterprétables certains segments mais pas l’ensemble du réseau. L’analyse des stents est difficile mais la technique progresse. Le patient non-perfusable ou refusant une pose de perfusion n’est pas éligible. L’antécédent d’allergie à un produit de contraste iodé doit faire rechercher l’allergène précis et conduit soit à rechercher une alternative à l’examen soit à l’entourer de mesures préventives et de surveillance renforcées avant et après l’examen.
Programme national de dépistage coronaire ?
Cette force diagnostique du coroscanner doit amener à réfléchir sur la pertinence de la mise en place d’un dépistage à grande échelle de la maladie coronaire par coroscanner. En effet, le pourcentage de scanners coronaires pathologiques est supérieur à 50% dans les centres réalisant cet examen de façon courante ce qui signifi e que la prévalence de la maladie coronaire à un stade infraclinique est très élevée dans la population générale, surtout au-delà de 50 ans. Il pourrait alors se discuter de réaliser un screening de la population générale à partir de 50 ans, avec par exemple un coroscanner tous les 10 ans. Réaliser plus fréquemment l’examen ne semble pas pertinent car la maladie évolue lentement. D’autre part, dès que de l’athérosclérose coronaire a été identifiée, le traitement hypolipémiant étant mis en place, la réalisation d’un nouveau coroscanner, même au bout de 10 ans n’apparaîtrait pas forcément indiquée. Pour le coup, c’est plutôt un examen à la recherche d’une ischémie myocardique qui serait intéressant, à intervalles réguliers de 5 ans par exemple, et en évitant les examens irradiants. Si l’on effectue des dépistages pour les cancers du sein, du col de l’utérus et des cancers recto-coliques, pourquoi ne pas envisager un programme de dépistage de la maladie coronaire chronique ?
Quel bénéfice et quel risque pour une campagne de prévention par coroscanner ?
Pour qu’une campagne de dépistage soit envisagée, il faut comparer le bénéfice escompté en termes de morbimortalité et le risque lié à la réalisation de la campagne de dépistage. Sur 100.000 examens avec produit de contraste iodé, on estime que moins de 50 patients présenteront une réaction allergique grave (gérée médicalement par l’équipe soignante) dont 1 à 3 cas mortels 33. Cela doit être extrapolé au dépistage d’une population importante. Si par exemple l’on souhaitait dépister les 26 916 013 français âgés de 50 ans et plus selon l’Insee 34 ce taux de mortalité impliquerait entre 269 et 807 décès liés à l’examen de dépistage. Disons en moyenne 500 décès. Pour un dépistage réalisé tous les dix ans, cela revient donc à 50 décès par an dus au dépistage. Ce chiffre serait-il acceptable pour un examen de dépistage ? Probablement que le chiffre serait plus bas en modifiant la prise en charge diagnostique chez les patients dits atopiques, aux antécédents allergiques. Ce chiffre doit également être mis en balance avec le nombre de décès par infarctus du myocarde par an dans la même population. La mortalité pour maladies cardiovasculaires est par exemple estimée à environ 140 000 décès par an en France, infarctus du myocarde, AVC et artérite réunis. Ce qui fait environ 400 décès par jour. A mettre en parallèle par exemple avec la pandémie actuelle de COVID-19 qui fait le même nombre de décès par jour en France mais sur une durée limitée. La pandémie d’athérosclérose est durable et s’estime en décennies si ce n’est en siècles. Et le seul vaccin disponible est la prévention cardiovasculaire, le dépistage et le traitement hypolipémiant. La décision ne peut donc être que politique, en ayant pesé le pour et le contre, mais elle peut aboutir si elle est portée par des universitaires influents qui considéreraient que le jeu en vaut la chandelle.
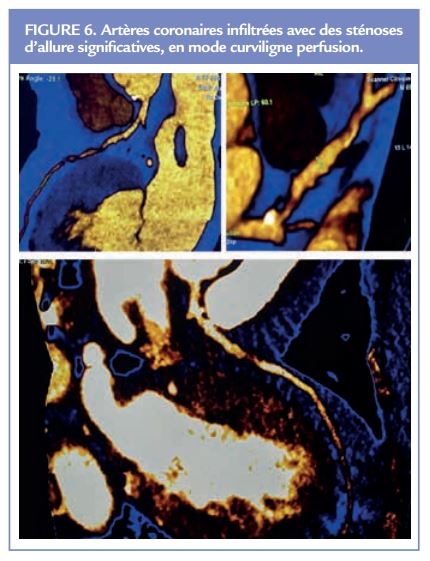
Dernier point, la mise au point de centres cardioradiologiques experts, réalisant cet examen du matin au soir (et possiblement la nuit si besoin) et du lundi au vendredi (voire au dimanche) permettrait de grouper des professionnels experts et donc de diminuer la survenue d’événements allergiques fatals. Si ces centres étaient non-seulement pourvus en cardiologues mais également en anesthésistes-réanimateurs prêts à intervenir et de manipulateurs radio tous formés aux gestes et aux médications d’urgence, la mortalité potentielle liée aux agents de contraste, actuellement estimée à 0,002% pourrait encore fortement diminuer.
Et quel intérêt pour le score calcique ?
Le score calcique a ceci de passionnant : personne ne sait dire exactement comment l’utiliser ! En effet, en 30 années depuis sa mise en place par Arthur S. Agatston en mars 1990, et près de 4 000 publications, il n’y a aucune recommandation claire et pertinente pour son utilisation. Citons tout de même les recommandations de l’ESC en 201925 qui préconisent de l’utiliser chez un patient considéré comme à risque cardiovasculaire faible ou intermédiaire en choisissant le cut-off de 100 UA (unités Agatston) pour décider de traiter par hypolipémiant. Pourquoi ce choix ? En se basant sur la littérature concernant le score calcique 36–43, on remarque que plus il est élevé plus la mortalité augmente. Il apparaît donc utilisable comme un marqueur de risque et non un facteur de risque comme le LDL-c. Cependant, quelle est la pertinence de choisir un seuil pour traiter par hypolipémiants ? Les études ont fait ainsi, c’est pour cela que les recommandations le font également, ce qui est habituel. Un premier seuil de 400 UA avait été retenu, puis un seuil de 100 UA. Tout cela n’est pas forcément logique ni adéquat en ce qui concerne la physiopathologie de l’athérosclérose. En effet, la calcification progressive d’une plaque athéromateuse est gage de stabilité en dehors des microcalcifications initiales 6–10,44,45. Les plaques dites « jeunes », avec une chape fibreuse fine et un noyau lipido-nécrotique important, sont les plus à risque de rupture et donc d’événement aigu. Elles sont identifiées par le coroscanner car elles ont une densité abaissée en-dessous de 30 UH. En revanche, elles sont totalement invisibles au score calcique. Ensuite, comment comparer un score calcique à 15 UA entre un patient qui a 25 ans et un patient qui a 83 ans ? A score calcique égal, risque égal ? Enfin, le seul seuil qui puisse éventuellement être cohérent pour le score calcique est le seuil d’une unité Agatston. En effet, dès 1 UA on sait que de l’athérosclérose coronaire est présente. Donc que le patient pourra bénéficier d’un traitement hypolipémiant. Avec cependant le risque d’être faussement rassuré par un score à zéro UA.
Décidément, le score calcique est trop imparfait pour répondre à notre interrogation qui est : « Ce patient est-il à risque ? Dois-je le traiter ? » Le coroscanner donnera une réponse beaucoup plus précise avec seulement trois possibilités :
1) Coroscanner strictement normal : Pas de traitement hypolipémiant nécessaire, prévention cardiovasculaire basée sur les autres facteurs de risque et règles hygiénodiététiques.
2) Coroscanner retrouvant des plaques athéromateuses avec sténose < 50% : Traitement hypolipémiant nécessaire, associé à une prévention cardiovasculaire de tous les facteurs de risque cardiovasculaire associés et règles-hygiéno-diététiques.
3) Coroscanner retrouvant des plaques avec sténose > 50% : Traitement hypolipémiant nécessaire avec toute la prévention cardiovasculaire nécessaire ainsi que les règles hygiéno-diététiques et recherche d’ischémie myocardique par un test dédié (IRM de stress ? ETT de stress ? Scintigraphie de stress ?).

Conclusions
Le coroscanner est un outil novateur, de plus en plus perfectionné, qui permet dès à présent de connaître de façon non-invasive le statut coronaire de nos patients. Il est peu irradiant en mode prospectif, plus irradiant en mode rétrospectif. Il comporte un risque très faible mais non-nul d’allergie à un produit de contraste iodé et ne peut être réalisé chez l’insuffi sant rénal sévère, chez la femme enceinte et chez un patient noncoopérant (confus, dément, etc.). C’est le meilleur examen à réaliser en cas de douleur thoracique, en l’absence de SCA. C’est également le meilleur examen pour le dépistage de l’athérosclérose coronaire même s’il n’est que très peu utilisé dans cette indication pour le moment. La visualisation de plaques athéromateuses permet de guider la prescription de thérapeutiques hypolipémiantes pour diminuer le risque de survenue d’événements cardiovasculaires aigus. La visualisation de sténoses permet d’indiquer la réalisation d’un test d’ischémie afin de déterminer s’il faut ou non envisager une revascularisation coronaire. Le score calcique pour sa part reste peu utilisable en pratique et pose plus de questions qu’il n’amène de réponses. Il est logique de lui préférer un coroscanner. La modification du pronostic d’un patient par suite de la réalisation du coroscanner devrait faire discuter la mise en place d’une campagne de dépistage systématique basée sur l’âge, par exemple à partir de 50 ans, à l’image de ce qui se fait pour le cancer du sein ou du colon. La sélection des patients éligibles au dépistage, en évitant ceux présentant des antécédents allergiques, ainsi qu’une équipe formée, réalisant cet examen à plein temps, devrait faire diminuer encore le risque d’une réaction allergique grave et pourrait faire envisager sa généralisation.
L’auteur déclare ne pas avoir de liens d’intérêts avec cet article
Adrien Pasteur-Rousseau – Cardiologue à l’Institut Cœur Paris Centre (ICPC). Clinique Turin (Paris 8e ), Clinique du Parc Monceau (Paris 17e ), Clinique Floréal (Bagnolet)
RÉFÉRENCES
- Fuller JH, Stevens LK, Wang SL. Risk factors for cardiovascular mortality and morbidity: the WHO Mutinational Study of Vascular Disease in Diabetes. Diabetologia. 2001 Sep;44 Suppl 2:S54-64.
- The top 10 causes of death [Internet]. [cited 2021 Feb 12]. Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death
- Maddox TM, Stanislawski MA, Grunwald GK, Bradley SM, Ho PM, Tsai TT, et al. Nonobstructive coronary artery disease and risk of myocardial infarction. JAMA. 2014 Nov 5;312(17):1754–63.
- Puchner SB, Liu T, Mayrhofer T, Truong QA, Lee H, Fleg JL, et al. High-Risk Plaque Detected on Coronary CT Angiography Predicts Acute Coronary Syndromes Independent of Significant Stenosis in Acute Chest Pain: Results From the ROMICATII Trial. J Am Coll Cardiol. 2014 Aug 19;64(7):684–92.
- Marchio P, Guerra-Ojeda S, Vila JM, Aldasoro M, Victor VM, Mauricio MD. Targeting Early Atherosclerosis: A Focus on Oxidative Stress and Inflammation. Oxid Med Cell Longev. 2019;2019:8563845.
- Diaz MN, Frei B, Vita JA, Keaney JF. Antioxidants and Atherosclerotic Heart Disease. Epstein FH, editor. N Engl J Med. 1997 Aug 7;337(6):408–16.
- Berliner JA. A Role for Oxidized Phospholipids in Atherosclerosis. N Engl J Med. 2005;3.
- Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005 Apr 21;352(16):1685–95.
- Chang H-J, Lin FY, Lee S-E, Andreini D, Bax J, Cademartiri F, et al. Coronary Atherosclerotic Precursors of Acute Coronary Syndromes. J Am Coll Cardiol. 2018 05;71(22):2511–22.
- Frostegård J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 2013 May 1;11:117.
- Tardif J-C, Kouz S, Waters DD, Bertrand OF, Diaz R, Maggioni AP, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019 Dec 26;381(26):2497–505.
- Ridker PM. From CANTOS to CIRT to COLCOT to Clinic: Will All Atherosclerosis Patients Soon Be Treated With Combination Lipid-Lowering and Inflammation-Inhibiting Agents? Circulation. 2020 Mar 10;141(10):787–9.
- Wohlford GF, Van Tassell BW, Ravindra K, Abbate A. COLCOT and CANTOS: piecing together the puzzle of inflammation and cardiovascular events. Minerva Cardioangiol. 2020 Feb;68(1):5–8.
- Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C, et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet Lond Engl. 2005 Oct 8;366(9493):1267–78.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Fulcher J, O’Connell R, Voysey M, Emberson J, Blackwell L, et al. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet Lond Engl. 2015 Apr 11;385(9976):1397–405.
- Cholesterol Treatment Trialists’ Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials. Lancet Lond Engl. 2019 Feb 2;393(10170):407–15.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet Lond Engl. 2010 Nov 13;376(9753):1670–81.
- Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015 Jun 18;372(25):2387–97.
- Giugliano RP, Cannon CP, Blazing MA, Nicolau JC, Corbalán R, Špinar J, et al. Benefit of Adding Ezetimibe to Statin Therapy on Cardiovascular Outcomes and Safety in Patients With Versus Without Diabetes Mellitus: Results From IMPROVEIT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Circulation. 2018 Apr 10;137(15):1571–82.
- Bohula EA, Wiviott SD, Giugliano RP, Blazing MA, Park J-G, Murphy SA, et al. Prevention of Stroke with the Addition of Ezetimibe to Statin Therapy in Patients With Acute Coronary Syndrome in IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial). Circulation. 2017 Dec 19;136(25):2440–50.
- Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017 04;376(18):1713–22.
- Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018 Nov 29;379(22):2097–107.
- Ray KK, Landmesser U, Leiter LA, Kallend D, Dufour R, Karakas M, et al. Inclisiran in Patients at High Cardiovascular Risk with Elevated LDL Cholesterol. N Engl J Med. 2017 Apr 13;376(15):1430–40.
- Raal FJ, Kallend D, Ray KK, Turner T, Koenig W, Wright RS, et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med. 2020 Apr 16;382(16):1520–30.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111–88.
- Collet J-P, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2020 Aug 29;
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14;41(3):407–77.
- Linde JJ, Kelbæk H, Hansen TF, Sigvardsen PE, Torp-Pedersen C, Bech J, et al. Coronary CT Angiography in Patients With Non-ST-Segment Elevation Acute Coronary Syndrome. J Am Coll Cardiol. 2020 Feb 11;75(5):453–63.
- Gray AJ, Roobottom C, Smith JE, Goodacre S, Oatey K, O’Brien R, et al. The RAPID-CTCA trial (Rapid Assessment of Potential Ischaemic Heart Disease with CTCA) – a multicentre parallel-group randomised trial to compare early computerised tomography coronary angiography versus standard care in patients presenting with suspected or confirmed acute coronary syndrome: study protocol for a randomised controlled trial. Trials. 2016 Dec 7;17(1):579.
- SCOT-HEART investigators. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial. Lancet Lond Engl. 2015 Jun 13;385(9985):2383–91.
- SCOT-HEART Investigators, Newby DE, Adamson PD, Berry C, Boon NA, Dweck MR, et al. Coronary CT Angiography and 5-Year Risk of Myocardial Infarction. N Engl J Med. 2018 06;379(10):924–33.
- Williams MC, Kwiecinski J, Doris M, McElhinney P, D’Souza MS, Cadet S, et al. Low-Attenuation Noncalcified Plaque on Coronary Computed Tomography Angiography Predicts Myocardial Infarction: Results From the Multicenter SCOTHEART Trial (Scottish Computed Tomography of the HEART). Circulation. 2020 May 5;141(18):1452–62.
- Brockow K, Ring J. Classification and pathophysiology of radiocontrast media hypersensitivity. Chem Immunol Allergy. 2010;95:157–69.
- Population par sexe et groupe d’âges | Insee [Internet]. [cited 2021 Feb 11]. Available from: https://www.insee.fr/fr/statistiques/2381474
- Agatston AS, Janowitz WR, Hildner FJ, Zusmer NR, Viamonte M, Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990 Mar 15;15(4):827–32.
- Gabriel FS, Gonçalves LFG, Melo EV de, Sousa ACS, Pinto IMF, Santana SMM, et al. Atherosclerotic Plaque in Patients with Zero Calcium Score at Coronary Computed Tomography Angiography. Arq Bras Cardiol. 2018 May 3;
- Grayburn PA. Interpreting the coronary-artery calcium score. N Engl J Med. 2012 Jan 26;366(4):294–6.
Cordiam n°40, JUIN – JUILLET 2021
