
Traitement endovasculaire des embolies pulmonaires aiguës
Introduction
Les recommandations des Sociétés Européenne et Américaines de Cardiologie codifient la prise en charge des embolies pulmonaires (EP) aiguës 1, 2. Les EP compliquées d’instabilité hémodynamique (état de choc ou hypotension) doivent bénéficier rapidement de thérapeutiques de reperfusion pulmonaire, principalement par l’administration d’une thrombolyse systémique. Les EP associant une stabilité hémodynamique à une dysfonction ventriculaire droite (VD) et à une élévation de la troponine justifient d’une surveillance accrue durant la phase initiale et la réalisation d’une thrombolyse systémique en cas d’apparition de signes de choc (5% des cas) 3 . La thrombolyse réduit la mortalité et le risque de dégradation hémodynamique dans ces situations 3, 4 et a participé à la réduction du taux de mortalité hospitalière globale de l’EP, qui est actuellement estimé à 7-11% 5 . Cependant, l’administration d’une thrombolyse systémique multiplie par 5 le risque de saignement majeur et par 10 le risque de saignement intracrânien dans l’étude randomisée Peitho (the Pulmonary EmbolIsm THrombOlysis trial)3 . L’incidence de survenue des hémorragies intracrâniennes après thrombolyse est de 3 à 5% dans des données de vie réelle 6, 7. De plus, seulement 30% des patients présentant une EP avec retentissement hémodynamique reçoivent finalement une thrombolyse 8 .
C’est dans l’optique de limiter le risque de saignement grave, intracrânien notamment, ou pour proposer des alternatives à la thrombolyse en cas de contre-indication formelle, que se développent des stratégies de reperfusion pulmonaire par voie endovasculaire. Différentes méthodes sont actuellement en cours d’évaluation comprenant la fibrinolyse in situ facilitée par les ultrasons et la thromboaspiration. Les techniques de thrombectomie mécanique avec fragmentation du thrombus au ballon, manuellement avec une sonde pigtail, ou par l’utilisation du système de thrombectomie rhéolytique AngioJet (Boston Scientific, Marlborough, MA, USA) ont désormais été abandonnées 9-11. Les procédures interventionnelles réalisées avec le système AngioJet se sont compliquées d’insuffisances rénales aiguës sur hémolyse dans 24% et de bradycardies sévères dont des asystolies dans 8% des cas 10. Ces résultats ont amené la Food and Drug Administration (FDA) Américaine à donner un avis défavorable à l’utilisation de ce dispositif dans le traitement de l’EP 12.
Réalisation de la procédure
D’un point de vue purement pratique, la réalisation d’une procédure de revascularisation pulmonaire se fait par voie veineuse fémorale préférentiellement avec cathétérisme des artères pulmonaires. Une angiographie sélective est réalisée pour définir les sites d’interventions selon la charge thrombotique.
Thrombolyse in situ dirigée par cathéter
Le traitement thrombolytique peut être administré directement au sein des thrombus pulmonaires à travers des cathéters. L’avantage de la délivrance locale est de limiter la dose de thrombolytique par au moins un facteur de 4, avec l’arrière-pensée de limiter les complications hémorragiques. Dans une méta-analyse de 35 études non contrôlées incluant un total de 544 patients avec une EP à haut risque (hypotension), 33% des patients étaient traités par thrombectomie seule et 66% par thrombectomie plus thrombolyse in situ. Le taux global de succès, défini par une stabilisation de l’état hémodynamique, une régression de l’hypoxie et la survie hospitalière, était de 85%. Le taux de succès était supérieur chez les patients traités par thrombectomie plus thrombolyse in situ. Le taux global de complications mineures était de 7,9% et le taux de complications majeures de 2,4% 13.
La diffusion d’ultrasons à haute fréquence au sein du thrombus pourrait permettre d’optimiser l’action du traitement thrombolytique en désagrégeant les fibres de fibrine du thrombus 14. Le système EKOS (Boston Scientific, Marlborough, MA, USA) est actuellement le cathéter pour lequel le plus de données est disponible. L’étude ULTIMA (The Ultrasound Accelerated Thrombolysis of Pulmonary Embolism trial) était une étude randomisée qui a évalué la prise en charge endovasculaire des EP avec une thrombolyse in situ facilitée par ultrasons 15. Dans cette étude, 59 patients avec une EP compliquée d’une dysfonction ventriculaire droite ont été randomisés pour recevoir soit de l’héparine seule (n=29), soit de l’héparine et une thrombolyse in situ (10-20 mg de tPA) facilitée par ultrasons (n=30). Le critère primaire, modification du diamètre VD/ventricule gauche (VG) mesuré en échographie entre l’admission et la 24ème heure, était significativement plus diminué dans le groupe procédure endovasculaire comparé au groupe héparine seule (0,30 ± 0,20 vs. 0,03 ± 0,16 ; p <0,001). Plusieurs autres études non-randomisées, non-comparatives ayant inclus des EP avec instabilité hémodynamique et des EP hémodynamiquement stables mais avec dysfonction VD ont retrouvé des résultats comparables en termes d’amélioration de la fonction ventriculaire droite (Figure 1) 16-28. Une méta-analyse de ces études a mis en évidence une réduction moyenne des pressions artérielles pulmonaires systoliques de 15,8 mmHg (Intervalle de confiance (IC) à 95% : 12,2-19,5) et du rapport VD/VG de 34% (IC à 95% : 25-42) 29.
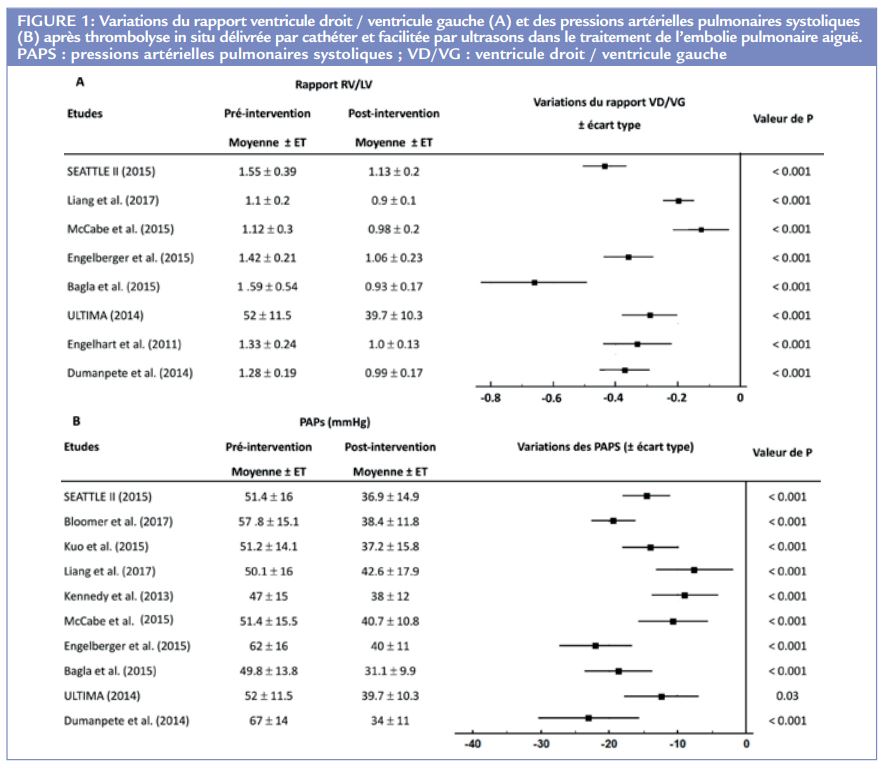
En ce qui concerne la sécurité de cette technique, le taux de mortalité était de 12,9% pour les EP à haut risque avec hypotension et de 0,74% pour les EP avec dysfonction VD et normotension dans cette méta-analyse. Les taux de saignement majeur et d’hémorragie intracrânienne étaient de 4,65% et 0,35%, respectivement 29. Le nombre assez élevé de saignements majeurs observé dans l’étude SEATTLE II (8,6%) 26, qui est la plus large étude sur le sujet avec 150 patients inclus, a été rattaché principalement à des saignements au point de ponction liés à des ponctions multiples et le traitement de ces saignements a consisté en des transfusions sans recours à la chirurgie 30. Finalement, dans une méta-analyse publiée par Tafur et al., ayant inclus 653 patients, le taux de mortalité était de 9% dans le groupe de patients traités par thrombolyse in situ sans ultrasons et de 4% dans celui traité par ultrasons 31. Le Tableau 1 résume les principales caractéristiques des études ayant analysé l’efficacité et la sécurité de la thrombolyse in situ délivrée par cathéter et facilitée par ultrasons dans le traitement de l’embolie pulmonaire aiguë 32. L’étude OPTALYSE-PE a démontré l’intérêt de la réduction de la durée ainsi que de la dose de perfusion de thrombolyse in situ. Dans cette étude, 101 patients présentant une EP à risque intermédiaire (âge moyen : 58 ans, 48% de femmes) ont été randomisés dans 4 groupes d’administration de la thrombolyse : (1) 8 mg sur 2 heures, (2) 8 mg sur 4 heures, (3) 12 mg sur 6 heures et (4) 24 mg sur 6 heures. Le critère primaire de jugement, modification du rapport VD/VG entre l’admission et la 48ème heure, diminuait significativement dans les 4 groupes, entre 23% et 26%. Le taux de saignement majeur était de 3% dont 1 saignement intracrânien. Aucun saignement majeur n’a été observé dans les 2 groupes recevant 8 mg de thrombolytique sur 2 heures et 12 mg sur 6 heures 33. Les résultats de l’étude OPTALYSE-PE avec un suivi clinique à 1 an ont montré la persistance de l’amélioration de la fonction systolique VD associée à une amélioration de la capacité fonctionnelle (évaluée par un test de marche de 6 minutes) et de la qualité de vie 34.
L’intérêt de l’utilisation des ultrasons dans le même temps que la thrombolyse in situ reste cependant débattu. L’étude SUNSET n’a en effet pas retrouvé de différence chez 81 patients randomisés entre thrombolyse in situ avec et sans ultrasons pour les critères de jugement réduction de l’obstruction pulmonaire au scanner (p = 0,76) et réduction du rapport VD/VG (p = 0,01) 35.
Thrombo-aspiration
Deux cathéters de thrombo-aspiration par l’intermédiaire de dispositifs exerçant une pression négative et sans utilisation associée de thrombolyse ont récemment démontré une efficacité et une sécurité dans la prise en charge endovasculaire des EP.
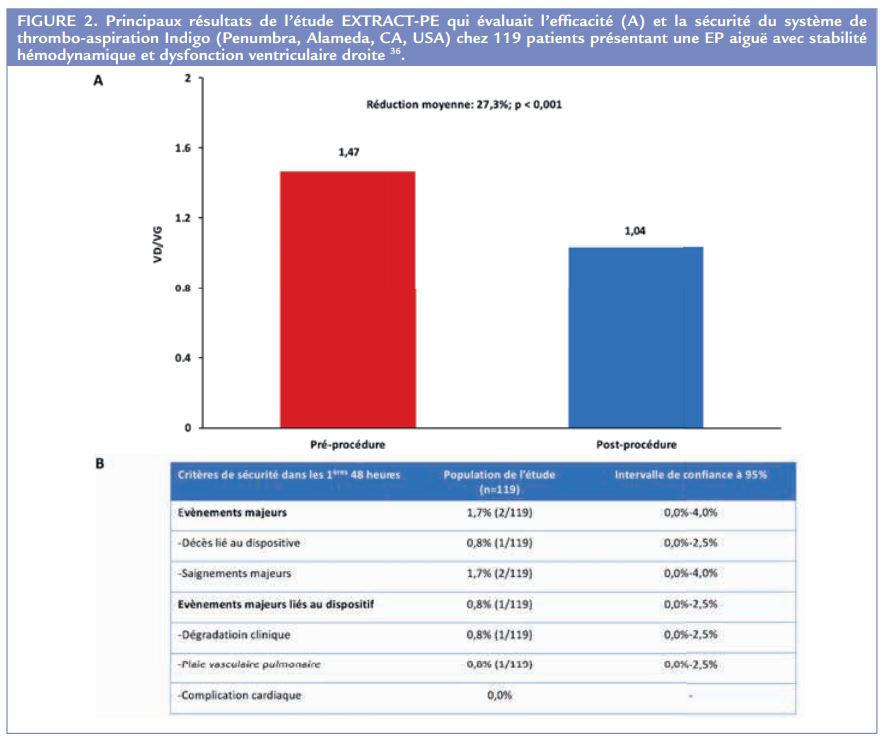
L’étude multicentrique EXTRACT-PE a évalué l’efficacité du système d’aspiration de 8 French Indigo (Penumbra, Alameda, CA, USA) chez 119 patients présentant une EP hémodynamiquement stable avec dysfonction ventriculaire droite associée. Les résultats objectivent une réduction significative de la dysfonction VD, évaluée par le rapport VD/VG qui diminue de 0,43 mm en moyenne. Deux patients (1,7%) ont présenté un saignement majeur dont un s’est compliqué du décès du patient (Figure 2) 36.
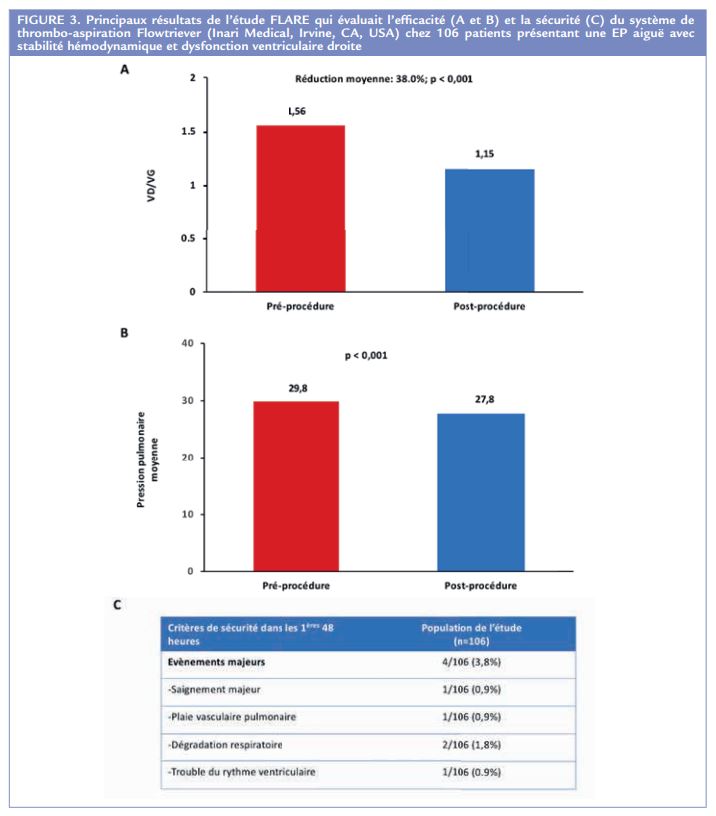
L’étude prospective et multicentrique FLARE a étudié le dispositif Flowtriever (Inari Medical, Irvine, CA, USA) dans la prise en charge des EP intermédiaires en incluant prospectivement 106 patients. Le système Flowtriever permet une aspiration à la seringue à travers un cathéter de 20-22 French après le déploiement au sein du thrombus de 3 disques (taille des disques de 10 à 18 mm). Le critère de jugement primaire, diminution du rapport VD/VG entre l’admission et la 48ème heure, était atteint avec une réduction moyenne de 0,38 mm (25,1% ; p < 0,001). Par ailleurs, le niveau de pression pulmonaire diminuait en moyenne de 29,8 mm Hg à 27,8 mm Hg entre les 2 échocardiographies (p < 0,001). Quatre patients (3.8%) ont présenté au cours de cette étude un événement indésirable grave dont 1 saignement majeur et 1 complication pulmonaire liée à l’utilisation du Flowtriever, justifiant la réalisation d’une lobectomie chirurgicale (Figure 3) 37.
Perspectives
Le rationnel du développement des techniques de revascularisation pulmonaire endoluminale repose sur la réduction du risque de saignement grave, notamment les hémorragies intracrâniennes qui représentent la complication la plus redoutée lors de l’injection d’une thrombolyse systémique. Actuellement, les procédures de thrombolyse in situ, notamment celles facilitées par ultrasons, sont celles qui ont inclus le plus d’effectifs. Cette technique ainsi que les méthodes de thrombo-aspiration avec les cathéters Indigo et Flowtriever ont montré de bons résultats avec une réduction de la dysfonction VD après intervention associée à un faible risque hémorragique. Les recommandations de la Société Européenne de Cardiologie publiées en 2019 recommandent désormais d’utiliser les procédures endovasculaires (ou l’embolectomie chirurgicale) comme une alternative à la thrombolyse systémique en cas de contre-indication à celle-ci, avec un niveau de recommandation IIa 1, 2.
Cependant, l’évaluation de ces techniques comparativement à un groupe contrôle ou à une autre stratégie de reperfusion pulmonaire n’est pas disponible et reste nécessaire. Actuellement, seulement 59 patients ont été inclus dans la seule étude randomisée évaluant le système EKOS 15, contre plus de 1700 patients randomisés dans des études sur la thrombolyse systémique 38. Par ailleurs, les critères de jugement jusqu’à présent utilisés pour évaluer les différents dispositifs de prise en charge endovasculaire des EP restent des critères intermédiaires (diminution du rapport VD/VG, diminution des pressions pulmonaires) sans information disponible sur des critères robustes comme la mortalité avec, de plus, des périodes de suivi courtes (intra-hospitalier ou 30 jours au maximum). Dans ce cadre, les registres KNOCOUT-PE (ClinicalTrials.gov NCT03426124) pour le système EKOS, et FLAME (ClinicalTrials. gov NCT04795167) pour le système Flowtriever vont prochainement être publiés et fourniront des données de mortalité (à 1 an pour KNOCOUT-PE et 45 jours pour FLAME).
Conclusions
Au cours de ces dernières années, les procédures endovasculaires de prise en charge de l’EP se sont développées avec des résultats encourageants sur des critères de jugement intermédiaires. Les données de large registre comprenant des données robustes permettront très prochainement de mieux définir l’intérêt et les indications des différents dispositifs.
Romain Chopard, MD, PhD, Service de Cardiologie, Centre Hospitalier Universitaire de Besançon
RÉFÉRENCES
- S Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, Jenkins JS, Kline JA, Michaels AD, Thistlethwaite P, Vedantham S, White RJ, Zierler BK, American Heart Association Council on Cardiopulmonary CCP, Resuscitation, American Heart Association Council on Peripheral Vascular D, American Heart Association Council on Arteriosclerosis T, Vascular B. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation 2011: 123(16): 1788-1830.
- Konstantinides SV, Meyer G. The 2019 ESC Guidelines on the Diagnosis and Management of Acute Pulmonary Embolism. European heart journal 2019: 40(42): 3453-3455.
- Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-Westendorf J, Bluhmki E, Bouvaist H, Brenner B, Couturaud F, Dellas C, Empen K, Franca A, Galie N, Geibel A, Goldhaber SZ, Jimenez D, Kozak M, Kupatt C, Kucher N, Lang IM, Lankeit M, Meneveau N, Pacouret G, Palazzini M, Petris A, Pruszczyk P, Rugolotto M, Salvi A, Schellong S, Sebbane M, Sobkowicz B, Stefanovic BS, Thiele H, Torbicki A, Verschuren F, Konstantinides SV, Investigators P. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014: 370(15): 1402-1411.
- Marti C, John G, Konstantinides S, Combescure C, Sanchez O, Lankeit M, Meyer G, Perrier A. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. European heart journal 2015: 36(10): 605-614.
- Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis. Lancet 2012: 379(9828): 1835-1846.
- Fiumara K, Kucher N, Fanikos J, Goldhaber SZ. Predictors of major hemorrhage following fibrinolysis for acute pulmonary embolism. Am J Cardiol 2006: 97(1): 127-129.
- Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999: 353(9162): 1386-1389.
- Stein PD, Matta F. Thrombolytic therapy in unstable patients with acute pulmonary embolism: saves lives but underused. Am J Med 2012: 125(5): 465-470.
- Schmitz-Rode T, Janssens U, Duda SH, Erley CM, Gunther RW. Massive pulmonary embolism: percutaneous emergency treatment by pigtail rotation catheter. J Am Coll Cardiol 2000: 36(2): 375-380.
- Chechi T, Vecchio S, Spaziani G, Giuliani G, Giannotti F, Arcangeli C, Rubboli A, Margheri M. Rheolytic thrombectomy in patients with massive and submassive acute pulmonary embolism. Catheter Cardiovasc Interv 2009: 73(4): 506-513.
- Nassiri N, Jain A, McPhee D, Mina B, Rosen RJ, Giangola G, Carroccio A, Green RM. Massive and submassive pulmonary embolism: experience with an algorithm for catheter-directed mechanical thrombectomy. Ann Vasc Surg 2012: 26(1): 18-24.
- Angiojet Xpeedior [product insert]. Minneapolis, Minn: Possis Medical, 2008; 1– 8.
- Kuo WT, Gould MK, Louie JD, Rosenberg JK, Sze DY, Hofmann LV. Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques. J Vasc Interv Radiol 2009: 20(11): 1431-1440.
- Braaten JV, Goss RA, Francis CW. Ultrasound reversibly disaggregates fibrin fibers. Thromb Haemost 1997: 78(3): 1063-1068.
- Kucher N, Boekstegers P, Muller OJ, Kupatt C, Beyer-Westendorf J, Heitzer T, Tebbe U, Horstkotte J, Muller R, Blessing E, Greif M, Lange P, Hoffmann RT, Werth S, Barmeyer A, Hartel D, Grunwald H, Empen K, Baumgartner I. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation 2014: 129(4): 479-486.
- Chamsuddin A, Nazzal L, Kang B, Best I, Peters G, Panah S, Martin L, Lewis C, Zeinati C, Ho JW, Venbrux AC. Catheterdirected thrombolysis with the Endowave system in the treatment of acute massive pulmonary embolism: a retrospective multicenter case series. J Vasc Interv Radiol 2008: 19(3): 372-376.
- Lin PH, Annambhotla S, Bechara CF, Athamneh H, Weakley SM, Kobayashi K, Kougias P. Comparison of percutaneous ultrasound-accelerated thrombolysis versus catheter-directed thrombolysis in patients with acute massive pulmonary embolism. Vascular 2009: 17 Suppl 3: S137-147.
- Engelhardt TC, Taylor AJ, Simprini LA, Kucher N. Catheter-directed ultrasound-accelerated thrombolysis for the treatment of acute pulmonary embolism. Thromb Res 2011: 128(2): 149-154.
- Kennedy RJ, Kenney HH, Dunfee BL. Thrombus resolution and hemodynamic recovery using ultrasound-accelerated thrombolysis in acute pulmonary embolism. J Vasc Interv Radiol 2013: 24(6): 841-848. 20. Dumantepe M, Uyar I, Teymen B, Ugur O, Enc Y. Improvements in pulmonary artery pressure and right ventricular function after ultrasound-accelerated catheter-directed thrombolysis for the treatment of pulmonary embolism. J Card Surg 2014: 29(4): 455-463. 21. Quintana D, Salsamendi J, Fourzali R, Narayanan G. Ultrasound-assisted thrombolysis in submassive and massive pulmonary embolism: assessment of lung obstruction before and after catheter-directed therapy. Cardiovasc Intervent Radiol 2014: 37(2): 420-426. 22. Bagla S, Smirniotopoulos JB, van Breda A, Sheridan MJ, Sterling KM. Ultrasound-accelerated catheter-directed thrombolysis for acute submassive pulmonary embolism. J Vasc Interv Radiol 2015: 26(7): 1001-1006. 23. Engelberger RP, Moschovitis A, Fahrni J, Willenberg T, Baumann F, Diehm N, Do DD, Baumgartner I, Kucher N. Fixed low-dose ultrasound-assisted catheter-directed thrombolysis for intermediate and high-risk pulmonary embolism. European heart journal 2015: 36(10): 597-604. 24. McCabe JM, Huang PH, Riedl L, Eisenhauer AC, Sobieszczyk P. Usefulness and safety of ultrasound-assisted catheter-directed thrombolysis for submassive pulmonary emboli. Am J Cardiol 2015: 115(6): 821-824. 25. Nykamp M, VandenHull A, Remund T, Santos A, Kelly P, Schultz G, Laurich C. Safety and efficacy of ultrasound-accelerated catheter-directed lytic therapy in acute pulmonary embolism with and without hemodynamic instability. J Vasc Surg Venous Lymphat Disord 2015: 3(3): 251-257. 26. Piazza G, Hohlfelder B, Jaff MR, Ouriel K, Engelhardt TC, Sterling KM, Jones NJ, Gurley JC, Bhatheja R, Kennedy RJ, Goswami N, Natarajan K, Rundback J, Sadiq IR, Liu SK, Bhalla N, Raja ML, Weinstock BS, Cynamon J, Elmasri FF, Garcia MJ, Kumar M, Ayerdi J, Soukas P, Kuo W, Liu PY, Goldhaber SZ, Investigators SI. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism: The SEATTLE II Study. JACC Cardiovasc Interv 2015: 8(10): 1382-1392. 27. Liang NL, Chaer RA, Marone LK, Singh MJ, Makaroun MS, Avgerinos ED. Midterm outcomes of catheter-directed interventions for the treatment of acute pulmonary embolism. Vascular 2017: 25(2): 130-136. 28. Yoo JW, Choi HC, Lee SJ, Cho YJ, Lee JD, Kim HC. Comparison between systemic and catheter thrombolysis in patients with pulmonary embolism. Am J Emerg Med 2016: 34(6): 985-988. 29. Bloomer TL, El-Hayek GE, McDaniel MC, Sandvall BC, Liberman HA, Devireddy CM, Kumar G, Fong PP, Jaber WA. Safety of catheter-directed thrombolysis for massive and submassive pulmonary embolism: Results of a multicenter registry and meta-analysis. Catheter Cardiovasc Interv 2017: 89(4): 754-760. 30. Sadiq I, Goldhaber SZ, Liu PY, Piazza G, Submassive, Massive Pulmonary Embolism Treatment with Ultrasound AcceleraTed ThromboLysis ThErapy I. Risk factors for major bleeding in the SEATTLE II trial. Vasc Med 2017: 22(1): 44-50. 31. Tafur AJ, Shamoun FE, Patel SI, Tafur D, Donna F, Murad MH. Catheter-Directed Treatment of Pulmonary Embolism: A Systematic Review and Meta-Analysis of Modern Literature. Clin Appl Thromb Hemost 2017: 23(7): 821-829. 32. Chopard R, Ecarnot F, Meneveau N. Catheter-directed therapy for acute pulmonary embolism: navigating gaps in the evidence. Eur Heart J Suppl 2019: 21(Suppl I): I23-I30. 33. Tapson VF, Sterling K, Jones N, Elder M, Tripathy U, Brower J, Maholic RL, Ross CB, Natarajan K, Fong P, Greenspon L, Tamaddon H, Piracha AR, Engelhardt T, Katopodis J, Marques V, Sharp ASP, Piazza G, Goldhaber SZ. A Randomized Trial of the Optimum Duration of Acoustic Pulse Thrombolysis Procedure in Acute Intermediate-Risk Pulmonary Embolism: The OPTALYSE PE Trial. JACC Cardiovasc Interv 2018: 11(14): 1401-1410. 34. Piazza G, Sterling KM, Tapson VF, Ouriel K, Sharp ASP, Liu PY, Goldhaber SZ. One-Year Echocardiographic, Functional, and Quality of Life Outcomes After Ultrasound-Facilitated Catheter-Based Fibrinolysis for Pulmonary Embolism. Circ Cardiovasc Interv 2020: 13(8): e009012. 35. Avgerinos ED, Jaber W, Lacomis J, Markel K, McDaniel M, Rivera-Lebron BN, Ross CB, Sechrist J, Toma C, Chaer R, Collaborators Ss. Randomized Trial Comparing Standard Versus Ultrasound-Assisted Thrombolysis for Submassive Pulmonary Embolism: The SUNSET sPE Trial. JACC Cardiovasc Interv 2021: 14(12): 1364-1373. 36. Sista AK, Horowitz JM, Tapson VF, Rosenberg M, Elder MD, Schiro BJ, Dohad S, Amoroso NE, Dexter DJ, Loh CT, Leung DA, Bieneman BK, Perkowski PE, Chuang ML, Benenati JF, Investigators E-P. Indigo Aspiration System for Treatment of Pulmonary Embolism: Results of the EXTRACT-PE Trial. JACC Cardiovasc Interv 2021: 14(3): 319-329. 37. Tu T, Toma C, Tapson VF, Adams C, Jaber WA, Silver M, Khandhar S, Amin R, Weinberg M, Engelhardt T, Hunter M, Holmes D, Hoots G, Hamdalla H, Maholic RL, Lilly SM, Ouriel K, Rosenfield K, Investigators F. A Prospective, Single-Arm, Multicenter Trial of Catheter-Directed Mechanical Thrombectomy for Intermediate-Risk Acute Pulmonary Embolism: The FLARE Study. JACC Cardiovasc Interv 2019: 12(9): 859-869. 38. Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky RL, Sardar P, Kumbhani DJ, Mukherjee D, Jaff MR, Giri J. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA 2014: 311(23): 2414-2421.
