
Remplacement valvulaire mitral percutané avec le dispositif Tendyne©
Avec la courtoisie des Docteurs Dr Pinelli, Dr Delesalle, Dr Laurent (Hôpital Clinique Claude Bernard, Metz)
HDLM
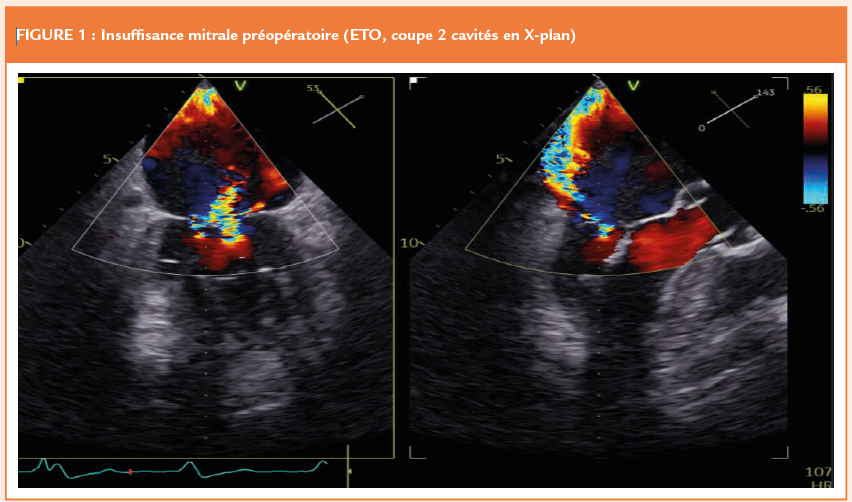
Une patiente de 85 ans, avec pour antécédents une BPCO, un lupus érythémateux systémique contrôlé, et pontage aorto-coronaire se présente avec une fuite mitrale sévère, symptomatique (OAP récidivants avec dyspnée majeure à la parole, NYHA IV). Devant le retentissement clinique des symptômes et le souhait de la patiente, une prise en charge invasive de la valvulopathie mitrale a été discutée au sein de la Heart-Team. Néanmoins, devant le haut risque chirurgical d’un remplacement valvulaire conventionnel redux sur un terrain respiratoire et auto-immun, un traitement percutané a été envisagé. Il s’agissait d’une fuite mixte association dilatation annulaire, avec pour antécédents une restriction de mobilité des feuillets en lien avec une dégénérescence myxoïde et un prolapsus postérieur. En prenant en compte la restriction et la longueur insuffisante du feuillet postérieur, la fermeture de la fuite mitrale par un Mitraclip© n’était pas possible.
Nous avons donc envisagé un autre dispositif de traitement percutané des fuites mitrales sévères : la valve Tendyne©. Les informations nécessaires en échocardiographie pour déterminer si l’implantation d’une Tendyne© est possible sont notamment les dimensions et l’orientation de la chambre de chasse ventriculaire gauche, la présence d’un mouvement systolique antérieur du feuillet mitral, la morphologie de l’appareil sous valvulaire mitral et le mécanisme de la fuite. Au scanner cardiaque, il convient d’analyser la segmentation de l’anneau mitral pour en déterminer la surface annulaire, le périmètre, le diamètre septal-latéral et inter-commissural ainsi que le degré de calcification annulaire. Ces données sont utilisées pour déterminer la taille de la prothèse, le site d’entrée dans le ventricule gauche et le degré potentiel d’obstruction de la chambre de chasse ventriculaire gauche.
Dispositif Tendyne©
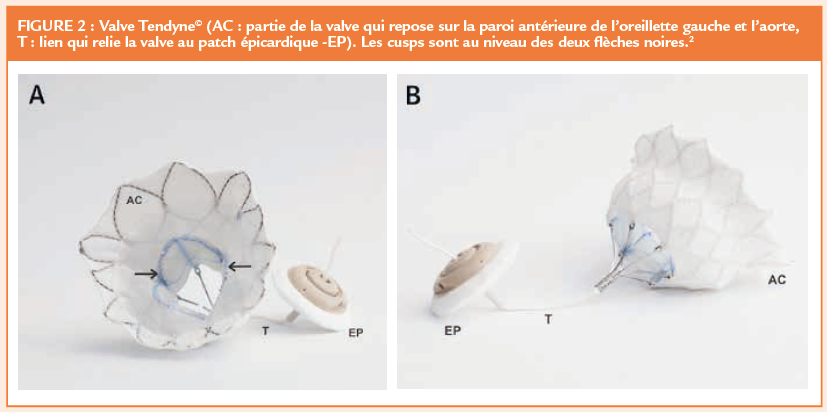
La valve mitrale Tendyne est une valve auto-expandable en nitinol construite en 2 parties (Figure 2). (1,2) Les valves implantées doivent être plus grandes que l’orifice mitral natif. La valve est en forme de D pour épouser la forme anatomique de l’orifice mitral. Elle est recouverte de péricarde de porc et d’une manchette en polyéthylène téréphtalate pour faciliter l’étanchéité de la valve dans l’anneau mitral. La valve se poursuit par un néo-cordage qui la relie au patch posé à l’extérieur de la cavité ventriculaire pour fermer l’orifice d’entrée trans-apical.
Procédure interventionnelle
L’intervention a été réalisée sous anesthésie générale par une mini-thoracotomie latérale gauche, après explication à la patiente des modalités thérapeutiques, des bénéfices attendus et des risques encourus en lien avec la procédure. La zone d’accès apicale et l’alignement optimal pour l’abord ventriculaire gauche ont été repérés grâce au scanner cardiaque et au guidage échographique per-procédure. Une fois la zone déterminée avec soin, un cathéter introducteur de 34F y a été inséré sur un guide de 0,035, jusqu’à l’oreillette gauche, en évitant de s’enchevêtrer dans l’appareil sous-valvulaire mitral.
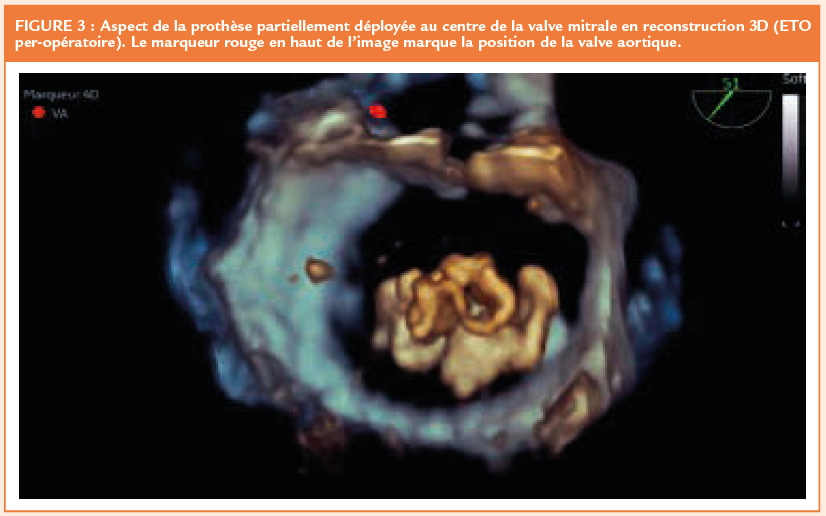
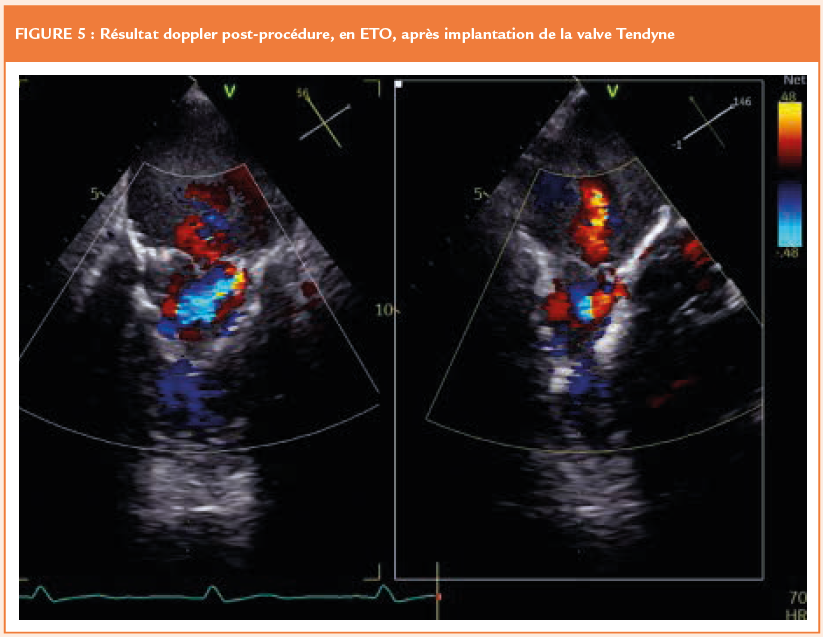
La prothèse est ensuite introduite dans la gaine, puis partiellement ouverte dans l’oreillette gauche. Grâce au guidage ETO, le « feuillet prothétique » antérieur (le plus long) est aligné avec le segment A2 (« clocking »). La valve est ensuite totalement déployée jusqu’à reposer sur l’anneau mitral. La difficulté de cette manœuvre de déploiement réside dans la nécessité de maintenir fixe la zone de largage. On place donc initialement l’orifice de la gaine quelques millimètres au-dessus de l’anneau mitral, orifice qu’on recule ensuite progressivement vers le VG tout au long du déploiement de la prothèse. A noter que l’on est réalisé en coordination entre les 3 opérateurs (cardiologie interventionnel, chirurgien cardiaque et échographiste). Le guidage ETO « live » est donc primordial à cette étape. En raison d’une fuite persistante, la prothèse a été recapturée une fois et repositionnée, avec un résultat tout à fait satisfaisant (Figures 4 et 5). Si le résultat obtenu après déploiement n’avait pas été satisfaisant (fuite résiduelle ou obstruction de la chambre de chasse), le dispositif aurait pu être à nouveau recapturé ou entièrement récupéré grâce à une gaine spécifique. Pour terminer, le patch épicardique a été apposé à l’apex pour refermer la voie d’abord, un dernier ajustement de la tension entre ce dernier et la prothèse étant nécessaire.
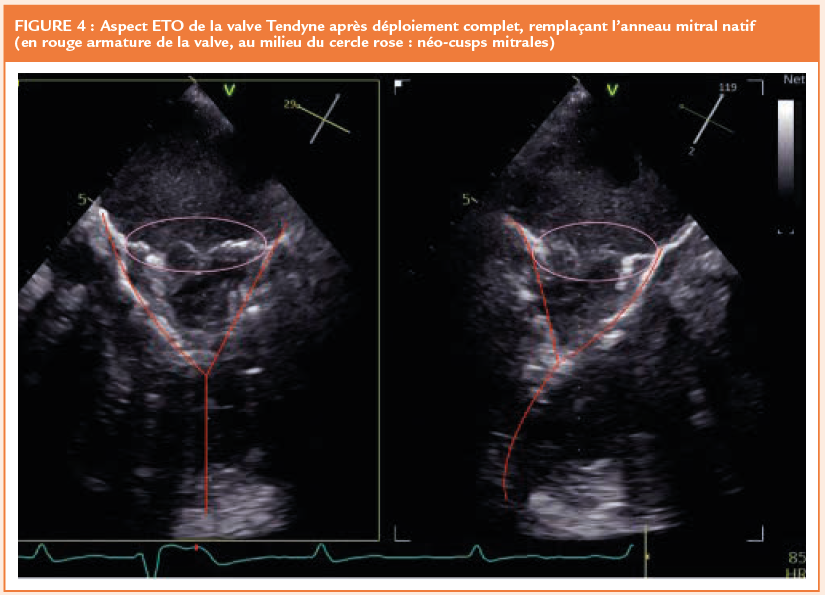
Les suites post-procédure ont été simples. La patiente doit être traitée par Aspirine 75mg avec une anticoagulation curative par Héparine non fractionnée puis relais par Warfarine pendant 3 mois, avec un INR cible de 2,5 à 3,5.
Données de la littérature
Le dispositif Tendyne© créé par la société Abbott a reçu le marquage CE en Europe au début de l’année 2020. Depuis, les résultats sur le pronostic à 2 ans après implantation de la Tendyne© ont été publiés dans le JACC. (3) Muller et al. décrivent les résultats de 100 patients inclus dans une étude en prospective non randomisée en ouvert. Il s’agissait de patients âgés à haut risque chirurgical (âge 74,7±7,0 ans, 69% d’hommes, 66% NYHA ≥ III) avec une insuffisance mitrale secondaire ou mixte dans l’écrasante majorité (89%) des cas. La valve a presque toujours (97%) pu être implantée avec succès. Le résultat pronostique a montré une mortalité toutes causes à 2 ans de 39% dont plus d’un tiers dans les premiers 90 jours. On notait également une réduction significative des hospitalisations pour insuffisance cardiaque associée à une amélioration majeure des symptômes à 1 et 2 ans (NYHA I-II dans >80% des cas).
›› A ce jour, la pose de dispositif Tendyne© n’est pas prise en charge par la Sécurité Sociale, sa place dans la stratégie thérapeutique de l’insuffisance mitrale est encore à définir.
Orianne Weizman, Paris
Références
1. Dahle G. Current Devices in TMVI and Their Limitations: Focus on Tendyne. Front Cardiovasc Med. 2020;7:592909.
2. Muller DWM, Farivar RS, Jansz P, Bae R, Walters D, Clarke A, et al. Transcatheter Mitral Valve Replacement for Patients With Symptomatic Mitral Regurgitation. J Am Coll Cardiol. janv 2017;69(4):381-91.
3. Muller DWM, Sorajja P, Duncan A, Bethea B, Dahle G, Grayburn P, et al. 2-
