Un traitement non invasif par thérapie ultrasonore du rétrécissement aortique calcifié : du rêve à la réalité
Je me propose ici de retracer dans ce court article l’aventure Cardiawave ou comment une idée plutôt saugrenue a pu se traduire en une réalité clinique avec un dispositif médical unique au monde développé par une start-up française Cardiawave, spin-off de l’université de Paris Cité, du CNRS et de l’Inserm.
Genèse
Très tôt pendant mon internat de cardiologie à Paris passant dans les grands centres de cardiologie et de chirurgie cardiaque de la capitale et plus particulièrement de l’hôpital Broussais et de Boucicaut, j’étais frappé par la lourdeur des interventions valvulaires cardiaques et de leur caractère très invasif impliquant une chirurgie à cœur ouvert avec sternotomie à la scie électrique et circulation extracorporelle, alors que la fonction myocardique était globalement conservée. Sous la direction des Professeurs Albert Hagège et Michel Desnos qui m’ont soutenu tout le long de ma carrière, j’entreprends un master d’imagerie. Ils m’envoient ensuite en post doc (1999-2001) dans le laboratoire d’échocardiographie du Pr Robert A Levine (Massachussetts General Hospital, Harvard Medical School, Boston, MA, USA), avec qui je collabore encore maintenant. Ce passage clé m’a permis d’appréhender les ultrasons cardiovasculaires non pas comme un seul outil d’imagerie mais comme un outil de meilleure compréhension des maladies valvulaires afin d’améliorer leur traitement en développant ainsi une nouvelle technique de réparation de la fuite mitrale secondaire encore utilisée actuellement, la section des cordages basaux ou « chordal cutting ». Pendant ce fellowship j’ai pu aussi observer l’impact majeur de l’interaction médecins chercheurs, physiciens et ingénieurs : nous avions effectivement une fois par mois des réunions au Massachusetts General Hospital-Massachusetts Institute of Technology (MIT) afin de transférer les applications physiques ou d’ingénierie aux problématiques des cliniciens et chercheurs en cardiologie.
L’émergence d’un concept
A mon retour en France, je voulais perpétuer cette méthode et j’ai commencé une collaboration avec l’équipe de l’Institut Langevin de Mathias Fink de l’Ecole Supérieure de Physique et de Chimie Industrielles (ESPCI) puis ensuite celle de Michael Tanter de l’Unité Inserm Physique pour la médecine. C’est lors d’une réunion en 2010 dans le laboratoire de recherche du Pr Carpentier alors que je présentais l’ensemble des progrès extraordinaires réalisés par l’équipe de Mathias Fink et Michael Tanter, leader mondial dans le domaine des ultrasons, que cette idée m’est venue avec mon alter ego physicien Mathieu Pernot, ancien de Columbia University et membre de l’équipe de Michael Tanter. Cette équipe a développé des techniques d’ultrason fascinantes et avant-gardistes comme l’échographie UltraFast, l’élastographie ShearWave Imaging, le Doppler vectoriel (avec des applications vasculaires étudiées dans le service de médecine vasculaire de l’HEGP grâce au Pr Joseph Emmerich qui me fi t venir en tant que PUPH dans le service) basées sur le retournement temporel des ondes et aussi des techniques de thérapies par ultrason privilégiant les phénomènes de cavitation plutôt que de HIFU (High Intensity Focused Ultrasound). L’idée était donc double : se baser sur le concept de réparation valvulaire du Professeur Alain Carpentier en ciblant la dysfonction valvulaire en l’occurrence, pour le RAC, la restriction du mouvement des feuillets calcifiés et rigides tout en conservant la valve native et deuxièmement réaliser cela de façon non invasive en utilisant des ultrasons à très haute pression et à très haute fréquence, guidés en temps réel par une échocardiographie transthoracique. Le but étant de ramollir les feuillets, de baisser leur rigidité et ainsi d’améliorer leur mobilité pour permettre une amélioration de la surface d’ouverture aortique.
En 2010 le TAVI inventé par le Professeur Alain Cribier en 2002 commençait déjà à s’imposer en pratique clinique et faisait déjà des merveilles mais soulignait aussi combien ces patients étaient fragiles et porteurs de nombreuses comorbidités et susceptibles donc de bénéficier de techniques moins invasives. Depuis, le TAVI est encore plus performant et est appliqué à des patients de plus en plus jeunes posant alors la problématique de la durabilité et de la nécessité de réintervenir, avec des interventions de « valve in valve ». Une procédure non invasive pouvant reculer le plus longtemps le TAVI permettrait peut-être ainsi d’éviter deux interventions pour ces patients.
Les étapes techniques initiales
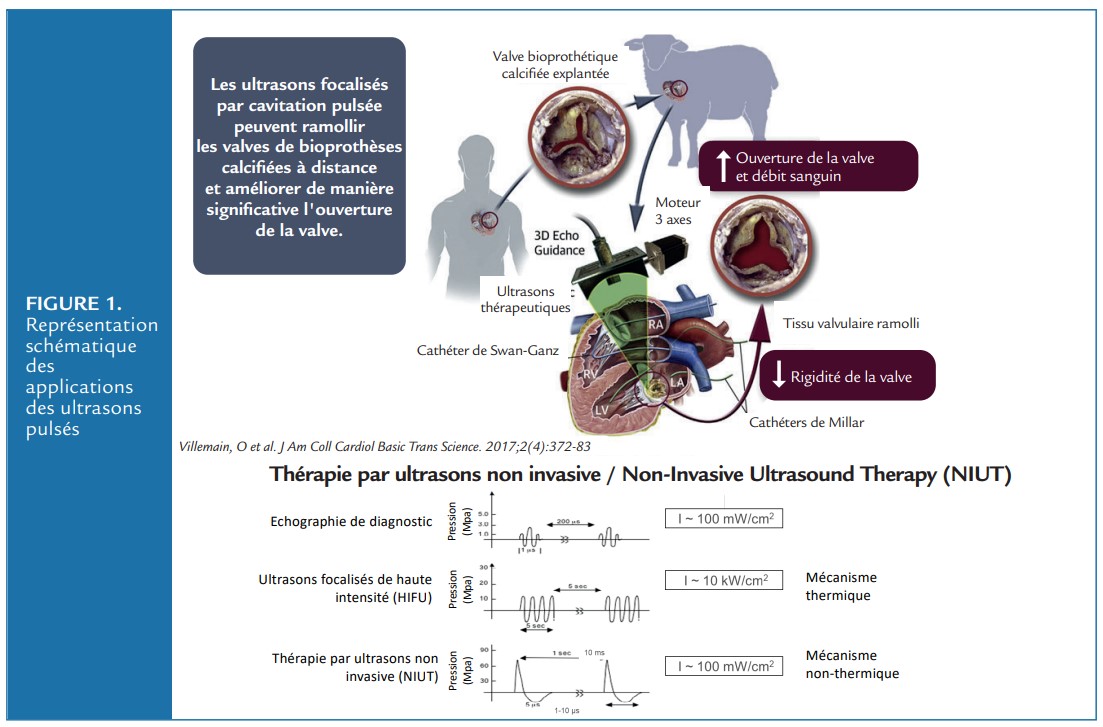
Il fallait donc commencer à faire la preuve du concept et pour les dispositifs médicaux on passe par les tests in vitro et in vivo avant de passer chez l’homme. Problème, il n’existe pas dans le monde de modèles animaux ou in vitro de RAC susceptibles de mimer la maladie humaine. Ainsi, avec Mathieu Pernot et notre thésard de sciences de l’époque Olivier Villemain, nous avons réalisé un modèle in vitro utilisant des bancs hydrauliques mimant le débit cardiaque avec à sa sortie des valves biologiques aortiques porcines calcifi ées explantées de patients opérés pour bioprothèses sténosantes. Nous avons développé dans le même temps un transducteur de thérapie d’ultrasons permettant la cavitation couplée à une sonde d’échographie. Cette technologie « non invasive ultrasound therapy » (NIUT) émet de courtes impulsions ultrasonores à haute pression à travers les tissus pour générer au niveau de la zone cible (les feuillets valvulaires calcifi és), un nuage de cavitation énergétique composé de bulles microscopiques dont l’implosion va permettre la création d’ondes de choc qui vont venir fragmenter les calcifications à l’intérieur du tissu
valvulaire pour redonner de la souplesse à la valve.
Les résultats initiaux sont très prometteurs : on est capable de diminuer de 50% le gradient de ses valves après une heure de thérapie et on corrèle ces résultats à la diminution de la rigidité évaluée de façon non invasive par le ShearWave imaging, technique d’élastographie développée par l’Institut Langevin et l’Unité Inserm la Physique pour la Médecine (U1273). Forts de ces résultats il nous fallait absolument une validation in vivo. En l’absence de modèle de RAC, l’idée a été d’implanter sous CEC des bioprothèses calcifiées serrées prélevées chez des patients en position mitrale chez le mouton et d’évaluer l’effet de la cavitation ultrasonore sur le gradient valvulaire et la surface d’ouverture et ce thorax ouvert en aigu. Cette expérimentation était très complexe et a nécessité toute l’équipe du labo gros animal de la fondation Carpentier et d’un chirurgien cardiaque Alain Bel avec qui je collaborais déjà depuis des années sur d’autres modèles expérimentaux.
Naissance d’une start-up
Les résultats positifs sont publiés sur le JACC Basic Trans Sciences en 2017 (Figure 1), alors qu’on avait déjà fondé en 2015 avec l’équipe de physiciens de l’Institut Langevin la start Figure 1. Représentation schématique des
up Cardiawave, spin-off de l’université de Paris, du CNRS et de l’Inserm dirigé et cofondé par notre talentueux CEO Benjamin Bertrand toujours à la tête de cette start-up 7 ans après.
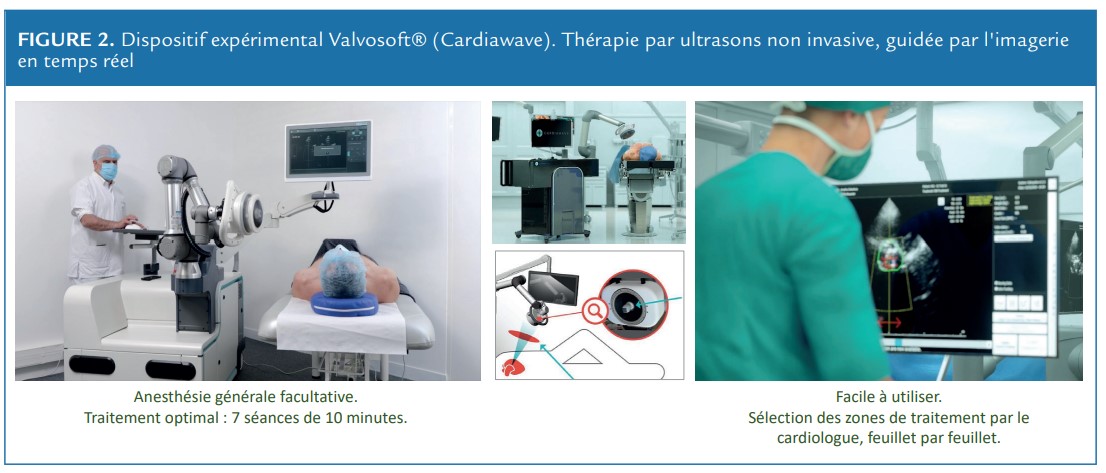
Cette start-up a la chance d’avoir comme membres de son conseil scientifique les Professeurs Alain Cribier, Roxana Merhan, Robert A Levine et les équipes de physiciens de l’ESPCI. Ce soutien entrepreneurial nous a permis alors de développer des prototypes de dispositifs médicaux de thérapie par ultrasons non-invasive (dispositifs de NIUT) de plus en plus performants, pouvant générer des ultrasons de haute énergie et haute fréquence qui ont la capacité de focaliser à travers la cage thoracique sur un point focal donné sur la valve aortique et de déplacer le point focal latéralement et en profondeur grâce à un guidage mécanique et électronique impliquant l’utilisation d’un transducteur multi-annulaire. Cette sonde émet de courtes impulsions ultrasonores à haute pression qui vont fragmenter les calcifications.
Le dispositif Valvosoft est un appareil mobile utilisant des ultrasons thérapeutiques non invasifs, guidés par un système d’imagerie échocardiographique qui permet de suivre en temps réel les mouvements de la valve aortique pour cibler avec précision la zone d’effet des ultrasons thérapeutiques. Un bras robotique motorisé facilite le guidage et le positionnement de l’applicateur au bout duquel est attaché le transducteur de thérapie et la sonde d’imagerie échocardiographique (Figure 2).
Le passage à la clinique
Sur la base de ces résultats précliniques très prometteurs, une étude clinique (Valvosoft® FIM study) a démarré en 2019. Quarante patients avec un RAC sévère symptomatique, non éligibles au remplacement valvulaire, ont été traités avec ce dispositif de NIUT (France, Pays-Bas et Serbie). Les résultats très encourageants sur l’efficacité et la sûreté de ce dispositif ont permis d’améliorer significativement la condition de vie des patients en réduisant la sévérité de leur RAC avec des diminutions des gradients de pression aortiques et une augmentation marquante de la surface d’ouverture aortique. Les résultats des 10 premiers patients réalisés sur l’HEGP et l’Amphia Hospital en Hollande sont publiés dans Circulation en mars 2021.
La période de crise sanitaire 2019-2021 a freiné les activités cliniques, les difficultés d’accès aux hôpitaux ainsi que les restrictions de voyage ont empêché la bonne tenue des études cliniques. Cardiawave a su faire preuve de créativité et a redoublé d’efforts en proposant aux opérateurs hors de l’HEGP de traiter des patients en présence d’un support technique délivré via une interface de suivi vidéo/audio permettant de suivre les procédures de France directement sur place par Cardiawave, et sous ma direction..
La fin de la crise sanitaire, et en dépit des nombreuses restrictions qui ont suivi, a néanmoins permis à Cardiawave de terminer la première étude clinique avec le traitement des derniers patients au premier semestre 2022 à Belgrade, en Serbie, pays européen où l’accès aux soins est plus difficile. Le succès obtenu sur les patients traités avec le dispositif de Cardiawave ouvre le champ des possibles dans les pays à forte densité. Cette étude à Belgrade a permis de réaliser des IRM cérébraux avant et après procédure démontrant l’absence d’AVC asymptomatiques chez ces patients. Finalement, c’est un total de 40 patients qui ont été traités par la version 1 de Valvosoft avec pour certains un suivi de 24 mois. Aucun événement grave n’a été enregistré pendant la procédure : pas d’infarctus, pas d’AVC ni de décès per procédure. La faisabilité et l’innocuité de cette technique sont donc démontrées chez ces patients très sévères, contrindiqués au TAVI ou à la chirurgie. Une amélioration de 21 % de l’AVA a été retrouvée chez ces patients.
Depuis Juin 2022, Cardiawave a initié une étude en vue de l’obtention du marquage CE (Valvosoft® Pivotal Study), avec une nouvelle génération du dispositif
Valvosoft qui améliore grandement les fonctionnalités de la première version, notamment pour les médecins : – système d’imagerie amélioré,
– meilleure maniabilité,
– nouvelle interface intuitive avec de nouvelles fonctionnalités de traitement.
Le tout embarqué dans un nouveau dispositif plus compact.
L’étude CE multicentrique (France, Pays-Bas, Allemagne) se poursuit, huit patients ont pu bénéficier du traitement par NIUT proposé par Cardiawave avec cette nouvelle génération du dispositif, toujours avec d’excellents résultats (Figure 3).

Le futur
De nombreux challenges persistent :
– Améliorer le dispositif avec une meilleure imagerie utilisant du 3D temps réel.
– Traiter des patients moins graves en ciblant les patients avec RAC de sévérité moyenne.
– Enfin probablement répéter cette thérapie plusieurs fois sur un même patient en ambulatoire (déjà réalisés sur quelques patients) afin améliorer l’efficacité et la pérennité du résultat obtenu.
Pour conclure, lorsque j’ai écrit cet article, j’ai pris conscience du chemin parcouru, de l’effort d’équipe multidisciplinaire et du temps passé (plus de huit ans) afin de transformer une idée et une hypothèse en réalité clinique avec la mise au point d’un dispositif dédié unique au monde, et des essais cliniques en cours. L’aventure n’est pas fi nie. Au contraire elle ne fait que commencer et a besoin de l’aide de toute la cardiologie et des industries d’imagerie afin de poursuivre cette voie du tout non invasif dans le traitement des maladies valvulaires cardiaques.
Emmanuel Messas, APHP, Paris
RÉFÉRENCES
- Messas E, IJsselmuiden A, Goudot G, Vlieger S, Zarka S, Puymirat E, Cholley B, Spaulding C, Hagège AA, Marijon E, Tanter M, Bertrand B, Rémond MC, Penot R, Ren B, den Heijer P, Pernot M, Spaargaren R. Feasibility and Performance of Noninvasive Ultrasound Therapy in Patients With Severe Symptomatic Aortic Valve Stenosis: A First-in-Human Study. Circulation. 2021 Mar 2;143(9):968-970. doi: 10.1161/CIRCULATIONAHA.120.050672. Epub 2021 Jan 25. PMID: 33486971.
- Smadja DM, Goudot G, Gendron N, Zarka S, Puymirat E, Philippe A, Spaulding C, Peronino C, Tanter M, Pernot M, Messas E. Von Willebrand factor multimers during non invasive ultrasound therapy for aortic valve stenosis. Angiogenesis. 2021 Nov;24(4):715-717. doi: 10.1007/s10456-021-09803-8. Epub 2021 Jun 8. PMID: 34101096.
- Messas E, Rémond MC, Goudot G, Zarka S, Penot R, Mateo P, Kwiecinski W, Escudero DS, Bel A, Ialy-Radio N, Bertrand B, Bruneval P, Marijon E, Spaargaren R, Tanter M, Pernot M. Feasibility and safety of non-invasive ultrasound therapy (NIUT) on an porcine aortic valve. Phys Med Biol. 2020 Oct 26;65(21):215004. doi: 10.1088/1361-6560/aba6d3. PMID: 33104523.
- Villemain O, Robin J, Bel A, Kwiecinski W, Bruneval P, Arnal B, Rémond M, Tanter M, Messas E, Pernot M. Pulsed Cavitational Ultrasound Softening: a new non-invasive therapeutic approach of calcified bioprosthetic valve stenosis. JACC Basic Transl Sci. 2017 Aug;2(4):372- 383. doi: 10.1016/j.jacbts.2017.03.012. PMID: 29367953; PMCID: PMC5777603.
- Messas E, Guerrero JL, Handschumacher MD, Conrad C, Chow CM, Sullivan S, Yoganathan AP, Levine RA. Chordal cutting: a new therapeutic approach for ischemic mitral regurgitation. Circulation. 2001 Oct 16;104(16):1958-63. doi: 10.1161/hc4201.097135. PMID: 11602501.