
INTERVIEW DU PROFESSEUR ALAIN CRIBIER
Avec de la persévérance et beaucoup de chance, on peut atteindre ses objectifs.
Alain Cribier, né le 25 janvier 1945 à Paris, est Professeur Emérite. Ancien Chef du Service de Cardiologie du CHU de Rouen jusqu’en 1993. Il a été ensuite Directeur Médical du Rouen Medical Training Center de Rouen qu’il a contribué à créer et est maintenant responsable des formations cardiovasculaires de ce centre. Il est à l’origine de la technique de remplacement percutané de la valve aortique, le TAVI (Transcatheter Aortic Valve Implantation) avec une première mondiale en 2002.
Quel est votre parcours ? comment en êtes-vous arrivé jusqu’au TAVI ? et comment une personne peut avoir à un moment donné cette idée et parvient à la concrétiser ?
Pour répondre à vos questions concernant le développement des technologies mises au point à Rouen depuis maintenant plus de 30 ans, je vais d’abord vous retracer brièvement mon parcours.
Une vie avant le TAVI…
J’ai eu beaucoup de chance dans ma carrière. D’abord, la chance de faire mes études de médecine à Paris dans de prestigieux services de chirurgie cardiaque et de cardiologie très orientés vers les innovations technologiques de l’époque. Ça se passait dans les années 70, ce qui ne nous rajeunit pas ! A l’hôpital Broussais, J’ai été l’instrumentiste du professeur Dubost pendant 4 ans et j’étais captivé par le résultat de ses innovations. Bien entendu, j’étais parti avec l’idée de devenir chirurgien cardiaque. Et puis est arrivé Mai 68. Il n’était pas vraiment très couru de passer des examens et des concours cette année-là et j’ai décidé de faire un certificat d’études supérieures de cardiologie. J’ai séjourné dans de grands services à Saint Antoine et à Tenon notamment ou les techniques de cathétérisme cardiaque se développaient, encore presque expérimentales. J’ai très tôt participé à ces investigations, révolutionnaires à l’époque. J’ai été parmi les premiers à appliquer le cathétérisme cardiaque gauche via le ventricule gauche par la pointe du cœur. J’ai assisté aussi aux premières coronographies : une grande époque. Les gens de l’hôpital Tenon, notamment Robert Haïat avec lequel j’avais des relations privilégiées et qui reste un ami très proche, m’ont poussé à passer l’internat. Ce n’était pas dans mes objectifs, j’étais prêt à m’installer dans le privé à Paris. Sur ces conseils, J’ai choisi Rouen pour m’éloigner de la capitale et parce que la ville était à 1 heure de Paris par l’autoroute, et c’est comme cela que j’y suis arrivé pour passer l’internat en 1972. Le service de cardiologie, dirigé par le Pr Brice Letac, était à la pointe. Le Pr Letac était un des premiers cardiologues français à avoir séjourné aux USA à une époque où ça ne se faisait guère. Il avait travaillé notamment avec Sones, pionnier de la coronographie, technique qu’il a « importée » à Rouen. Il a été très heureux de me voir arriver car j’étais le seul à avoir eu une expérience du cathétérisme et de la coronographie à Paris. J’ai passé là mon internat à développer mon expérience en cardiologie invasive. A la fin de mon internat, c’est lui qui a organisé un séjour crucial pour mon avenir au Cedars-Sinai Medical Center à Los Angeles, où j’ai pu travailler avec deux éminents cardiologues Jeremy Swan et William Ganz (dont vous connaissez le cathéter). Ils m’ont ouvert l’esprit à la recherche et à l’innovation, et m’ont appris à détecter les besoins cliniques, à savoir me considérer, ce qui peut être très présomptueux, comme capable de les résoudre. Quand je suis revenu à Rouen en 1977, j’ai rapidement développé des techniques liées à l’angioplastie, un cathéter de perfusion par exemple, et j’ai initié en France la prise en charge de l’infarctus aigu par thrombolyse intracoronaire. J’ai aussi travaillé sur la thermographie et le preconditioning coronaire.
L’idée d’une dilatation aortique au ballonnet…
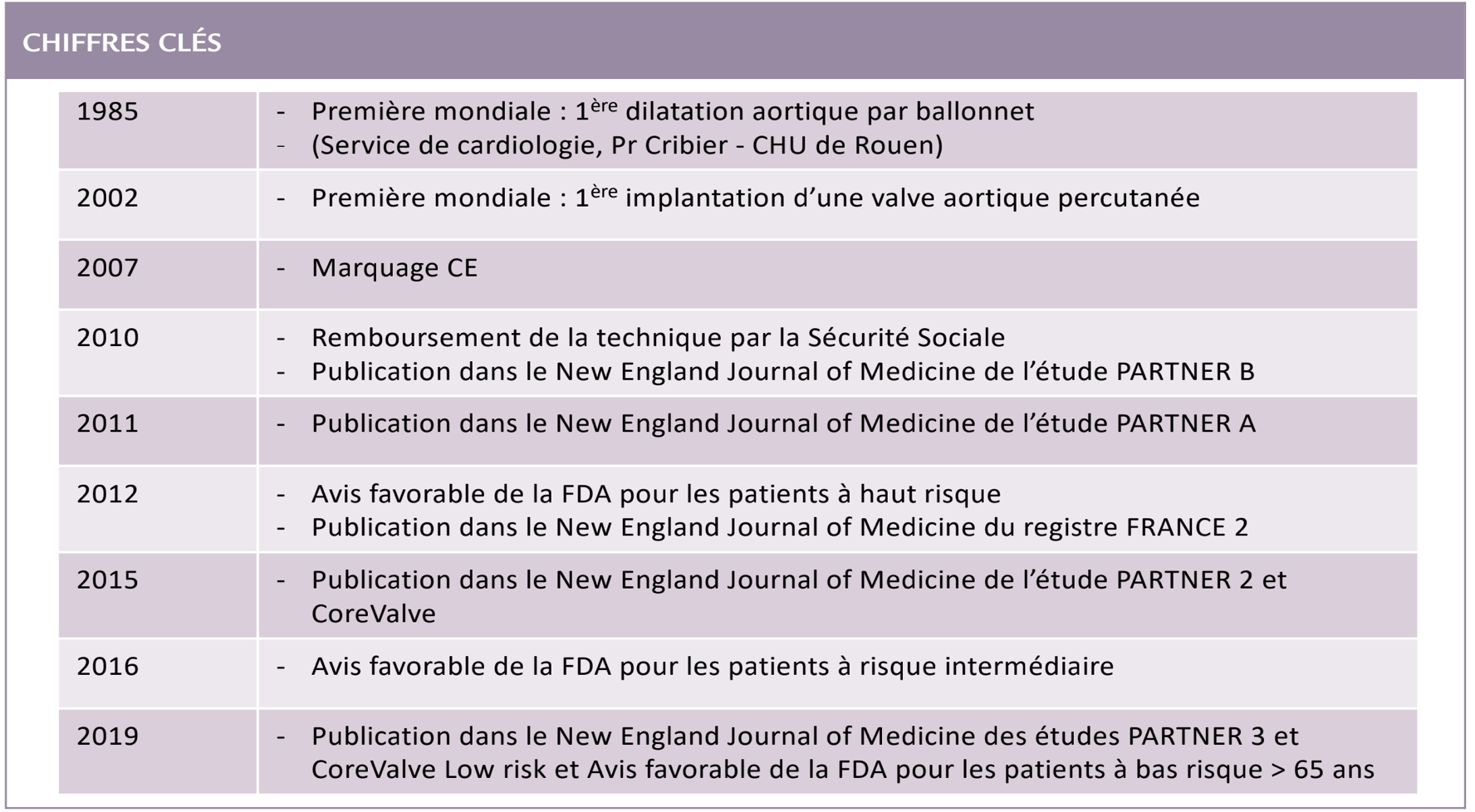
Et puis il y a eu un tournant décisif quand j’ai considéré qu’il y avait un besoin clinique majeur non satisfait pour le traitement du rétrécissement aortique. J’ai été frappé par le grand nombre de patients récusés pour le remplacement aortique chirurgical (RVA) alors qu’ils étaient symptomatiques avec un rétrécissement aortique sévère et dont le pronostic sans opération était catastrophique à court terme. A l’époque, l’âge seul, au-delà de 70 ans faisait partie des contre-indications au RVA. Par exemple, à Rouen, 95% des patients opérés d’un RVA avait moins de 70 ans. Des patients auxquels je m’étais attaché revenaient mourir dans le service après plusieurs épisodes d’insuffisance cardiaque ou des symptômes graves. Cela m’a paru inacceptable. On avait déjà organisé à Rouen le traitement des rétrécissements pulmonaires congénitaux par dilatation au ballonnet : nous disposions donc de ballonnets gonflables. J’ai commencé à me demander si on ne pouvait pas tester ces ballonnets dans les valves aortiques calcifiées. L’idée parait tout à fait banale aujourd’hui, mais à l’époque c’était considéré comme impossible car on craignait de tuer le malade par embolie cérébrale, infarctus, rupture d’anneau, ou fibrillation ventriculaire. J’ai eu la chance, encore une fois, d’avoir un contact attachant avec une patiente de Dieppe âgée de 72 ans qui était hautement symptomatique et très handicapée par la survenue de syncopes au moindre effort. J’ai proposé à Brice Letac de tenter une dilatation de la valve aortique et il m’a répondu que j’étais complètement fou et que ce serait illusoire d’essayer. J’ai tenté de le convaincre à chaque fois que la patiente revenait dans le service. Finalement, j’ai profité de ses vacances pour l’appeler en lui disant « Ecoute, cette patiente vient de revenir ; on devrait essayer, de toute façon elle va mourir dans les semaines qui viennent ! ». La mortalité des patients symptomatiques non opérés était, comme encore aujourd’hui, de l’ordre de 70% dans les 2 ans, c’était terrible. Il m’a dit « Bon, si tu veux essayer, vas-y ». Donc j’ai fait, en tremblant, cette première dilatation aortique au ballonnet en septembre 1985. Cela s’est extrêmement bien passé. J’ai utilisé des ballons de taille croissante jusqu’à 23 mm et j’ai obtenu un résultat intéressant avec une diminution instantanée du gradient. L’amélioration a été immédiate, avec disparition instantanée de tout symptôme pendant deux ans. La patiente a pu retrouver une vie normale et est devenue une vedette dans la région après que son histoire ait été publiée dans la presse. Elle a même commencé à voyager, ce qu’elle n’avait jamais fait auparavant.
Par la suite, j’ai rapidement appelé les patients très symptomatiques récusés par les chirurgiens, auxquels j’ai réalisé une dilation aortique avec le même succès et très peu de complications. La première publication, dans le Lancet, a provoqué un grand émoi dans la communauté médicale. La dilatation aortique (devenue « Balloon Aortic Valvuloplasty » ou BAV) a connu un succès mondial avec des dizaines de milliers de patients traités partout dans le monde. Un grand nombre de français et d’étrangers sont venus à Rouen pour apprendre cette technique. Nous avons organisé à Rouen des séminaires de formation avec cas en direct (ce qui ne se faisait guère dans les années 80) au cours desquels nous avons reçu tous les grands noms de la cardiologie interventionnelle de l’époque. J’ai commencé à parcourir le monde pour former les équipes sur place. Ce fut le début d’une carrière mouvementée qui n’a jamais cessé depuis.
Après 5 ou 6 ans d’engouement pour le BAV et de multiples publications internationales sur le sujet dont de grands registres américains, il est apparu quelque chose que j’avais supputé dès les premières années : les resténoses valvulaires étaient fréquentes. Après une phase d’enthousiasme extrême, il y a eu une phase de découragement conduisant à l’abandon progressif de la technique, en dehors de cas particuliers extrêmes, d’ailleurs validés par la FDA. On considère souvent le BAV comme un échec, mais l’échec reste relatif, quand on voit cette technique toujours utilisée quotidiennement, au cours du TAVI (prédilatation valvulaire ou post dilatation de prothèse). Sans le BAV, nous n’en serions pas là aujourd’hui. En outre, le succès initial du BAV, si ulcérant pour les chirurgiens, les a poussés peu après à démontrer leur capacité à opérer avec succès les sujets âgés, ce qui a sauvé un très grand nombre de patients et je m’en réjouis.
Les valves stentées… sous anesthésie locale
Dès 1988, j’ai annoncé lors de séminaires à Rouen qu’il y aurait une prochaine étape consistant à implanter un dispositif (je ne savais pas encore que ça serait une valve stentée) en utilisant des techniques usuelles de cathétérisme cardiaque sous anesthésie locale, à cœur battant, pour maintenir la valve ouverte après valvuloplastie afin de résoudre le problème de la resténose. Je prévoyais l’anesthésie locale puisque les risques élevés de l’anesthésie générale chez des patients âgés et fragiles était une des grandes causes de rejet du RVA. Il se trouve qu’à cette époque ont été commercialisés des stents Palmaz de Johnson & Johnson de grosse taille pour le traitement des artères périphériques, notamment des iliaques. Nous avons alors réalisés en 1993-14 avec Hélène Eltchaninoff et René Koning, mes collègues de Rouen, une étude autopsique qui devait s’avérer fondamentale pour le TAVI, consistant à implanter des stents Palmaz de 23mm dans des valves aortiques calcifiées. Nous avons démontré que les stents permettaient de maintenir une ouverture circulaire de la valve : avec une pression d’inflation de 4 atmosphères on pouvait repousser en périphérie les calcifications aortiques dans tous les cas. En limitant la hauteur des stents à 17mm, le stents restaient à l’écart des ostia coronaires, de la valve mitrale et de la partie haute du septum interventriculaire, siège du faisceau de His. Ils étaient aussi très solidement ancrés dans les calcifications valvulaires, difficiles à extraire. Tout devenait donc possible ! Les chirurgiens restaient néanmoins très fortement opposés, soulevant l’ensemble des problèmes techniques jugés insurmontables et annonçant un nombre pharamineux de complications mortelles: « tu vas tuer le malade sur table… ». Nos données anatomiques m’ont cependant poussé à avancer malgré tout.
L’objectif était évidemment de mettre en place un stent valvulé pour rétablir la fonction normale de la valve aortique. Il restait donc à insérer une valve à l’intérieur du stent. La démarche a été extrêmement difficile. J’ai cherché des financements, car il faut avoir beaucoup d’argent pour développer de telles techniques. J’ai contacté toutes les compagnies biomédicales qui pouvaient être intéressées, en France, aux Etats Unis, en Europe, … A chaque fois que j’allais quelque part, je rencontrais des industriels pour leur présenter le projet, y compris en Inde, au Brésil, en Russie, au Japon… Ça a duré 5 ans. Et je n’ai reçu que des réponses négatives. Ce n’était guère étonnant car les experts de ces compagnies étaient tous des chirurgiens cardiaques et tous faisaient la liste des invraisemblances de cette technique, qu’ils considéraient comme farfelue : impossibilité de passer la valve aortique avec un ballon sur lequel serait montée une valve stentée, déformation de la valve qui resterait sténosante, risque d’AVC, d’insuffisance mitrale, d’infarctus, etc… En Amérique, un des grands arguments était qu’une telle technique ne serait jamais acceptée par la FDA. C’était vraiment décourageant et à plusieurs reprises on m’a dit que c’était l’idée « la plus stupide jamais présentée pour une innovation technologique ». J’aurais pu abandonner le projet !
Un dilatateur mitral métallique en attendant…
Je n’ai pas perdu mon temps pendant ces 5 ans, et j’ai développé autre chose : un dilatateur métallique percutané original pour le traitement du rétrécissement mitral dans les pays en voie de développement, avec la société française Medicorp (Nancy). Un système très efficace et très intéressant sur le plan économique puisque, contrairement au ballon d’Inoue, il pouvait être stérilisé de très nombreuses fois, comme un instrument chirurgical, jusqu’à 100 fois dans certains centres, ce qui diminuait drastiquement le coût des procédures. C’est d’ailleurs ce qui l’a tué puisque la société Bolton (USA) qui l’avait racheté à Medicorp a décidé après deux ans d’arrêter sa fabrication pour manque de rentabilité. Après une dizaine d’années d’utilisation très large notamment en Asie (particulièrement en Inde) ou en Amérique du Sud, et des milliers de malades traités, la commercialisation de ce dilatateur a donc cessé, au grand dam des utilisateurs. Je n’ai pas pu poursuivre dans ce domaine en raison des évènements suivants.
Une rencontre américaine et une collaboration israélienne…
Beaucoup de chance, en 1997! Lors d’un congrès où je présentais mon projet de valve sans grand espoir, j’ai rencontré un ingénieur américain, Stan Rabinovich, qui s’est montré très enthousiaste, impressionné par les résultats autopsiques que je lui avais présentés. Je n’en revenais pas ! En retournant aux USA, il en a parlé à son collègue Stan Rowe, chez Johnson & Johnson (J&J). Ces deux ingénieurs avaient contribué à la création du stent coronaire Palmaz-Schatz. Ils savaient donc comment faire un stent en ciselant un tube d’acier au laser. Martin Leon, cardiologue renommé, était à l’époque directeur médical de J&J. Il a prêté une oreille attentive à ce projet et a joué le jeu sans trop y croire. En 1999, tous les quatre, nous avons créé une start-up « Percutaneous Valve Technologies » pour développer le projet nous-mêmes avec des moyens financiers très limités. Encore une fois, nous avons eu de la chance. Au cours d’un meeting en Israël, nous avons trouvé une petite compagnie nommée Aran R&D qui venait de décider de développer du matériel médical. Ils venaient de recruter Assaf Bash, un ingénieur qui avait travaillé sur le développement de stents aux USA. Ils ont financé la recherche et le développement, en participant avec leur équipe d’ingénieurs à la fabrication de cette valve aortique. En quelque mois, ils sont arrivés à la constitution d’un prototype qui correspondait à mes désirs et qui suivait de très près les critères utilisés dans mon brevet européen, avec des schémas, des dessins, la façon de mettre la valve en place, etc… Quelques mois plus tard, Assaf Bash est venu à Rouen en apportant un magnifique prototype de valve déployable par ballonnet, d’un calibre serti de 24French (7mm) et de 23mm de diamètre en position ouverte. C’était incroyable !
Ce prototype a été testé de façon complète en laboratoire en Israël, avec toutes les données d’ingénierie sur le stent, la valve, etc… Il contenait une valve tricuspide suturée dans le stent, résistant à la compression/expansion, d’abord en polymère, ensuite en péricarde de cheval puis de bœuf. En laboratoire, elle fonctionnait remarquablement bien avec une durabilité de plus de 5 ans. Dès la fin 1999, nous avons testé cette valve testée in-vivo sur modèle animal, la brebis, avec Hélène Eltchaninoff, Nicolas Borenstein et François Laborde à Paris, dans le centre de recherche de l’Institut Montsouris. Plus d’une centaine d’implantations ont été réalisées au fur et à mesure des affinements technologiques, en passant par le tronc brachio-céphalique (qui a la taille d’une artère fémorale humaine). La première valve a été implantée avec succès en position orthotopique, c’est-à-dire dans la valve aortique native. Le brebis a survécu, et quelques heures après elle était sur ses pattes avec une bioprothèse aortique en place en position intra-valvulaire. C’était fabuleux ! J’ai présenté ce cas quelques jours plus tard au congrès TCT à Washington. La réaction a été assez extraordinaire car à la fin de la présentation une file d’investisseurs privés nous attendait, ce qui nous a permis de continuer la recherche. Mais contre toute attente, nous n’avons plus réussi à implanter de valve en position orthotopique. Obstruction coronaire, insuffisance mitrale… la valve embolisait ou les brebis mourraient. Il a fallu une chance incroyable pour que le premier cas soit réussi !
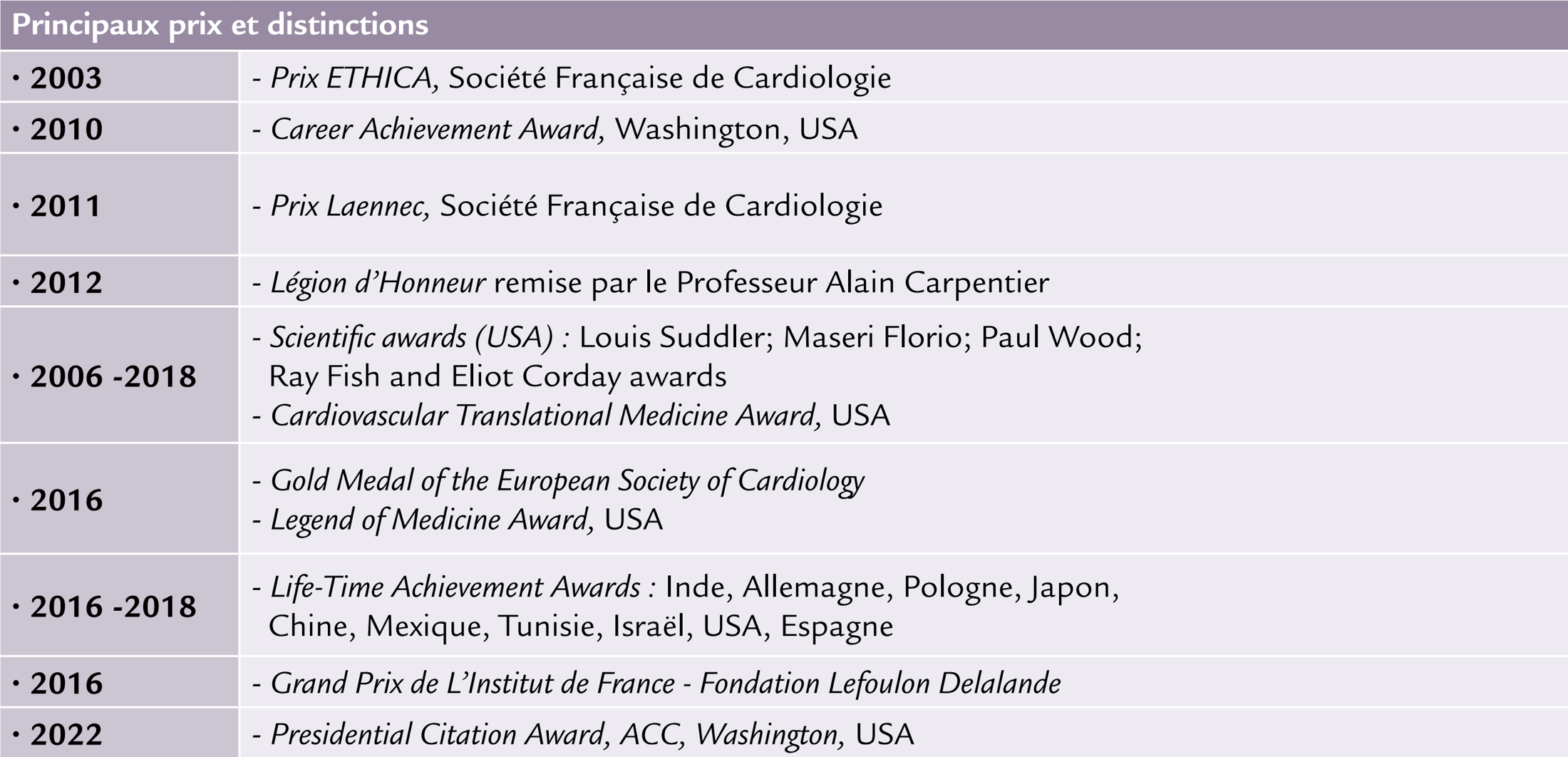
On a essayé d’utiliser d’autres approches avec des implantations faciles dans l’artère pulmonaire, dans l’aorte ascendante (une catastrophe), dans l’aorte descendante (un échec car la valve n’est plus sujette à un gradient de pression suffisant et dysfonctionne en quelques heures) … Pour développer une valve aux USA, il faut pouvoir prouver qu’elle est fonctionnelle au bout de 5 mois dans le système artériel, et il suffit d’une dizaine de cas réussis. Nous avons donc refait une nouvelle série en implantant la valve dans l’aorte descendante mais après création d’une insuffisance aortique contrôlée (une idée originale). Cette fois, grand succès, la valve était toujours parfaitement intacte et fonctionnelle au bout de 5 mois, un argument de poids pour pouvoir passer à l’homme. Ces résultats ont permis plus tard de réaliser les premiers TAVI aux USA avec l’accord de la FDA. En deux ans nous avions en main tous les procédés techniques pour réussir une implantation valvulaire (introducteurs, guides, système de sertissage, mode de délivrance etc…) Mais nous n’avions bien-sûr aucune certitude de reproduire ces résultats chez l’homme. L’idée restait d’utiliser chez l’homme la voie d’abord percutanée fémorale rétrograde. Débuter les cas cliniques est une grande question pour une start- up parce qu’un échec peut avoir un effet négatif retentissant et anéantir la compagnie. Donc j’étais prêt psychologiquement, mais je ne savais pas qui nous implanterions… jusqu’à ce que je reçoive de Lille un patient de 57 ans, inhabituellement jeune, qui avait un rétrécissement aortique sévère (0,70 cm2). Il était mourant, en choc cardiogénique, avec une fraction d’éjection à 12%. Il avait fait plusieurs arrêts cardiaques et avait beaucoup de comorbidités, dont un cancer pulmonaire opéré, une pancréatite chronique, une ischémie de jambe, raisons pour lesquelles, malgré son âge et son état catastrophique, les chirurgiens de Lille refusaient le RVA. Il était venu à Rouen pour qu’on lui fasse une dilatation aortique en urgence par voie trans-septale (les artères fémorales étaient inaccessibles avec deux pontages aorto-iliaques dysfonctionnels). Il a survécu au transport et dès son arrivée à Rouen nous avons tenté cette dilatation. Nous étions rompus à Rouen à la technique trans-septale grâce aux commissurotomies mitrales et nous avions déjà réalisé des dilatations aortiques par cette voie d’abord. La procédure a dû être prématurément interrompue en raison de plusieurs arrêts cardiaques sur table et le lendemain le patient était à nouveau mourant. La seule solution pouvait être d’essayer d’implanter une valve par voie trans-septale malgré les risques immenses. J’ai appelé mes collègues de PVT aux USA pour leur expliquer le contexte et leur proposer cette idée. Ils ont vraiment réfléchi avant de me donner le feu vert parce que les conséquences d’un échec auraient été désastreuses. Finalement ils m’ont donné leur accord pour des raisons éthiques, car c’était le dernier espoir pour sauver ce patient jeune. J’ai téléphoné en Israël pour qu’une valve nous soit amenée à Rouen dans les 24 heures, ce qui a été fait. J’ai passé une nuit blanche à me demander comment j’allais avertir la famille et le patient qu’on avait peut-être une solution ; je ne savais pas comment présenter les choses. Vous allez avoir du mal à me croire mais j’ai à nouveau eu une chance incroyable. J’ai été voir le malade pour lui proposer cette solution, et j’ai commencé à lui parler de nos expérimentations. J’ai alors été interrompu par son gendre qui était présent : « ne vous inquiétez pas, le fait d’être une première mondiale ne nous fait pas peur. Je suis moi-même un malade qui a eu une première mondiale, une angioplastie au laser, pour le traitement de mon insuffisance coronarienne en Allemagne. Faites tout pour le sauver ». On s’est donc lancés dès le lendemain avec Hélène Eltchaninoff et Christophe Tron, un autre collègue du service, dans cette aventure d’implantation d’une valve aortique par voie trans-septale.
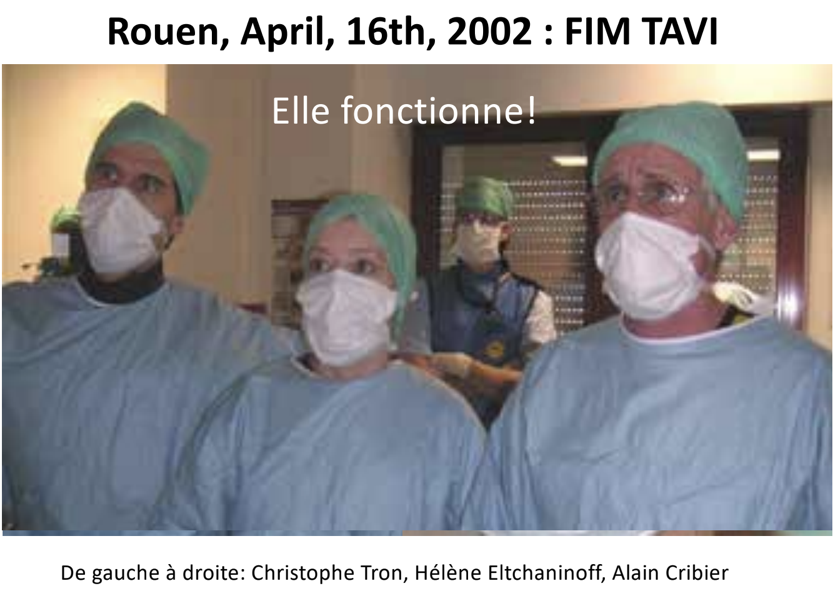
Il faut savoir que le patient avait en outre un thrombus flottant dans le ventricule gauche, et je craignais évidemment beaucoup de déloger ce caillot. Eh bien, il ne s’est rien passé ! L’intervention réalisée sous anesthésie locale, sans ETO, a duré à peu près 1h-1h30. La valve montée par la veine fémorale, sur un guide extrait par l’artère fémorale controlatérale, a franchi le septum inter-auriculaire après dilatation et a pu être délivrée au sein des dépôts calcaires visibles à l’écran. Le moment a été ahurissant pour toute l’équipe présente: il y a eu d’abord l’abolition immédiate du gradient transvalvulaire et une ré-ascension de la pression aortique. Chez ce patient en choc cardiogénique, on a pu arrêter les vasopresseurs sur table avec une tension stable à 100 mm Hg. On a assisté à une véritable résurrection instantanée : recoloration cutanée, retour à une conscience normale avec un patient souriant et remerciant tout le monde. Avec Hélène, on s’était dit que si le patient survivait une demi-heure avec sa valve, ce serait déjà un succès. On regardait l’heure et le patient allait toujours très bien à 30 minutes, 1 heure, 2 heures. Nous n’en croyions pas nos yeux. Beaucoup de gens pleuraient dans la salle, c’était très émouvant. Une heure après son retour en soins intensifs, on sabrait le champagne avec lui, assis, alors qu’il ne pouvait absolument pas s’asseoir auparavant. Le lendemain, il répondait à une foule de journalistes, des radios, télévisions, … et il disait que ça s’était magnifiquement bien passé, qu’il se sentait beaucoup mieux… Inoubliable ! Il n’a malheureusement pas survécu à la nécessité d’une amputation de jambe au 4e mois liée à son ischémie de jambe pré-TAVI ayant continué d’évoluer sans aucune possibilité thérapeutique. Mais son rôle dans la suite des évènements a été considérable et nous ne l’oublierons jamais !

Le TAVI nait…
Nous avons publié ce cas immédiatement dans Circulation et le directeur de la revue m’a dit que c’était la publication la plus demandée, la plus souvent citée dans l’histoire de Circulation; cela montre l’effet que cela a fait sur le public. Il y a eu un revirement complet de la part des cardiologues qui initialement sceptiques, ont commencé à croire au miracle ! Par contre, il y avait toujours une énorme opposition de la part des chirurgiens cardiaques qui considéraient unanimement que j’avais eu beaucoup de chance mais que ça ne marcherait plus ensuite. J’ai commencé à discuter avec l’administration française, l’AFFSAPS, sur la possibilité de faire une série de patients pour implanter cette valve. La discussion a duré près d’un an (experts chirurgiens) pour que, finalement, je sois autorisé à démarrer une première série de patients en compassionnel au sens le plus sévère du terme, à condition qu’ils soient mourants (pronostic vital à 15 jours…) tout en continuant à utiliser uniquement la voie trans-septale, celle utilisée lors du premier patient. Ça n’était pas dans mon cahier des charges personnel mais je n’ai pas eu le choix car j’avais vraiment besoin de continuer. Contre toute attente, nous avons pu réaliser à Rouen une première série de 38 patients en utilisant ces critères d’inclusion terrifiants, avec des résultats très positifs. J’ai obtenu tardivement le droit d’utiliser la voie transfémorale en raison des bons résultats initiaux. Nous n’avons eu aucune mortalité sur table, mais plusieurs patients sont décédés dans les jours, les semaines ou mois suivants du fait des comorbidités, jamais de dysfonction valvulaire. Il y a eu eu beaucoup de fuites paravalvulaires (probablement en cause dans certains décès) avec cette valve d’une taille unique de 23 mm. On sait maintenant que cette taille est insuffisante pour une majorité de patients. Mais l’amélioration fonctionnelle était toujours spectaculaire. Ces résultats publiés dans le Journal of the American College of Cardiology ne sont pas passé inaperçus !
Deux exemples cliniques ont été déterminants pour convaincre la communauté médicale et chirurgicale de la validité de la technique : une de nos premières patientes, âgée de 83 ans, habitait Paris et venait de retourner chez elle pour y mourir après 2 mois d’hospitalisation, car elle était jugée inopérable en raisons de ses comorbidités et de son état hémodynamique. Elle a vu un reportage télévisé sur notre premier patient et demandé à sa fille de l’emmener à Rouen. Lorsque j’ai reçu l’appel, je n’étais pas très chaud pour la prendre car elle était dans un état catastrophique, et je ne pensais pas qu’elle arriverait vivante à Rouen. Une fois arrivée, nous avons réussi à lui implanter la valve par voie trans-septale non sans difficultés (massage pendant 3⁄4 d’heure). Elle s’est rétablie très rapidement et de façon spectaculaire. Un an plus tard elle était capable de répondre à l’invitation de Martin Leon de venir présenter son expérience du TAVI à Washington, au congrès TCT. Elle y a été reçue comme un reine et a conquis l’assistance en parlant devant 2000 personnes. Cette patiente a joué un rôle considérable dans l’acceptation future de la technique.
Elle a vécu près de 7 ans, menant une vie normale, asymptomatique, sans la moindre dysfonction valvulaire, avant de mourir d’un cancer du sein à 90 ans. Le 2ème exemple concerne une patiente de 85 ans, sur laquelle nous avons réalisé la première implantation par voie transfémorale rétrograde programmée car elle avait un rétrécissement mitral associé. Malgré l’absence de système de délivrance dédié, la procédure a été très simple et rapide avec un résultat parfait, laissant bien augurer de ce que serait l’avenir du TAVI. Elle s’est rétablie complètement, a repris ses voyages. Elle était d’origine marocaine et a invité tout le service au Maroc pour une bar-mitsvah. Elle a survécu 5 ans pour finalement mourir d’un infarctus avec une valve intacte.
Ces deux exemples ont considérablement aidé à convaincre les cardiologues de l’extraordinaire intérêt du TAVI. Les implantations trans-septales ont débuté en Europe et aux USA dès 2004. Les implantations s’avéraient compliquées pour les équipes n’ayant que peu ou pas d’expérience de la voie trans-septale, mais des améliorations cliniques spectaculaires ont été aussi rapportées.
Notre start-up, largement financée par des fonds privés, a été rachetée en 2004 par Edwards LifeSciences aux USA, compagnie connue pour la fabrication de bioprothèses chirurgicales, notamment la valve Carpentier-Edwards, majoritairement implantée par les chirurgiens. Il y a eu une réelle bagarre entre les compagnies Boston Scientific, J&J, Edwards LifeSciences et Medtronic pour acquérir notre start-up, pour une somme record à l’époque.
L’évolution de la valve chez Edward Life Sciences…
La valve qui s’appelait initialement Cribier-Edwards a été améliorée pour devenir la valve Edwards Sapien. En dehors de modifications structurelles mineures, son avantage était d’être produite en deux tailles (23 et 26 mm) ce qui était un progrès considérable. Elle était conçue pour implantation rétrograde fémorale à l’aide d’un cathéter de délivrance remarquable et je voyais enfin mes souhaits se réaliser. Compte tenu des restrictions de la régulation française, c’est John Webb à Vancouver qui a réalisé les premiers cas avec cette voie d’abord. Nous n’avons pu suivre qu’au bout d’un an. A partir de 2005, la technique s’est répandue dans plusieurs pays, en Europe et aux USA. J’ai assisté à la plupart des premières dans les différents centres pour conseiller les équipes.
Comme seuls 50% des patients pouvaient être implantés par voie fémorale pour des raisons de taille d’introducteur (24 French) une technique d’implantation par voie transapicale a été développée, avec une approche mini-invasive chirurgicale. Les chirurgiens ont été conquis par cette technique et ont commencé à croire au TAVI. J’étais avec Frédéric Mohr et Mickael Mack à Leipzig, pour la première implantation transapicale. Ils me montrent souvent comme le diable entrant dans le bloc opératoire : c’était une provocation de faire du TAVI en chirurgie.
La technique s’est propagée dans plusieurs services en France et a été commercialisée à partir de 2007. Les résultats étaient formidables sur l’amélioration fonctionnelle et la survie des patients, tous très âgés et à très haut risque, même si cela a été aussi le début de l’expérience des complications et la recherche de moyens pour les éviter. C’est à cette époque que sont apparues les « Hearts Teams », faite d’équipes multidisciplinaires soudées autour du TAVI, une avancée majeure pour ne pas dire une révolution en médecine pour la sélection et le suivi des patients. La visualisation des voies d’abord, de la valve, de l’aorte et la détermination de la meilleure taille de valve par CT Scan a aussi marqué un progrès notable pour la sécurité des procédures. Il faut dire que l’industrie a constamment travaillé en partenariat avec les cardiologues pour améliorer la réalisation et les résultats du TAVI.
Dès 2004, une valve concurrente est arrivée sur le marché, la CoreValve qui a été développée par un chirurgien français Jacques Seguin, une valve auto-expansive. Dès le départ, j’avais discuté avec les ingénieurs d’Aran qui considéraient qu’une valve auto-expansive n’aurait pas une force suffisante pour maintenir la valve aortique ouverte ; ils n’ont pas poursuivi le développement. CoreValve a pourtant réussi à en faire une qui tenait la route, avec certes des soucis et des complications au début. La compagnie Medtronic qui a acquis ultérieurement la CoreValve était très impliquée en cardiologie interventionnelle générale, contrairement à Edwards, et avait un pouvoir de marketing beaucoup plus important. Le calibre plus petit de l’introducteur fémoral (21 French) a aussi conquis beaucoup de cardiologues. Ensuite, il y a eu une réelle compétition entre les deux dispositifs : la valve d’Edwards et la CoreValve. Cette compétition a été très stimulante et un joué un grand rôle dans la diffusion mondiale de la technique.
En 2012, Edwards a amélioré la valve Sapien, un tournant évolutif pour le développement de notre technologie : la valve Sapien XT était meilleure que la précédente sur le plan hémodynamique tout en permettant de diminuer significativement le calibre des introducteurs puisqu’on est passé de 24 French à 16 et 18 French avec 3 tailles de valve (23, 26 et 29 mm). Ces améliorations ont permis le recours à la voie transfémorale dans 90% des cas, un progrès considérable pour les patients. Avec ce dispositif plus fin, notre centre a surenchéri en développant la voie transfémorale « minimaliste », permettant de réaliser la procédure en percutané strict, sous simple anesthésie locale, sans surveillance par ETO pendant la procédure, ce qui correspondait à mes espoirs initiaux. D’ailleurs, en cohérence avec cette idée de base, aucun malade de Rouen depuis le premier cas n’a été implanté sous anesthésie générale. On pouvait utiliser très facilement des systèmes de fermeture percutanée fémorale et laisser sortir les patients au bout de 2 ou 3 jours. C’était une révolution. Cela a été mal reçu dans les pays anglo-saxons et notamment aux USA et en Grande-Bretagne où l’on considérait comme insensé, voire non-éthique de vouloir implanter une valve sans anesthésie générale ni ETO. Même Martin Leon, mon partenaire de PVT a annoncé en congrès qu’il ne fallait pas le faire ! Nous sommes restés longtemps les seuls à Rouen à utiliser cette stratégie d’implantation, publiée par notre équipe pour la première fois dans le JACC Cardiovascular Intervention en 2012. Mais la technique s’est rapidement répandue dans le monde et est à l’heure actuelle utilisée presque partout, même aux USA (90% des cas).
En parallèle avec les progrès techniques de la valve Edwards, la CoreValve s’est aussi beaucoup améliorée en ce qui concerne sa structure, sa forme, ses diamètres et le calibre d’insertion pour arriver arriver aujourd’hui à la valve Evolut.
De nombreux registres ont été constitués, nationaux et internationaux, dont l’important registre européen SOURCE, incluant des milliers de patients. En France, les registres prospectifs ont été particulièrement bien menés, registre France, puis France 2 (publié dans le New England Journal of Medicine), poursuivis plus récemment par France TAVI et Fast TAVI incluant tous les patients français. Hélène Eltchaninoff et Martine Gilard de Brest ont été la clef de voute de ces registres français. Le traitement par TAVI des bioprothèses chirurgicales dégénérées a également débuté et a démontré tout son intérêt par rapport à la reprise chirurgicale. L’ensemble des données publiées ont joué et continuent de jouer un rôle très important pour la compréhension et l’expansion du TAVI. Mais comme toujours, la preuve scientifique de la valeur du TAVI ne pouvait être apportée que par des études randomisées (evidence-based).
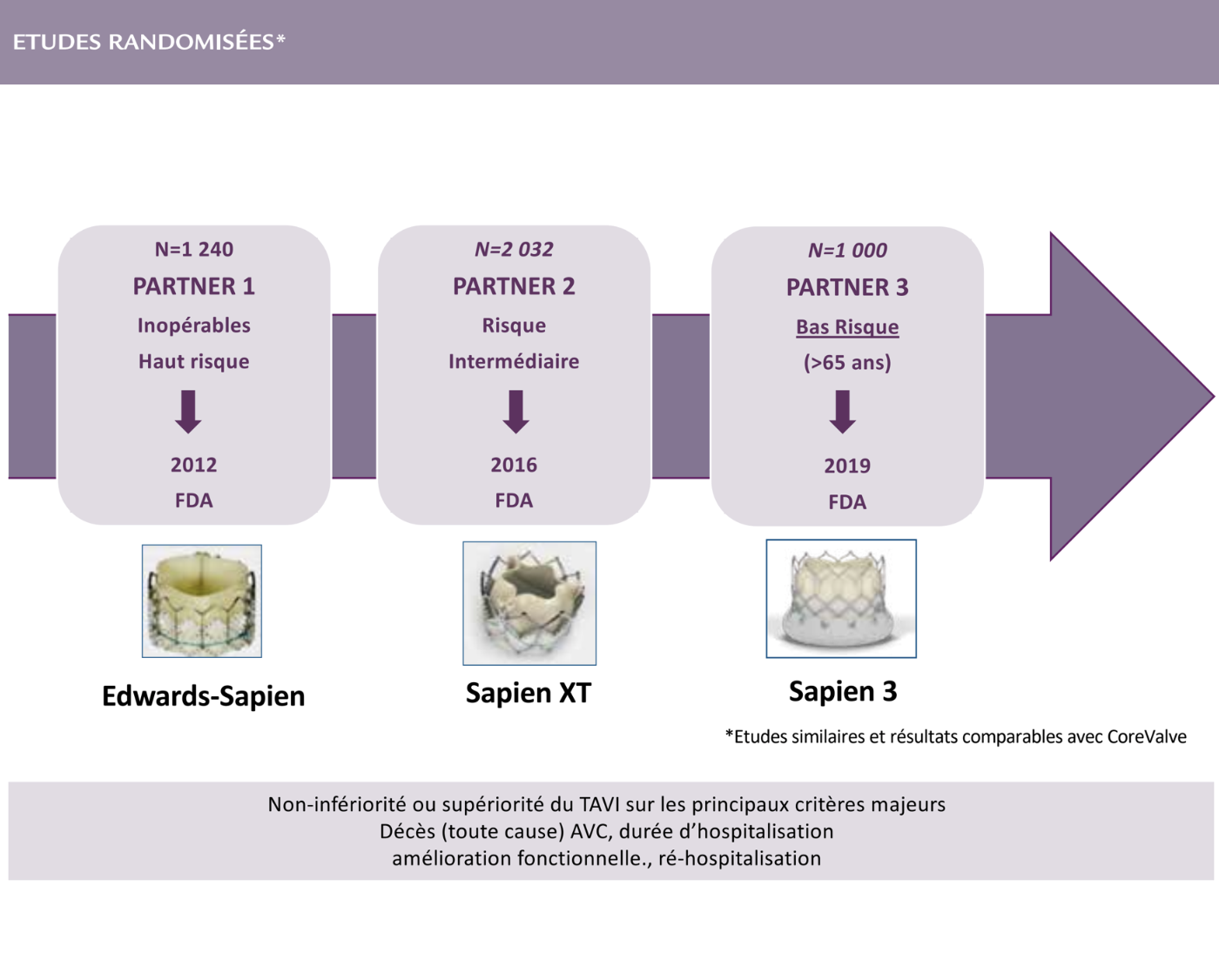
La première étude en 2010 a été l’étude PARTNER 1 aux USA rassemblant des centaines de patients octogénaires strictement inopérables (PARTNER 1B) ou à très haut risque chirurgical (PARTNER 1A) où le TAVI a été comparé dans le premier cas au traitement médical seul et dans le second au RVA. De façon remarquable, les cardiologues sélectionnés n’avaient qu’une expérience très débutante du TAVI alors que les chirurgiens cardiaque étaient les plus reconnus. Chez les patients inopérables le TAVI a diminué de 60% la mortalité à 1 an par rapport au traitement médical. PARTNER 1A a montré que les principaux critères d’évaluation (dont la mortalité à 1 an) étaient comparables à la chirurgie aboutissant à la validation du TAVI dans cette catégorie de patients. Les résultats étaient maintenus à 5 ans. Une étude comparable a été réalisée avec La CoreValve sur les sujets à haut risque avec des résultats équivalents et même une amélioration de la mortalité à un an avec le TAVI. Ces résultats publiés dans le New England Journal of Médicine ont conduit rapidement à l’approbation du TAVI par la FDA pour ces catégories de patients, un premier succès mémorable !
Puisque les résultats étaient très bons chez les patients à haut risque, tester la valve sur des patients à risque moindre (risque intermédiaire) devenait réaliste. En 2016, ont été publiés les résultats d’une seconde étude randomisée (PARTNER 2) menée aux USA avec la Sapien XT chez les patients à risque intermédiaire. J’étais inquiet, car l’incidence des résultats sur l’expansion future du TAVI était majeure. Contre toute attente, les résultats du TAVI ont été comparables à ceux de la chirurgie cardiaque à deux ans sur les principaux critères d’évaluation. Après la publication de ces résultats dans le New England Journal of Medicine, la FDA a validé le TAVI pour les patients à risque intermédiaire. Quelle immense satisfaction pour nous !… Un peu plus tard les mêmes résultats ont été publiés avec la CoreValve, également validée par la FDA. La population « cible » a dès lors considérablement augmenté dans le monde. Alors, pourquoi pas le TAVI chez les patients plus jeunes à bas risque ?
Ce fut réalisé deux ans plus tard avec les études PARTNER 3 et Evolut Low Risk trial chez des patients de plus de 65 ans, dix ans plus jeunes en moyenne qu’auparavant. PARTNER 3, réalisée avec la dernière génération de valve Edwards (comprenant une jupe externe particulièrement efficace contre les fuites paravalvulaires) publiée en 2019 avec plus de 1 000 patients à bas risque, a montré que les résultats étaient identiques à la chirurgie et même meilleurs en ce qui concerne des critères incluant la mortalité, les réhospitalisations et les AVC. Des résultats extrêmement favorables également obtenus avec la Medtronic CoreValve Evolut.
 La Victoire… du TAVI
La Victoire… du TAVI
2019, a été le tournant décisif. Peu après la publication des résultats, encore une fois dans le New England Journal, la FDA a donné son accord pour utiliser le TAVI chez tous les malades atteints de rétrécissement aortique symptomatique quel que soit leur risque chirurgical au-delà de 65 ans, un véritable bouleversement des indications. Les Recommandations Européennes ont suivi avec retard, mettant la barre des âges à 70 ans. Mais quel progrès pour les patients ! Les convaincre actuellement, quel que soit leur âge, de se faire opérer est devenu un combat. Avec 2 millions de malades traités dans le monde dans plus de 80 pays on aboutit à un changement de paradigme : le TAVI a été conçu pour les patients inopérables ou à haut risques et aujourd’hui le RVA est réservé aux patients n’ayant pas une indication optimale pour le TAVI !…
Il y a très peu (ou pas) de techniques médicales qui ont été évaluées scientifiquement avec autant de précautions, en partant des patient les plus graves pour arriver aux patients tout-venant ! Lorsqu’une technique médicale est développée (par exemple l’angioplastie) il est d’usage de commencer par des cas simples pour s’étendre ensuite aux cas plus complexes ou plus graves. Les résultats s scientifiques de toutes les investigations sur le TAVI n’en ont que plus de valeur !
En termes de chiffres, il y a environ 2 millions de TAVI implantés. Le nombre d’implantations annuelles dans le monde s’élève à combien ?
En France, on implante annuellement 15 000 valves. A Rouen, on en fait 5 à 6 par semaine. Dans les pays occidentaux, le TAVI apparait sur le planning au même titre que les angioplasties et stents coronaires. Il suffit d’ une demi-heure pour mettre une valve en place. Les patients sortent au bout de 2 jours dans 50% des cas. Dans certains centres d’Amérique du Nord, certains patients sont traités en hospitalisation de jour : on met une valve le matin, ils sortent le soir. Il n’y a aucun besoin de rééducation fonctionnelle ; 70 000 valves sont implantées chaque année aux USA, 20 à 25 000 en Allemagne. Je crois qu’il y a eu 180 000 TAVI dans le monde en 2021.
Pour avoir une idée de la bascule, si on prend les chiffres français, est ce que vous connaissez le nombre d’interventions chirurgicales pour RAC en 2000 vs 2022 ?
J’ai du mal à répondre car je n’ai pas les chiffres exacts concernant le RVA. Il y en avait 150 000 par an avant le TAVI. Ce qui est sûr c’est qu’à partir de 2019, les courbes TAVI/RVA se sont croisées aux USA comme dans plusieurs pays européens avec davantage de TAVI que de RVA.
Quelle sera l’étape suivante ?
Dans l’avenir, on peut s’attendre à une croissance continuelle du TAVI dans le monde, en raison du vieillissement de la population, de l’augmentation du nombre des opérateurs (incluant certains chirurgiens cardiaques…), de la validation probable par les autorités de santé de certains centres expérimentés ne disposant pas de chirurgie cardiaque sur place, et des progrès sur la détection du rétrécissement aortique. A cet égard, les médecins généralistes doivent apprendre à mieux prendre en compte la symptomatologie des patients très âgés, savoir les ausculter et les envoyer sans hésiter au cardiologue pour confirmer le diagnostic par échographie. Il est temps pour eux de ne plus considérer le TAVI comme une technique expérimentale… A Rouen, Hélène Eltchaninoff (qui m’a succédé à la tête du service de Cardiologie) organise une journée annuelle d’information pour le grand public et les médecins généralistes, place de la cathédrale, une manifestation très utile, très suivie et appréciée.
Parallèlement, les avancées technologiques se poursuivent, tant pour la valve Edwards que pour la Medtronic CoreValve, pour en améliorer la durabilité et minimiser le risque de complications. De nouvelles valves d’autres compagnies, Boston Scientific, Abbott, Meril, sont commercialisées et compétitives même si leur supériorité par rapport aux valves « historiques » n’est pas démontrée. Certaines peuvent avoir un rapport coût-efficacité intéressant dans les pays émergents qui deviennent aussi très demandeurs. On a la chance en France que le TAVI soit remboursé. Ce n’est pas le cas partout ; ainsi par exemple au Maroc, la valve coûte 25 000 euros sans compter les frais d’hospitalisation. Le but est de voir le TAVI apparaitre dans ces pays non occidentaux, notamment en Afrique ou dans certains pays asiatiques, pour éviter d’envoyer les patients se faire traiter ailleurs. Cela prendra du temps. L’aspect économique de cette technologie est un énorme frein à son expansion. Le coût devrait diminuer, c’est une tendance générale pour les dispositifs médicaux qui ont du succès.
Il y a aussi en cours quatre études randomisées qui cherchent à démontrer le bénéfice du TAVI sur les patients asymptomatiques ou avec un RA modéré. On se dirige vers la démonstration, j’espère, que le TAVI peut être indiqué avant même l’apparition des symptômes avant que les patients ne soient menacés dans leur vie, ce qui « boosterait » encore plus les indications. Réponse dans les toutes prochaines années.
Il reste des questions sur la durabilité des valves TAVI : est-elle comparable à celle des bioprothèses chirurgicales ? C’est un gros point, alors que l’on s’adresse à une population de plus en plus jeune. On dispose de nouvelles valves tous les 2 ans et on ne sait pas si les valves de dernière génération seront aussi durables que les précédentes. Actuellement, les études ont montré qu’il y a très peu de dysfonctionnements, de l’ordre de 1% jusqu’à 5 ans, en tous cas aucune alerte par rapport aux valves chirurgicales. Nous avons à Rouen plusieurs patients ayant franchi la barre des 10 ans (jusqu’à 14 ans) sans dysfonctionnement structurel. Quand la valve dysfonctionne, on a la possibilité de faire un TAVI dans TAVI (valve in valve) mais on le fait surtout couramment et de plus en plus pour les dysfonctionnements de bioprothèses chirurgicales. Il faut en tout cas discuter de cette éventualité avec les patients les plus jeunes, avant d’obtenir leur consentement. C’est un grand sujet d’actualité : quelle décision prendre à 65 ou 70 ans, chirurgie ou TAVI ? Quelle première valve implanter, comment s’assurer d’un accès ultérieur aux coronaires etc… Enfin, de nombreuses recherches sont menées pour améliorer la durabilité des valves, passant par exemple par le développement de valves TAVI non biologiques. L’avenir est prometteur !
Pour finir, on ignore presque tout du rétrécissement aortique, sa genèse, ses causes, son évolution. Comprendre ces aspects pourrait aboutir à une prévention de la maladie. Malgré des facteurs de risque comparables à ceux de l’athérosclérose artérielle, malgré la coexistence fréquente de lésions coronaires associées, les méthodes préventives de l’athérosclérose demeurent inefficaces pour ralentir sa progression. C’est tout l’intérêt de grands programmes de recherche en cours, comme le remarquable programme de Recherche Hospitalo-Universitaire (RHU) : Stop-AS, obtenu à Rouen par Hélène Eltchaninoff programme multidisciplinaire ayant pour buts d’améliorer les connaissances sur la maladie (de la cellule au traitement) en associant de nombreuses équipes académiques, cliniques et de recherche, et des industriels. D’importants moyens sont mis en œuvre pour la réalisation d’études précliniques, d’essais multicentriques et de registres, évaluant aussi bien des biomarqueurs que des approches thérapeutiques innovantes. Il viendra un jour peut-être où ces connaissances accumulées permettront de ralentir ou de prévenir la maladie ?
Pour conclure, 20 ans après la première implantation, je ne peux qu’exprimer mon étonnement et ma satisfaction devant l’extraordinaire expansion d’une technique dont le concept était initialement si critiqué. J’observe aussi l’impact « culturel » du TAVI en médecine, avec le développement d’un travail très nouveau en équipe multidisciplinaire au sein de chaque institution. Enfin, il est clair que le TAVI a joué un rôle exemplaire pour le développement de multiples autres procédures interventionnelles valvulaires (le traitement de l’insuffisance mitrale ou l’insuffisance tricuspide par exemple) et pour le traitement non chirurgical de nombreuses maladies cardiaques structurelles non valvulaires. Il y a de quoi se réjouir de tout cela !
Propos recueillis par Angélique Bironneau
