
A-t-on encore besoin des antiarythmiques en 2023 ?
Il y a plus de 40 ans, Vaughan Williams proposait une classification des médicaments antiarythmiques en 4 classes basées sur leurs propriétés électrophysiologiques¹‚². Cette vision scientifique laissait présager le succès des approches rationnelles de prise en charge Ides arythmies.
Cependant, les connaissances accumulées sur la balance bénéfices/risques des antiarythmiques d’une part et le développement spectaculaire des thérapeutiques non médicamenteuses en rythmologie d’autre part, ont diminué progressivement la part des médicaments antiarythmiques dans notre arsenal thérapeutique. Certains auteurs discutent la proposition provocatrice de mettre les antiarythmiques « à la poubelle » (« Pill in the bin »)³.
Pour tenter de répondre à la question titre de cet article, nous discuterons dans un 1er temps des balances bénéfices/risques des antiarythmiques, puis nous décrirons les comparaisons des approches pharmacologiques et non pharmacologiques dans la prise en charge de différents troubles du rythme. Nous soulignerons ce qui nous semble « rester » des ,bonnes indications du traitement antiarythmique en 2023.
Risques et bénéfices des antiarythmiques
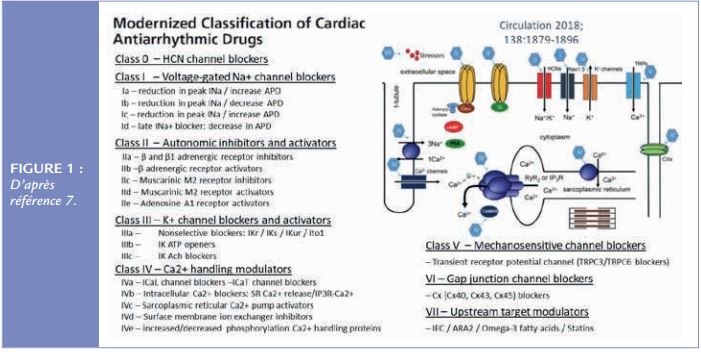
La grande période des antiarythmiques s’est arrêtée brutalement avec la présentation des résultats de l’étude CAST à la fi n des années 1980. Cette étude paraissait cependant devoir être positi ve : les patients post-infarctus avec des ESV avaient un pronostic défavorable ; les antiarythmiques de classe I diminuaient la fréquence des ESV ; on att endait donc une diminuti on de la mortalité avec les antiarythmiques de classe I en post-infarctus. Le résultat obtenu était inverse avec une surmortalité dans le groupe antiarythmique(4). Le d-sotalol (classe III) n’a pas fait mieux (augmentation de mortalité versus placebo)(5). Cette « douche froide » a entrainé une évolution des classifications (la dernière comporte 8 classes et plus de 20 sous-classes – cf. Figure 1) et des indications (6, 7, 8).
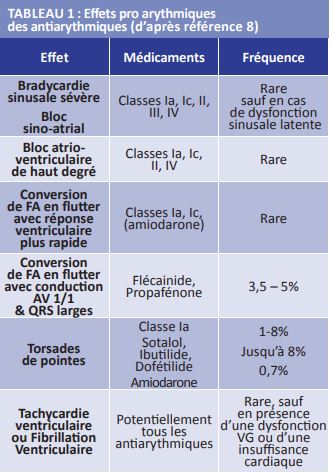
Tous les antiarythmiques peuvent avoir des effets pro-arythmiques (Tableau 1)(8).
Les antiarythmiques de classe I ou autres médicaments bloquant le courant sodique (induisant une diminution de la vitesse de propagation de la dépolarisation) peuvent entrainer un ralentissement de la fréquence atriale en flutter ou TA et une réponse ventriculaire en 1/1 très rapide (Figure 2A), un élargissement des QRS (avec un effet fréquence dépendant, c’est-à-dire avec un effet plus marqué ,aux fréquences rapides) ou encore le démarrage d’une tachycardie ventriculaire polymorphe pouvant dégénérer en FV (Figure 2B).
Enfin, les antiarythmiques de classe I élèvent le seuil de défibrillation.
L’allongement de la durée de la repolarisation ventriculaire (et donc des périodes réfractaires) constitue l’autre grand mécanisme de l’effet antiarythmique.
Cependant, l’allongement de la durée de l’intervalle QT peut être associé à la survenue de Torsades de Pointes pouvant dégénérer en fibrillation ventriculaire (Figure 2C)(9).
Cet allongement de l’intervalle QT est le mécanisme d’action principal des antiarythmiques de classe III, mais est aussi observé avec les classes Ia et Ic, certains classes IV ainsi que de très nombreux médicaments non antiarythmiques (cf. https://www.crediblemeds.org pour une liste exhaustive mise à jour régulièrement et classée en fonction du risque d’allongement de l’intervalle QT et de torsades de pointes). L’utilisation des médicaments allongeant l’intervalle QT/QTc est associée à un sur-risque de mortalité subite(9) et cela justifie la surveillance ECG de l’intervalle QT/QTc lors de leur prescription.
Le risque pro arythmique des antiarythmiques n’est pas seulement théorique. Dans une méta-analyse récente, la survenue d’arythmies induites est environ 2 fois plus fréquente avec les antiarythmiques qu’avec le placebo(10). Plus grave encore, dans cette même méta-analyse, la mortalité est 2 fois plus importante sous antiarythmique que sous placebo(10). Cette surmortalité peut être la conséquence d’effets pro arythmiques mais aussi d’effets secondaires extracardiaques (cf. par exemple les complications thyroïdiennes ou pulmonaires de l’amiodarone). Ces données ont incité la commission de transparence de la Haute Autorité de Santé à statuer que plusieurs antiarythmiques (sotalol, cibenzoline, hydroquinidine, et disopyramide) n’ont plus de place dans la stratégie de prévention des récidives de FA. Parallèlement, les recommandations ESC 2020 sur la prise en charge de la FA ont rétrogradé le Sotalol d’une classe IIa à une classe IIb pour la prévention de la récidive de FA.
A côté des risques associés à la prescription des antiarythmiques, leur efficacité est moins bonne qu’on pourrait le souhaiter. On peut retenir globalement que si les antiarythmiques sont plus efficaces que le placebo pour prévenir la récidive de fibrillation atriale, l’efficacité (taux de récidive) à 1 an est autour de 50%10. L’amiodarone est le plus efficace (70% de maintien en rythme sinusal dans l’étude CTAF), mais ses effets secondaires limitent sa prescription notamment chez les sujets peu âgés.
En présence d’une altération de la FEVG, seuls les bêtabloquants et l’amiodarone peuvent être utilisés.
A l’étage ventriculaire, l’amiodarone associée aux bêtabloquants diminue le risque de récidive de tachycardie ventriculaire mais pas le risque de mort subite (12, 13, 14).
Les bêtabloquants (classe II de la classification des antiarythmiques) sont l’exception qui confirme la règle. Ils sont en effet très efficaces en prévention des arythmies, de la mort subite et de la mortalité globale dans le post-infarctus, l’insuffisance cardiaque, le syndrome du QT long congénital ou encore dans les tachycardies ventriculaires catécholergiques (15, 16, 17, 18).
L’efficacité souvent décevante des antiarythmiques associée à un risque pro arythmique potentiellement létal a constitué un moteur puissant pour le développement des approches non pharmacologiques.
Place des traitements médicamenteux et non médicamenteux des arythmies
Les balances bénéfices/risques des antiarythmiques et des traitements non pharmacologiques et les études comparatives permettent de définir les indications respectives des différentes approches thérapeutiques pour chaque type de trouble du rythme. Les indications actuelles des antiarythmiques sont listées dans les Tableaux 2 à 5.
Rythmes réciproques et voies accessoires
Les rythmes réciproques (RR souvent improprement dénommé « tachycardie jonctionnelle ») par réentrée atrio-nodo-ventriculaire ou empruntant une voie accessoire peuvent être arrêtés par les manœuvres vagales, l’adénosine, les inhibiteurs calciques bradycardisants ou les bêtabloquants. Ce n’est que lorsque la tolérance hémodynamique est compromise ou en cas d’échec des médicaments précédemment cités que l’on propose une cardioversion électrique (19).
Pour la prévention des récidives de rythme réciproque, les dernières recommandations européennes indiquent le recours à l’ablation en 1ère intention (classe I B), les antiarythmiques de classe II ou IV en 2ème intention (classe IIa B). Les classes I et III ne sont pas citées dans cette indication (19). Cependant, compte tenu du caractère bénin des RR, les recommandations permettent d’envisager l’abstention thérapeutique (classe IIa C) (19).
L’ablation doit être expliquée au patient, en précisant bien que la radiofréquence est la technique de référence mais est associée à un risque de BAV nécessitant l’implantation d’un pacemaker chez environ 1% des patients. La cryothérapie permet de diminuer ce risque mais elle est moins efficace et associée à des échecs per procédure et à un risque de récidive significatif (≥ 20%).
Il n’est pas rare que pendant la procédure, l’opérateur constate que le risque de BAV est important (marge anatomique faible, instabilité du cathéter, absence de disparition de la voie lente en position basse et rythme jonctionnel rapide pendant les tirs en position plus haute). Il est, dans ces situations, préférable d’accepter un échec de procédure.
Lorsque l’ablation n’est pas souhaitée ou n’est pas couronnée de succès, et que les récidives sont fréquentes et/ou mal tolérées, on peut alors prescrire un antiarythmique de classe II, IV (en 1ère intention), en cas d’échec de classe Ic et très exceptionnellement l’amiodarone (Tableau 2).
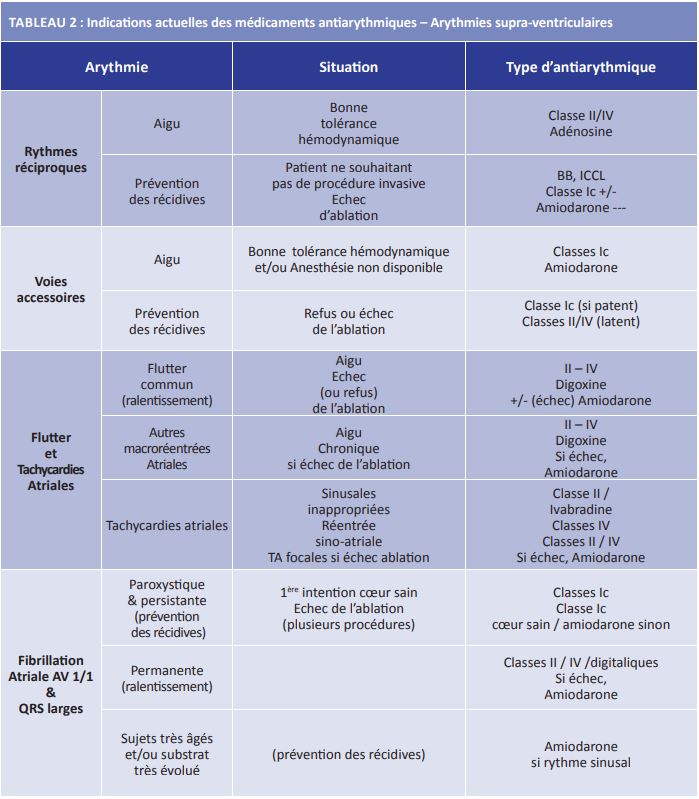
En cas de tachycardie atriale, flutter ou FA avec réponse ventriculaire rapide par une voie accessoire perméable, la tolérance hémodynamique est souvent compromise et la cardioversion électrique reste la meilleure solution (19)). Lorsque la réalisation de l’anesthésie générale pour la cardioversion ne peut pas être réalisée rapidement ou lorsque la tolérance hémodynamique est bonne, on peut envisager d’essayer de ralentir la conduction antérograde par la voie accessoire en utilisant un antiarythmique de classe Ic (classe IIa) ou l’amiodarone (classe IIb) (19). Classes II et IV « favorisent » la conduction antérograde par la voie accessoire en ralentissant celle dans le nœud atrioventriculaire. Ils sont classiquement contre-indiqués dans cette indication.
L’ablation des voies accessoires a été une des plus belles démonstrations de l’efficacité de cette technique et a permis de faire quasiment disparaître le recours à la chirurgie des voies accessoires.
La prévention des récidives de RR ou d’épisodes de conduction antérograde rapide aux ventricules passe donc en 1ère intention par l’ablation (I B) (19).
Cependant, la balance bénéfice/risque de l’ablation peut devenir défavorable lorsque la voie accessoire est proche des voies de conduction nodo-ventriculaires, difficile d’accès (réseau veineux coronaire, position inféro-para-septale…) ou lorsque l’ablation est infructueuse (voie accessoire « protégée », associée à une cardiopathie congénitale telle anomalie d’Ebstein ou autre). Les échecs peuvent exceptionnellement justifier le recours à la chirurgie (mort subite sur voie accessoire très perméable), mais le plus souvent, dans ces situations d’échec de l’ablation (ou de refus de l’intervention par le patient) le traitement antiarythmique pourra être utile (AA classe Ic (classe IIb B) ou en cas de voie accessoire latente AA de classe II ou IV (classe IIa B) (19).
Flutters & Tachycardies Atriales
En aigu, la cardioversion électrique reste la meilleure solution si la tolérance hémodynamique est compromise (19). Lorsque la réalisation de l’anesthésie générale pour la cardioversion ne peut pas être réalisée rapidement ou lorsque la tolérance hémodynamique est bonne, on peut envisager d’essayer de ralentir la conduction antérograde par la voie accessoire en utilisant un antiarythmique de classe II, IV (classe IIa), avec la Digoxine ou en cas d’échec avec l’amiodarone (classe IIb) (19). L’Ibutilide et le Dofétilide peuvent être utilisés pour régularisation mais ne sont pas disponibles en France. En revanche, les AA de classe Ic ne doivent pas être utilisés dans ces circonstances en raison du risque de flutter 1/1. Le traitement chronique ou la prévention des récidives dépend du mécanisme de l’arythmie.
Flutter atrial commun
Les taux de succès très élevés associés à un faible taux de complications, ont fait de l’ablation de l’isthme cavo-tricuspide le meilleur traitement du flutter atrial commun (symptomatique ou associé à une altération de la FEVG), que cela soit en prévention des récidives (classe IA) ou même en 1ère intention (IIa B) (19). Les traitements ralentisseurs (classes II ou IV, digitaliques, exceptionnellement l’amiodarone) sont réservés aux contre-indications générales à l’ablation, aux refus du patient, ou à l’échec de l’ablation.
Autres Flutters et Tachycardies Atriales focales
Les macro-réentrées atriales ne dépendant pas de l’isthme cavo-tricuspide sont beaucoup plus rares et surviennent le plus souvent sur des oreillettes cicatricielles (et actuellement majoritairement après une ablation de FA persistante). Les antiarythmiques sont peu efficaces et l’ablation est le traitement de 1ère intention (dans des centres équipés de systèmes de cartographie 3D) (I B).
Les tachycardies atriales focales (droites ou gauches) sont peu sensibles aux antiarythmiques et difficiles à ralentir. L’ablation est donc également la meilleure solution (classe IB).
En cas d’échec, de refus ou de balance bénéfice/risque défavorable, on utilisera les bradycardisants (classes II ou IV) (IIa), la digoxine et en cas de résultat insuffisant l’amiodarone (IIb C)19. L’amiodarone peut aussi être essayée pour éviter la récidive après cardioversion. L’ablation de la conduction atrio-ventriculaire associée à une stimulation biventriculaire est proposée en cas d’échec des traitements précédents.
Enfin, les tachycardies sinusales inappropriées relèvent des AA bradycardisants (bêtabloquant et/ou Ivabradine –classe IIa), les tachycardies par réentrée sino-atriale des inhibiteurs calciques bradycardisants (classe IIb C) ou en cas d’échec de l’ablati on (classe IIa C)19.
Fibrillation Atriale
La FA est l’arythmie la plus fréquente et c’est donc pour son traitement que la « lutte de part de marché » est la plus disputée. Comme signalée plus haut, l’effi cacité des anti arythmiques pour la prévention des récidives de FA est décevante (11). L’ablation est plus efficace pour prévenir la récidive de FA mais n’a pas, à ce jour, démontré de bénéfice en termes de mortalité (20). L’étude EAST-AFNET a testé l’effet d’une stratégie de maintien du rythme sinusal par rapport à une stratégie de contrôle de la fréquence et ne pouvait donc pas montrer de bénéfice de l’ablation en termes de mortalité (21).
De plus, l’ablation est un geste invasif, associé à un risque non négligeable de complications graves (autour de 5%) et de mortalité péri-interventionnelle pouvant aller jusqu’à 0,5%22. Les recommandations ESC 2020 (23) tiennent compte de ces différents éléments mais leur formulation peut être considérée comme « ouvrant la porte » à toutes les éventualités. En première intention, et en cas de FA paroxystique ou persistante mais à faible risque de récidive, le traitement antiarythmique a une indication de classe I et l’ablati on en classe IIa (IIb si la FA est persistante mais à faible risque de récidive). L’indication est donc « plus forte » pour les antiarythmiques. Le choix entre ablation et anti arythmique doit, d’après les recommandations, être guidé par la préférence du patient. Il faut cependant s’assurer que le choix du patient n’est pas principalement celui du praticien… Dans notre expérience, une présentation objective des bénéfices/risques des 2 stratégies, précisant que les 2 ne sont pas exclusives dans le temps, aboutit dans la grande majorité des cas au choix, par le patient, d’un traitement antiarythmique en 1ère intention. Lorsque la FA récidive sous antiarythmiques, ou en cas de cardiomyopathie rythmique, l’ablation est en indiquée en 1ère intention (classe I)23.
Enfin, la probabilité de maintien en rythme sinusal est souvent futi le chez les patients très âgés et/ou en présence d’un substrat atrial très évolué. Dans ces situations, la FA est le plus souvent tolérée avec un objectif thérapeutique de contrôle de la réponse ventriculaire en FA (avec des classes II, IV ou un digitalique) (23). Ces situations seront largement majoritaires dans les prochaines années. En effet, des projections démographiques prévoient pour 2060 que 2/3 des patients avec une FA auront plus de 80 ans (24).
Extrasystoles & Tachycardies Ventriculaires
Les indications des antiarythmiques dans les arythmies ventriculaires ont été récemment précisées dans les recommandations 2022 de l’ESC sur la mort subite (25).
Extrasystoles ventriculaires et Tachycardies Ventriculaires sur cœur sain
Il est légitime de traiter les ESV/TV lorsqu’elles sont gênantes et/ou si on suspecte qu’elles sont responsables d’une altération de la fracti on d’éjection ventriculaire gauche.
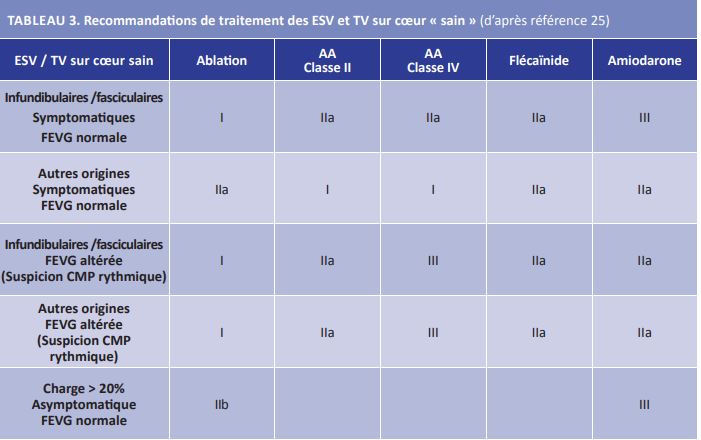
Le Tableau 3 résume les recommandations de traitements ESC 202225. On constate dans ce tableau que l’ablation est proposée en 1ère intention en cas d’ESV/TV infundibulaires ou fasciculaires symptomatiques et en cas de cardiomyopathie rythmique induite par les ESV. Les antiarythmiques restent indiqués pour les autres origines topographiques, en cas d’échec de l’ablation ou encore lorsque le patient ne souhaite pas une procédure invasive. Les inhibiteurs calciques bradycardisants sont classiquement contre-indiqués en cas d’altérati on de la FEVG. Cela est le cas également pour le flécaïnide qui est cependant proposé dans ces recommandations. Enfin, on peut s’étonner de la recommandation (certes faible IIb) d’ablation ESV chez les patients asymptomatiques avec charge > 20% et une FEVG normale. En effet, il a été montré que dans nombre de cas la charge en ESV diminuait spontanément lors du suivi et que l’évolution vers la cardiomyopathie rythmique était rare et réversible si traitée (26).
Tachycardies ventriculaires sur cardiopathie ischémique
Les bêtabloquants intra-veineux restent la pierre angulaire du traitement rythmique lors des SCA ST+ (prévention primaire – classe IIa, ou 2 aire classe I). En cas de récidive d’arythmie on utilise l’amiodarone (IIa) parfois associée à la lidocaïne (classe IIb) (25). L’ablation intervient en dernier recours avec l’overdrive pacing (IIa) et avec la sédation, la modulation autonomique, et l’assistance circulatoire (classe IIb) (25).
En chronique, la cicatrice d’infarctus peut constituer le substrat de TV monomorphes soutenues récidivantes. La prévention primaire passe également par les bêtabloquants et une « thérapie médicale optimale » du post infarctus adaptée à la FEVG. L’ablation est plus efficace que les antiarythmiques pour prévenir la survenue d’une 1ère TV ou d’une récidive sur cicatrice d’infarctus. Cependant, la mortalité péri procédure est significative (3 à 5% dans les meilleurs centres), l’ablation n’est pas associée à une diminution de la mortalité et enfin, les stratégies d’ablation précoce n’ont pas démontré de bénéfice clinique (27, 28, 29). De plus l’étude VANISH a montré que l’amiodarone était aussi efficace que l’ablation dans la prévention de la récidive de TV, avec une tendance à une mortalité plus faible (30). L’étude PARTITA semble montrer un résultat plus en faveur de l’ablation mais a des limites méthodologiques majeures (31). Ces éléments supportent l’utilisation des bêtabloquants dans tous les cas (prévention 1èreet 2ème intention). La survenue d’une TV fait poser la question de l’indication du DAI qui est indispensable si la FEVG est altérée. Chez le patient avec une FEVG > 40% ou déjà porteur d’un DAI, il faut privilégier l’ajout de l’amiodarone en cas de TV (classe IIa). Si les TV sont fréquentes, mal tolérées, transformées en FV par la stimulation antitachycardique, ou nécessitent une réduction par choc, l’ablation est alors la meilleure solution thérapeutique (classe I) (25) (Tableau 4). Le Sotalol garde une place dans les recommandations mais semble d’efficacité limitée.
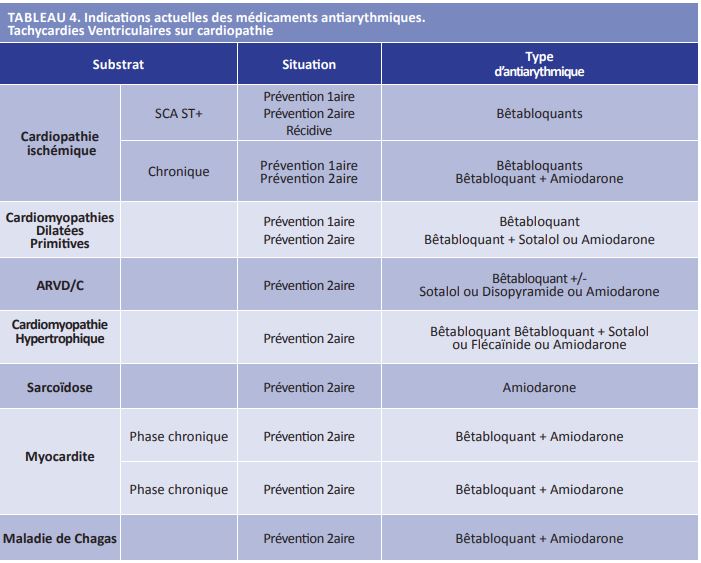
Tachycardies ventriculaires sur cardiopathie non ischémique
Dans les cardiomyopathies dilatées non ischémiques, l’ablation par cathéter des TV est moins efficace, nécessite plus souvent un abord épicardique et est associée à un risque plus important de complications.
Dans les cardiomyopathies dilatées primitives, le traitement bêtabloquant est toujours indiqué. En cas de TV soutenues (mais pas en préventi on primaire) il faut prescrire l’amiodarone (classe IIa B) et c’est seulement lorsque les TV (symptomatiques ou nécessitant un choc) récidivent sous amiodarone qu’il faut envisager une ablation dans un centre « expert » et équipé d’une infrastructure permettant de gérer les complications de l’ablation (classe IIa C) (25).
Les indications sont très similaires dans les dysplasies arythmogènes avec cependant une place pour le sotalol et le fl écaïnide (25).
Dans la cardiomyopathie hypertrophique, les antiarythmiques sont prescrits en cas de TV symptomatique (classe IIa C), avant de proposer l’ablation (IIb C) (25).
Les antiarythmiques sont également utilisés avant l’ablation dans la sarcoïdose, les myocardites, la maladie de Chagas (25) (Tableau 4).
Prévention primaire de la mort subite ou de la récidive de TV polymorphes ou fibrillations ventriculaires
Les indications des antiarythmiques ont, ici également, été récemment précisées dans les recommandations 2022 de l’ESC sur la mort subite (25).
Le nombre de situations cliniques et de médicaments antiarythmiques est très important.
Nous allons ici lister les différentes indications parmédicament antiarythmique (Tableau 5).
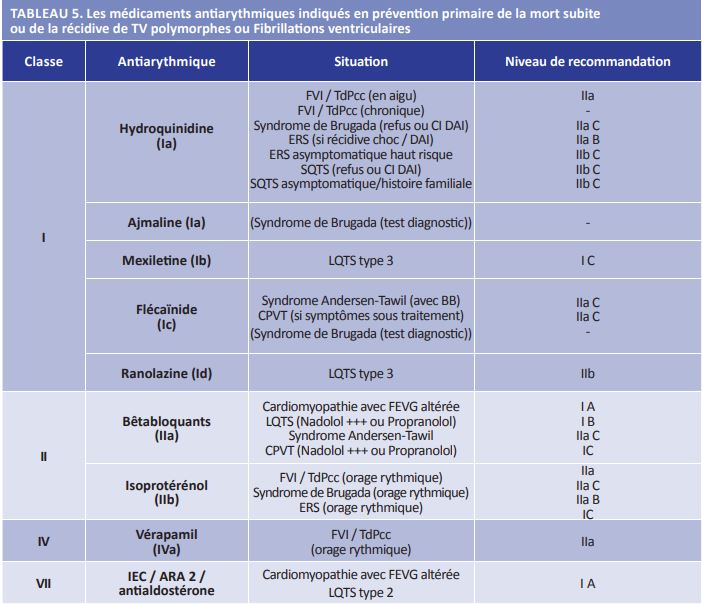
Certaines indications mentionnées dans le tableau 5 sont peu fréquentes (maladies rares) mais font appel à des médicaments dont la distribution n’est pas assurée dans tous les pays (par exemple le nadolol en Allemagne ou l’hydroquinidine dans de nombreux pays) et la pérennité de leur distribution est menacée au niveau global.
Conclusions
Les antiarythmiques sont indiscutablement des médicaments potentiellement dangereux. Cependant, dans des nombreuses situations il n’y a pas d’alternative thérapeutique ou encore les alternatives n’ont pas toujours un meilleur profil bénéfice/risque.
Les alternatives non-pharmacologiques interventionnelles (DAI, ablati on) sont actuellement fortement mises en avant pour de raisons parfois scientifiquement validées. Cependant, les études comparatives utilisent souvent des critères de jugement rythmologiques et nous manquons d’études randomisées d’évaluation de stratégies thérapeutiques avec des critères de jugement cliniques « durs » et pas seulement rythmiques.
La « tentation » interventionnelle est, peut-être, également favorisée par la rémunération actuelle et la valorisation financière hospitalière des actes de rythmologie interventionnelle qui n’incitent pas toujours à une lecture critique des publications médicales ni à un choix centré sur l’intérêt du patient.
La réponse à la question provocatrice du titre de cet article est donc affirmative. Nous avons encore besoin des médicaments antiarythmiques dans les très nombreuses situations cliniques décrites dans les différentes tables de cet article. Contrairement à ce que l’on aurait pu penser, ce besoin est croissant (Figure 3) (32). Cette utilisation doit être raisonnée, adaptée à la situation de chaque patient et aux co-prescriptions. On peut pour cela s’aider du consensus publié par l’EHRA (8).
Enfin, il est également important que les cardiologues et les rythmologues agissent afin que les tentations de la HAS de limiter la prescription de cette classe thérapeutique d’une part et les logiques industrielles d’autre part, n’aboutissent à la perte d’accès à certains de ces médicaments et infine à des impasses thérapeutiques au détriment de nos patients.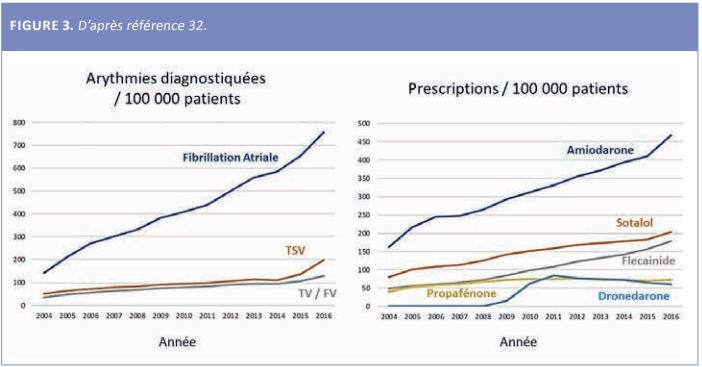
Fabrice Extramiana, Vincent Algalarrondo, Anne Messali, Amir Zouaghi, Charles Morgat, Patrick De Jode, Isabelle Denjoy, Antoine Leenhardt,
Hôpital Bichat, Paris
Références
1. Vaughan Williams EM. In Cardiac Arrhythmias Sweden, Astra, Sodertaije, 1981, pp 449-472.
2. Vaughan William EM. J Clin Pharmacol 1984;24:129-1473.
3. Leung LWM, Akhtar Z, Seshasai SRK, Gallagher MM. First-line management of paroxysmal atrial fibrillation: is it time for a ‘pill in the bin’ approach? A discussion on the STOP AF First, EARLY AF, Cryo-FIRST, and EASTAF NET 4 clinical trials. Europace. 2022 Apr 5;24(4):533-537.
4. Echt DS, Liebson PR, Mitchell LB, Peters RW, Obias-Manno D, Barker AH, Arensberg D, Baker A, Friedman L, Greene HL, et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med. 1991 Mar 21;324(12):781-8.
5. Waldo AL, Camm AJ, deRuyter H, Friedman PL, MacNeil DJ, Pauls JF, Pitt B, Pratt CM, Schwartz PJ, Veltri EP. Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival With Oral d-Sotalol. Lancet. 1996;348(9019):7-12.
6. The Sicilian gambit. A new approach to the classification of anti-arrhythmic drugs based on their actions on arrhythmogenic mechanisms. Task Force of the Working Group on Arrhythmias of the European Society of Cardiology. Circulation on. 1991;84(4):1831-51.
7. Lei M, Wu L, Terrar DA, Huang CLH. Modernized Classifi cati on of Cardiac Antiarrhythmic Drugs. Circulation on. 2018 Oct 23;138(17):1879-1896.
8. Dan GA, Marti nez-Rubio A, Agewall S, Boriani G, Borggrefe M, Gaita F, van Gelder I, Gorenek B, Kaski JC, Kjeldsen K, Lip GYH, Merkely B, Okumura K, Piccini JP, Potpara T, Poulsen BK, Saba M, Savelieva I, Tamargo JL, Wolpert C; ESC Scienti fi c Document Group. Antiarrhythmic drugs-clinical use and clinical decision making: a consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology (ESC) Working Group on Cardiovascular Pharmacology, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and International Society of Cardiovascular Pharmacotherapy (ISCP). Europace. 2018;20:731-732.
9. Tisdale JE, Chung MK, Campbell KB, Hammadah M, Joglar JA, Leclerc J, Rajagopalan B, American Heart Associati on Clinical Pharmacology Committ ee of the Council on Clinical Cardiology and Council on Cardiovascular and Stroke Nursing. Drug-Induced Arrhythmias: A Scienti fi c Statement From the American Heart Association. Circulation on. 2020;142(15):e214-e233.
10. Valembois L, Audureau E, Takeda A, Jarzebowski W, Belmin J, Lafuente-Lafuente C. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev. 2019;9(9): CD005049.
11. Roy D, Talajic M, Dorian P, Connolly S, Eisenberg MJ, Green M, Kus T, Lambert J, Dubuc M, Gagné P, Natt el S, Thibault B. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med. 2000;342(13):913-20.
12. Connolly SJ, Dorian P, Roberts RS, Gent M, Bailin S, Fain ES, Thorpe K, Champagne J, Talajic M, Coutu B, Gronefeld GC, Hohnloser SH, Optimal Pharmacological Therapy in Cardioverter Defibrillator Patients (OPTIC) Investigators. Comparison of beta-blockers, amiodarone plus beta-blockers, or sotalol for prevention of shocks from implantable cardioverter defibrillators: the OPTIC Study: a randomized trial. JAMA. 2006;295:165-71.
13. Vassallo P, Trohman RG. Prescribing amiodarone: an evidence-based review of clinical indications. JAMA. 2007 Sep 19;298(11):1312-22.
14. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M, Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N, Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH, Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005;352:225-37.
15. Lown B, Verrier RL. Neural activity and ventricular fibrillation. N Engl J Med. 1976;294:1165-70.
16. Liang C, Zhang C, Gan S, Chen X, Tan Z. Long-Term Effect of β-Blocker Use on Clinical Outcomes in Postmyocardial Infarction Patients: A Systematic Review and Meta-Analysis. Front Cardiovasc Med. 2022 Apr 8;9:779462.
17. Mazzanti A, Maragna R, Vacanti G, Monteforte N, Bloise R, Marino M, Braghieri L, Gambelli P, Memmi M, Pagan E, Morini M, Malovini A, Orti z M, Sacilott o L, Bellazzi R, Monserrat L, Napolitano C, Bagnardi V, Priori SG. Interplay Between Geneti c Substrate, QTc Durati on, and Arrhythmia Risk in Pati ents With Long QT Syndrome. J Am Coll Cardiol. 2018 Apr 17;71(15):1663-1671.
18. Hayashi M, Denjoy I, Extramiana F, Maltret A, Roux Buisson N, Lupoglazoff JM, Klug D, Hayashi M, Takatsuki S, Villain E, Kamblock J, Messali A, Guicheney P, Lunardi J, Leenhardt A. Incidence and risk factors of arrhythmic events in catecholaminergic polymorphic ventricular tachycardia. Circulation on. 2009;119:2426-34.
19. Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, Calkins H, Corrado D, Deft ereos SG, Diller GP, Gomez-Doblas JJ, Gorenek B, Grace A, Ho SY, Kaski JC, Kuck KH, Lambiase PD, Sacher F, Sarquella-Brugada G, Suwalski P, Zaza A; ESC Scienti fi c Document Group. 2019 ESC Guidelines for the Management of Patients with supraventricular tachycardia. The Task Force for the Management of Patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020;41:655-720.
20. Packer DL, Mark DB, Robb RA, Monahan KH, Bahnson TD, Poole JE, Noseworthy PA, Rosenberg YD, Jeffries N, Mitchell LB, Flaker GC, Pokushalov E, Romanov A, Bunch TJ, Noelker G, Ardashev A, Revishvili A, Wilber DJ, Cappato R, Kuck KH, Hindricks G, Davies DW, Kowey PR, Naccarelli GV, Reiff el JA, Piccini JP, Silverstein AP, Al-Khalidi HR, Lee KL; CABANA Investigators. Effect of Catheter Ablation on vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019;321(13):1261-1274.
21. Kirchhof P, Camm AJ, Goett e A, Brandes A, Eckardt L, Elvan A, Fetsch T, van Gelder IC, Haase D, Haegeli LM, Hamann F, Heidbüchel H, Hindricks G, Kautzner J, Kuck KH, Mont L, Ng GA, Rekosz J, Schoen N, Schott en U, Suling A, Taggeselle J, Themistoclakis S, Vett orazzi E, Vardas P, Wegscheider K, Willems S, Crijns HJGM, Breithardt G; EAST-AFNET 4 Trial Investigators. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. N Engl J Med. 2020;383:1305-1316.
22. Cheng EP, Liu CF, Yeo I, Markowitz SM, Thomas G, Ip JE, Kim LK, Lerman BB, Cheung JW.Risk of Mortality Following Catheter Ablation of Atrial Fibrillation. J Am Coll Cardiol. 2019;74(:2254-2264.
23. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, Boriani G, Castella M, Dan GA, Dilaveris PE, Fauchier L, Filippatos G, Kalman JM, La Meir M, Lane DA, Lebeau JP, Letti no M, Lip GYH, Pinto FJ, Thomas GN, Valgimigli M, Van Gelder IC, Van Putt e BP, Watkins CL; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial Fibrillation developed in collaboration with the
European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the Diagnosis and Management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42:373-498.
24. Di Carlo A, Bellino L, Consoli D, Mori F, Zaninelli A, Baldereschi M, Catt arinussi A, D’Alfonso MG, Gradia C, Sgherzi B, Pracucci G, Piccardi B, Polizzi B, Inzitari D; Nati onal Research Program: Progett o FAI. La Fibrillazione Atriale in Italia. Prevalence of atrial fibrillation in the Italian elderly population and projections from 2020 to 2060 for Italy and the European Union: the FAI Project. Europace. 2019;21:1468-1475.
25. Zeppenfeld K, Tfelt-Hansen J, de Riva M, Winkel BG, Behr ER, Blom NA, Charron P, Corrado D, Dagres N, de Chillou C, Eckardt L, Friede T, Haugaa KH, Hocini M, Lambiase PD, Marijon E, Merino JL, Peichl P, Priori SG, Reichlin T, Schulz-Menger J, Sti cherling C, Tzeis S, Verstrael A, Volterrani M; ESC Scientific Document Group.2022 ESC Guidelines for the Management of Patients with ventricular arrhythmias and the Prevention of sudden cardiac death. Eur Heart J. 2022 Aug 26:ehac262.
26. Lee AKY, Andrade J, Hawkins NM, Alexander G, Bennett MT, Chakrabarti S, et al. Outcomes of untreated frequent premature ventricular complexes with normal left ventricular function. Heart 2019;105:1408–1413.
27. Santangeli P, Frankel DS, Tung R, Vaseghi M, Sauer WH, Tzou WS, Mathuria N, Nakahara S, Dickfeldt TM, Lakkireddy D, Bunch TJ, Di Biase L, Natale A, Tholakanahalli V, Tedrow UB, Kumar S, Stevenson WG, Della Bella P, Shivkumar K, Marchlinski FE, Callans DJ, International VT Ablation Center Collaborative Group. Early Mortality After Catheter Ablation of Ventricular Tachycardia in Patients With Structural Heart Disease. J Am Coll Cardiol. 2017;69:2105-2115.
28. Kampaktsis PN, Doulamis IP, Tzani A, Cheung JW. Preventive versus deferred catheter ablation of myocardial infarct-associated ventricular tachycardia: A meta-analysis. Heart Rhythm O2. 2020;1:275-282.
29. Willems S, Tilz RR, Steven D, Kääb S, Wegscheider K, Gellér L, Meyer C, Heeger CH, Metzner A, Sinner MF, Schlüter M, Nordbeck P, Eckardt L, Bogossian H, Sultan A, Wenzel B, Kuck KH; BERLIN VT Investigators. Preventive or Deferred Ablation of Ventricular Tachycardia in Pati ents With Ischemic Cardiomyopathy and Implantable Defibrillator (BERLIN VT): A Multi center Randomized Trial. Circulation. 2020;141:1057-1067.
30. Parkash R, Nault I, Rivard L, Gula L, Essebag V, Nery P, Tung S, Raymond JM, Sterns L, Doucett e S, Wells G, Tang ASL, Stevenson WG, Sapp JL.Effect of Baseline Anti arrhythmic Drug on Outcomes With Ablation in Ischemic Ventricular Tachycardia: A VANISH Substudy (Ventricular Tachycardia Ablation Versus Escalated Antiarrhythmic Drug Therapy in Ischemic Heart Disease). Circ Arrhythm Electrophysiol. 2018;11:e005663.
31. Della Bella P, Baratt o F, Vergara P, Bertocchi P, Santamaria M, Notarstefano P, Calò L, Orsida D, Tomasi L, Piacenti M, Sangiorgio S, Penti malli F, Pruvot E, De Sousa J, Sacher F, Tritto M, Rebellato L, Deneke T, Romano SA, Nesti M, Gargaro A, Giacopelli D, Perett o G, Radinovic A. Does Timing of Ventricular Tachycardia Ablation Affect Prognosis in Pati ents With an Implantable Cardioverter Defibrillator? Results From the Multi Center Randomized PARTITA Trial. Circulation. 2022;145:1829-1838.
32. Timothy M Markman TM, Zhi Geng Z, Andrew E Epstein AE, Saman Nazarian S, Rajat Deo R, Francis E Marchlinski FE, Peter W Groeneveld PW, David S Frankel DS. Trends in Antiarrhythmic Drug Use Among Patients in the United States Between 2004 and 2016. Circulation. 2020;141:937–939
