


Contexte et hypothèse
L’amylose cardiaque à transthyrétine (TTR), qu’elle soit d’origine génétique (liée à une mutation) ou non (forme sauvage), est associée à une morbi-mortalité élevée. Cette pathologie résulte de l’accumulation extracellulaire de dépôts amyloïdes formés de TTR. Les options thérapeutiques actuelles sont limitées et reposent principalement sur des stabilisateurs de la TTR, comme le TAFAMIDIS et l’ACORAMIDIS, qui ont déjà montré un bénéfice. Le VUTRISIRAN, un traitement à ARN interférent, inhibe la synthèse hépatique de la TTR (qu’elle soit mutée ou sauvage) et a déjà démontré son efficacité dans la polyneuropathie liée à l’amylose TTR génétique1 . Une analyse post-hoc de cette étude a également suggéré un effet cardiaque bénéfique2. L’étude HELIOS-B vise à évaluer l’efficacité et la sécurité du VUTRISIRAN dans l’atteinte cardiaque de l’amylose à TTR, qu’elle soit génétique ou sauvage, en comparaison avec un placebo.
Critères d’inclusion et exclusion :
Inclusion
– Âge entre 18 et 85 ans.
– Diagnostic d’amylose cardiaque à TTR (génétique ou sauvage), avec confirmation histologique ou par scintigraphie osseuse montrant une fixation cardiaque sans gammapathie.
– Épaisseur septale > 12mm à l’échocardiographie transthoracique.
– Hospitalisation pour insuffisance cardiaque ou signes cliniques d’insuffisance cardiaque.
– NT-proBNP > 300pg /mL et < 8 500pg /mL (ou >600pg/mL et <8 500pg/mL en cas de fibrillation atriale).
– Distance de marche de 6 minutes > 150m.
– Traitement par TAFAMIDIS ou absence de traitement par TAFAMIDIS sans intention d’initiation du traitement dans les 12 mois suivant la randomisation.
Exclusion
– Classe NYHA IV (insuffisance cardiaque sévère).
– Classe NYHA III avec amylose avancée (stade 3).
– Polyneuropathie sévère.
– Autre cause de cardiomyopathie.
– Débit de filtration glomérulaire (DFG) <30mL/min/m2 Plan d’étude et traitements étudiés Il s’agit d’un essai clinique de phase 3, contrôlé par placebo, randomisé, multicentrique et en double aveugle. La randomisation s’est faite selon un ratio 1:1, stratifiée en fonction du type d’amylose à TTR, du stade NYHA, de l’âge, et de l’utilisation de TAFAMIDIS.
Les patients ont été assignés à recevoir soit du VUTRISIRAN (25mg), soit un placebo. Les injections sous-cutanées étaient administrées toutes les 12 semaines pendant une durée de 36 mois. Au-delà de 36 mois, une phase d’extension en ouvert de 24 mois a permis à tous les patients de recevoir du VUTRISIRAN.
Critères de jugement
Les critères d’évaluation ont été analysés séparément dans la population globale et dans la population sans TAFAMIDIS (c’est-à-dire les patients qui ne recevaient pas de traitement par TAFAMIDIS au départ), permettant ainsi une évaluation précise des effets du VUTRISIRAN en monothérapie. Le critère de jugement principal (CJP) était un composite de mortalité toute cause et récurrence d’événements cardiovasculaires (hospitalisation ou consultation urgente pour insuffisance cardiaque) durant la période en double aveugle (jusqu’à 36 mois).
Critères secondaires :
– Mortalité toute cause à 42 mois.
– Test de marche de 6 minutes à 30 mois.
– Évaluation de la qualité de vie par le KCCQ-OS à 30 mois.
– Classe NYHA à 30 mois.
– Surveillance de la sécurité tout au long de l’étude par un comité indépendant de surveillance des données : événements indésirables, surveillance clinique et biologique.
Hypothèses et méthodologie statistique
L’hypothèse principale de l’étude est que le VUTRISIRAN est supérieur au placebo sur le CJP. L’échantillon de 654 patients, dont 60% en monothérapie, a permis d’atteindre une puissance d’environ 80% pour détecter une différence entre les groupes. Les analyses ont utilisé un modèle modifié d’Andersen-Gill avec un estimateur de variance robuste, tenant compte de covariables telles que le type d’amyloïdose, la classe NYHA, l’âge et le niveau de NT-proBNP. Le risque alpha pour les critères a été contrôlé à un niveau de signification bilatéral de 0,05 via une procédure de gatekeeping basée sur Hochberg. Les critères de jugement ont été évalués séparément dans la population globale et la population sous monothérapie, aboutissant à 10 critères préspécifiés (2 principaux et 8 secondaires) testés de manière hiérarchique.
Population
Entre 2019 et 2021, 655 patients ont été inclus dans 87 centres répartis sur 26 pays, dont 326 dans le groupe VUTRISIRAN et 329 dans le groupe placebo. Parmi eux, 40% ne prenaient pas de TAFAMIDIS au moment de l’inclusion, constituant ainsi la population en monothérapie (196 patients dans le groupe VUTRISIRAN et 199 dans le groupe placebo). Les caractéristiques initiales sont présentées dans le Tableau 1.
1. Adams D, Tournev IL, Taylor MS, et al. Efficacy and safety of vutrisiran for patients with hereditary transthyretin-mediated amyloidosis with polyneuropathy: a randomized clinical trial. Amyloid 2023;30:1-9. 2. Garcia-Pavia P, Grogan M, Kale P, et al. Impact of vutrisiran on exploratory cardiac parameters in hereditary transthyretin-mediated amyloidosis with polyneuropathy. Eur J Heart Fail 2024;26:397- 410.
Résultats
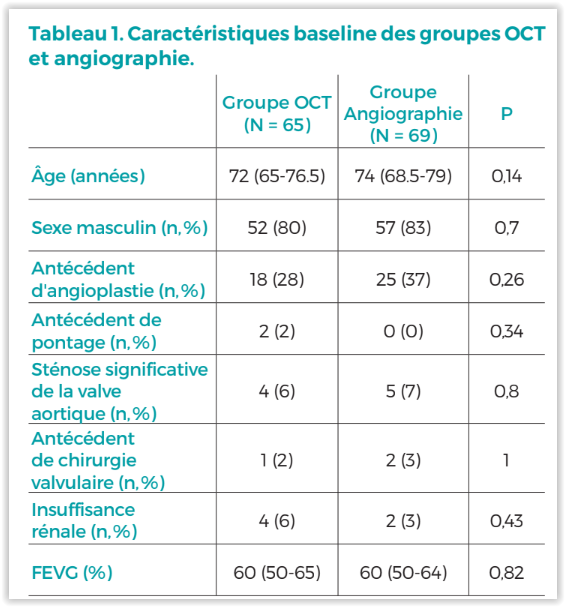
Concernant l’analyse du critère de jugement principal, le VUTRISIRAN a significativement réduit le risque d’évènement, incluant la mortalité toutes causes et la récurrence des événements cardiovasculaires, par rapport au placebo (HR = 0,72 ; IC 95% : 0,56-0,93 ; P= 0,01 ; Tableau 2). Chaque composant du CJP a également montré une réduction individuelle. Les courbes de survie de Kaplan-Meier divergaient dès 6 mois (Figure 1).
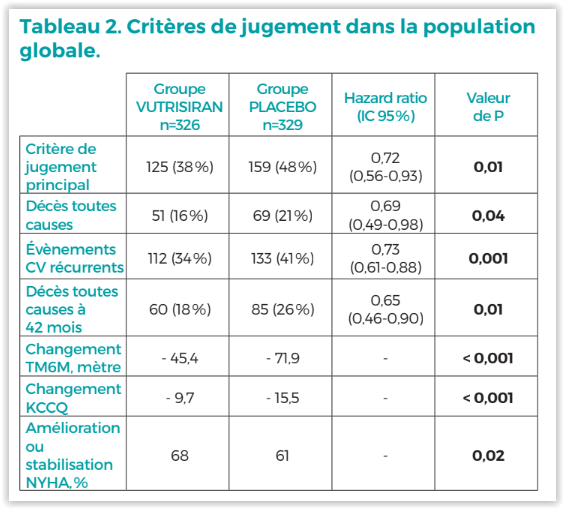
Concernant les critères secondaires, dans le groupe VUTRISIRAN :
– La mortalité toutes causes à 42 mois a été significativement réduite par rapport au placebo (HR = 0,65 ; IC 95% : 0,46-0,90 ; P = 0,01 ; Figure 2).
– La diminution de performance évaluée par le test de marche de 6 minutes était moins importante que dans le groupe placebo (P < 0,001).
– Le score de qualité de vie, évalué via le questionnaire KCCQ, était moins altéré que dans le groupe placebo (P < 0,001).
– Enfin, une détérioration de la classe NYHA était moins fréquemment observée par rapport au groupe placebo (P = 0,02).
Au sein de la population en monothérapie (sans traitement par TAFAMIDIS associé), des résultats similaires ont été observés hormis pour le décès de toutes causes à 36 mois.
Concernant la sécurité, l’incidence d’effets secondaires était identique dans les 2 groupes et le traitement a été arrêté chez 10 (3%) et 13 (4%) patients, au sein des groupes VUTRISIRAN et placebo respectivement.
Conclusion
Dans cet essai contrôlé, randomisé et multicentrique, le traitement par VUTRISIRAN a significativement réduit le risque de décès toutes causes confondues et les événements cardiovasculaires récurrents chez les patients atteints d’amylose cardiaque à TTR, par rapport au placebo. Cet effet bénéfique a été observé aussi bien chez les patients sous TAFAMIDIS que chez ceux n’en recevant pas. En outre, le VUTRISIRAN a été associé à une moindre détérioration de la fonction physique ainsi qu’à une amélioration de la qualité de vie des patients.
COMMENTAIRE
Les résultats de cet essai ouvrent de nouvelles perspectives dans le
traitement de l’amylose cardiaque à TTR. Le VUTRISIRAN a montré
une réduction significative de la mortalité et des événements
cardiovasculaires, ainsi qu’une amélioration de la fonction
physique et de la qualité de vie. Des études supplémentaires
sont nécessaires pour évaluer son impact à long terme et chez
des patients présentant des stades plus avancés de la maladie.

Caroline Chong-Nguyen, Inselspital, Berne, Suisse
OCT versus angioraphy pour le guidage des angioplasties des lésions coronaires calcifiées : l’étude CALIPSO (Calcified Lesion Intervention Planning Steered by OCT).
Contexte et hypothèse
Les calcifications coronariennes sont très fréquentes parmi les sténoses athéromateuses (30 à 40 % selon l’angiographie mais 75 à 85% selon l’imagerie intracoronaire) et augmentent le risque d’évolution défavorable après une angioplastie (PCI), y compris la resténose du stent, la thrombose et la nécessité d’une revascularisation répétée. Différents algorithmes de prise en charge des lésions calcifiées basés sur l’imagerie intracoronaire ont été proposés, mais les données soutenant cette approche sont actuellement rares.
Les objectifs de cette étude sont les suivants :
– Évaluer la supériorité du guidage OCT par rapport au guidage angiographique pour la PCI des lésions calcifiées.
– Évaluer la sécurité du guidage OCT dans la PCI des lésions calcifiées.
Critères d’inclusion
– Patient avec lésion coronarienne stable
– Lésion coupable modérément à sévèrement calcifiée selon la classification de Mintz
– Possibilité anticipée de franchir la lésion coupable avec le cathéter OCT
Critères d’exclusion
– Choc cardiogénique
– SCA lié à la lésion cible
– Insuffisance rénale sévère (clairance de la créatinine <30ml/min/m2) – Impossibilité de franchir la lésion cible avec le cathéter OCT et les ballons, indication d’utilisation du dispositif Rotablator en première ligne
– Âge < 18 ans, refus de consentir
– Grossesse
Plan d’étude et traitements étudiés
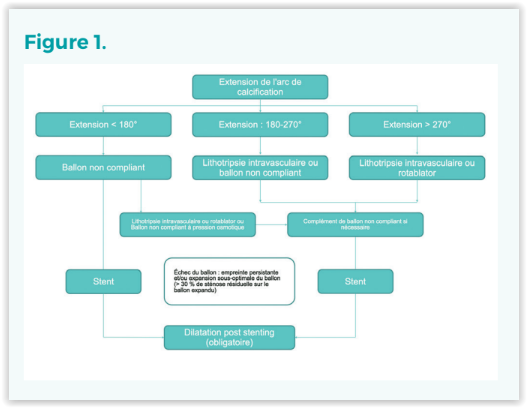
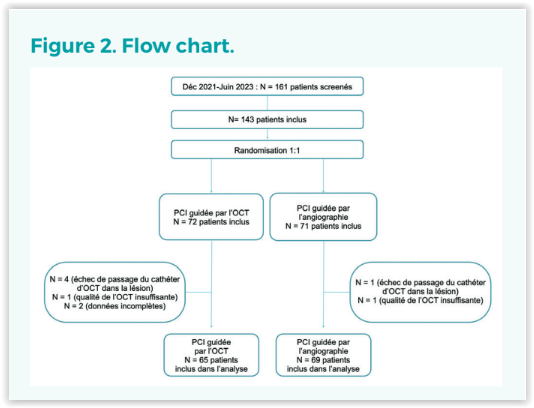
Il s’agit d’un essai prospectif, multicentrique, randomisé et de supériorité comparant la stratégie PCI guidée par OCT et la stratégie PCI basée sur l’angiographie pour la prise en charge des lésions calcifiées. La figure 1 résume le flow chart procédural.
Critères de jugement
Critère principal :
• Surface minimale du stent après PCI sur l’OCT final
Critères secondaires :
• Efficacité :
» Expansion géométrique du stent (%) selon les critères LEMON ou DOCTORS » % de sténose post-PCI (angiographie coronarienne quantitative)
» % de mauvaise apposition résiduelle majeure
» MACE à 30 jours et 1 an (décès CV + Target Lesion Revascularization + IM + thrombose de stent)
• Sécurité :
» Infarctus du myocarde périprocédural (définition SCAI)
» Dose de radiation / volume de produit de contraste / durée de la procédure
Population
161 patients ont été screenés et 134 inclus dans 14 centres en France entre décembre 2021 et juin 2023. Les caractéristiques baseline sont résumés dans le tableau 1. La figure 2 résume le flow chart de l’étude.

– Résultats : critère de jugement principal
La surface moyenne des stents atteinte était significativement plus grande dans le groupe OCT (médiane de 8,4mm2, IQR : 7-10,3) par rapport au groupe Angiographie (médiane de 7,4mm2, IQR : 6,4-8,6) (p=0,01). Le pourcentage de la surface moyenne des stents <4,5mm2 (figure 3) est significativement moins élevé dans le groupe OCT que dans le groupe guidé par l’angiographie (8% versus 36%, p<0,001).

– Critères secondaires (Tableau 2)
Le succès de l’expansion géométrique des stents était significativement plus élevé dans le groupe OCT, avec 75% (49 patients) atteignant le succès contre 29% (20 patients) dans le groupe Angiographie (p<0,001). Il n’y avait pas de différence significative dans l’incidence de la malapposition majeure entre le groupe OCT (35%, 26 patients) et le groupe Angiographie (49%, 34 patients) (p=0,1). Le pourcentage de stent mal apposé était significativement plus bas dans le groupe OCT (médiane de 0%, IQR : 0-8,3) par rapport au groupe Angiographie (médiane de 0%, IQR : 0-14,5) (p=0,02).
– Événements indésirables et tolérance
Aucun MACE supplémentaire n’a été enregistré dans aucun groupe au cours du premier mois (8,1% dans le groupe OCT contre 8,8% dans le groupe angiographie). Les complications étaient similaires entre les groupes OCT et Angiographie, sans différences significatives en termes de perforation distale, de rupture coronaire, ou de dissection significative. La durée de la procédure, la durée de la fluoroscopie, la dose de radiation et le volume de contraste utilisé étaient également comparables entre les deux groupes. Le tableau 3 résume les événements indésirables.


Conclusion
L’étude CALIPSO est la première étude randomisée contrôlée comparant l’angioplastie guidée par OCT et celle guidée par l’angiographie pour les lésions calcifiées modérées à sévères, en utilisant un algorithme prédéfini pour la préparation de la plaque, le dimensionnement du stent et l’optimisation. La surface minimale du stent post-PCI atteinte dans le groupe OCT était supérieure à celle atteinte avec un guidage angiographique, répondant ainsi au critère d’évaluation principal de l’essai. De plus, la PCI guidée par OCT a entraîné une expansion moyenne du stent significativement plus grande et une moindre apposition anormale que la PCI guidée par angiographie, sans aucune différence concernant la sécurité procédurale. Si cette supériorité en termes de critères d’imagerie est susceptible de se traduire par un bénéfice clinique, une évaluation future sera nécessaire.


