Présentation par M Thornhill (University of Scheffield, UK) ; Late Breaking Clinical Trials, lundi 17 novembre 2014
Contexte et objectifs :
Depuis la sortie des premières recommandations sur l’antibioprophylaxie de l’endocardite infectieuse (EI) dans les années 1950, les mises à jour successives ont progressivement conduit à une diminution de la durée du traitement et circonscrit le périmètre des patients à risque comme celui des procédures invasives concernées. L’absence d’études randomisées à entretenu une polémique sur le bienfondé de ces évolutions. La prise de conscience collective que le brossage dentaire relargue plusieurs fois par jour des quantités de bactéries tout aussi inquiétantes que celles libérées par une extraction dentaire a contribué à une prise de conscience qui a abouti aux recommandations 2008 du NICE (National Institute for Health and Care Excellence). Ces recommandations ont marqué un véritable tournant dans l’approche de la prévention de l’EI puisque qu’elles écartaient purement et simplement l’antibioprophylaxie pour les procédures dentaires et pour les procédure touchant aux parties hautes et basses du tractus gastro-intestinal, au tractus génito-urinaire et aux tractus respiratoire.
Des voix s’étaient alors élevées pour souligner la nécessité d’une évaluation des conséquences de ce changement stratégique radical. C’est désormais chose faite avec l’enquête nationale menée au Royaume-Uni et dont les résultats ont été présentés en Late Breaking Clinical Trials par M Dayer du National Health System à Chicago durant l’AHA.
Méthodologie :
Les informations sur l’antibioprophylaxie viennent de 2 sources : d’abord par le recensement de toutes les prescriptions d’une dose unique soit de 3 g d’amoxyciline, soit de 600 mg de clindamycine ; ensuite par le recensement de tous les patients sortis d’une hospitalisation avec un diagnostic d’endocardite infectieuse entre le 1er janvier 2000 et le 31 mars 2013. L’étude a ainsi pu porter sur un total de 19 804 cas.
Résultats :
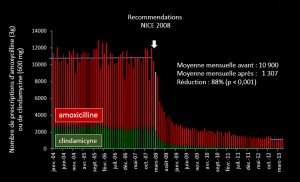
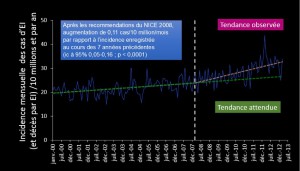
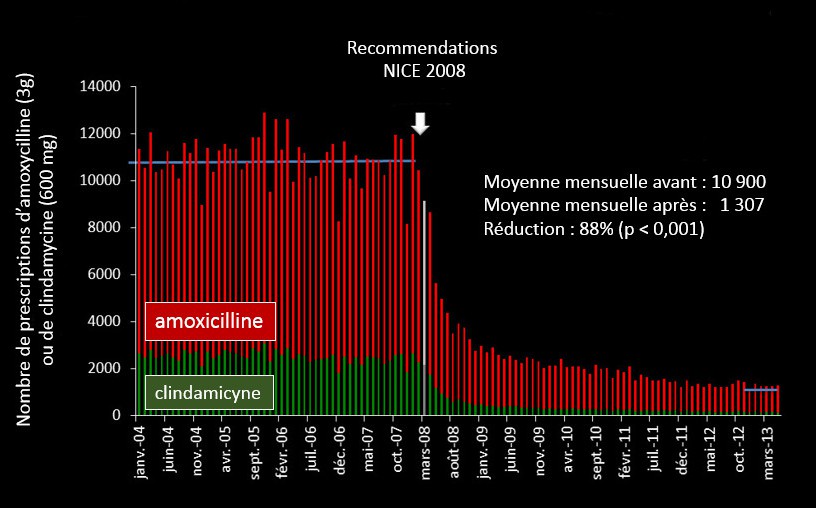
La diminution du nombre de prescriptions de ces deux antibiotiques a été spectaculaire puisqu’elle est passée de 10 900 en mars à 1 307 en mars 2013 (figure 1). Les droites de tendances issues des courbes d’incidence des nouveaux cas d’EI, traduisent une augmentation linéaire progressive entre janvier 2000 et décembre 2007 mais, au-delà, la pente est plus marquée et traduit une augmentation plus rapide de l’incidence des nouveaux cas (figure 2). En mars 2013, cette augmentation correspondait à 35 endocardites supplémentaires par mois depuis 2008. Pour impressionnante qu’elle soit, cette progression est troublante puisqu’il suffit de décaler de 3 mois le départ le lissage de la courbe après mars 2008 pour que les pentes des deux périodes (avant et après mars 2008) soient quasiment identiques. En termes de mortalité, cette augmentation d’incidence de l’EI pourrait avoir pour conséquence une augmentation de mortalité par EI estimée à 1,3 cas supplémentaires par mois ou 18 par an, mais cette augmentation n’est pas statistiquement significative.
Conclusion :
Ces données soulèvent finalement plus de questions qu’elles n’apportent de réponses, ne serait-ce parce qu’en l’absence de toute références comparatives (nombre d’hospitalisations hors EI, variation du nombre de patients à risque …) la réalité de l’augmentation n’est pas formellement démontrée. Le plus préoccupant pour nos collègues britanniques va bien être de gérer la communication avec leurs patients…
Figure 1. Enquête NHS sur l’incidence de l’endocardite infectieuse au Royaume-Uni. Nombre mensuel de prescriptions d’antibiotiques avant et après les recommandations 2008 du NICE.
Figure 2. Enquête NHS sur l’incidence de l’endocardite infectieuse au Royaume-Uni. Incidence mensuelle et droites de tendance. La droite figurant la tendance après 2008 (soit 35 cas supplémentaires/ 10 millions/an) part ici de mars 2008 mais elle serait horizontale en partant de juin 2008.