Le cholestérol des lipoprotéines de basse densité ou LDL-cholestérol (LDL-C) est reconnu comme étant une cause directe d’athérosclérose 1. De plus l’abaissement du LDL-C réduit le risque de maladies cardiovasculaires athéromateuses et les recommandations de l’ESC/EAS proposent d’atteindre des taux de LDL-C inférieurs à 0.70 g/l ou de réduire d’au moins 50% ce taux pour les patients à très haut risque cardiovasculaire 2.
Les statines sont recommandées en traitement de première intention avec possibilité d’association avec l’ézétimibe. Toutefois de nombreux patients, en particulier à très haut risque cardiovasculaire, n’atteignent pas les objectifs proposés illustrant la nécessité de disposer d’autres approches thérapeutiques. Dans ce domaine, la découverte de la protéine PCSK9 (Proprotein Convertase Subtilisin/Kexin type 9) a certainement été l’avancée la plus spectaculaire ces dernières années.
Inhibition de PCSK9 : le concept
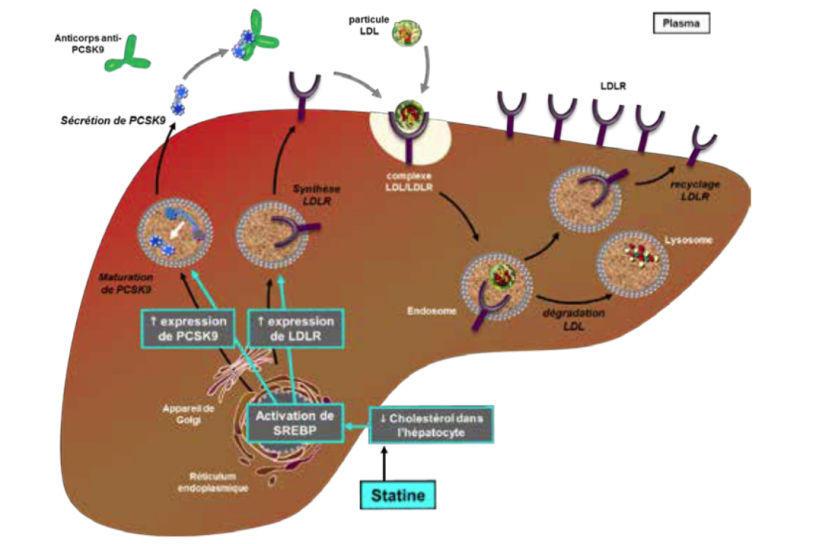
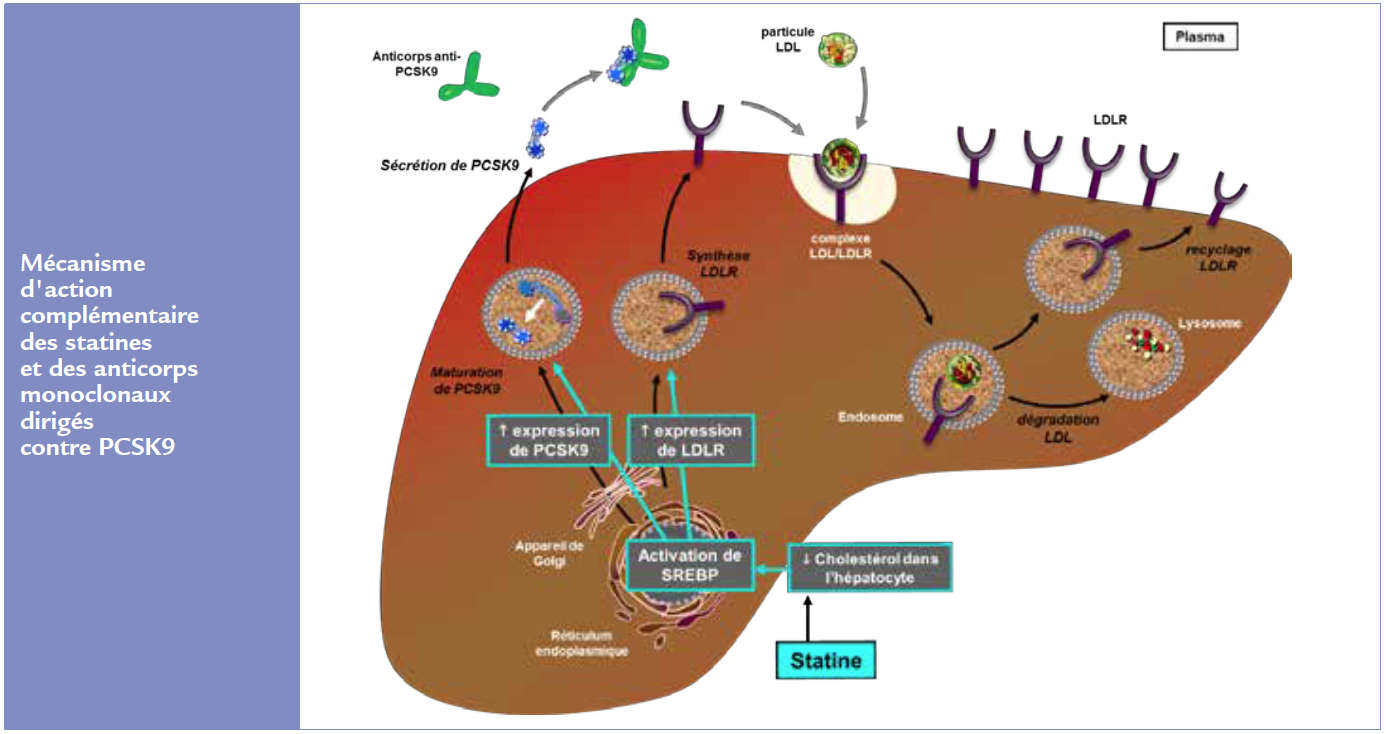
Même si de nombreux travaux sont encore nécessaires pour préciser toutes les fonctions de PCSK9 (en particulier extra-hépatiques), la fonction principale de PCSK9 est la régulation de la concentration des particules LDL. En effet PCSK9 est une protéine secrétée essentiellement par l’hépatocyte et dans le plasma, PCSK9 se lie aux récepteurs des LDL avec comme conséquence une plus grande dégradation de ces récepteurs à l’origine de la clairance des LDL plasmatiques. En résumé, plus les concentrations plasmatiques de PCSK9 seront élevées, moins il y aura de LDL-récepteurs fonctionnels à la surface de l’hépatocyte et moins de particules LDL pourront être épurées par ces récepteurs. PCSK9 est ainsi un inhibiteur endogène du récepteur des LDL et inhiber PCSK9 paraissait bien être une nouvelle voie pour abaisser le taux de LDL-C plasmatique.
De plus, et comme illustré sur la figure ci-dessous, lors d’un traitement par statine, il existe non seulement une augmentation de l’expression des LDL-récepteurs, mais aussi en parallèle une augmentation de l’expression de PCSK9, cette régulation conjointe limitant potentiellement l’effet pharmacologique de réduction du LDL-C lors d’un traitement par statine. L’association statine et inhibiteur de PCSK9 était donc une stratégie logique sur le plan pharmacologique pour obtenir le maximum de LDL-récepteurs fonctionnels disponibles à la surface de l’hépatocyte et pour abaisser en complément le taux de LDL-C.
Inhibition de PCSK9 : les stratégies possibles
De nombreuses approches thérapeutiques pouvaient être envisagées pour inhiber la fonction de PCSK9 soit au niveau intracellulaire, soit au niveau extracellulaire. Le développement d’oligonucléotides antisens inhibant la synthèse de PCSK9 a été arrêté en raison de problèmes de toxicité. Par contre de petits fragments d’ARN ou small interfering RNA (siRNA) bloquantl’ARN messager de PCSK9 sont toujours en développement avec des résultats prometteurs dans un essai de phase 2 avec inclisiran, permettant d’envisager une stratégie d’injection sous-cutanée (SC) uniquement une fois tous les 6 mois. D’autres stratégies pourraient être de bloquer le processus auto-catalytique intracellulaire de PCSK9.
Mais PCSK9 étant une protéine circulante, la stratégie la plus aisée était d’inhiber en extracellulaire la liaison de PCSK9 aux LDL-récepteurs avec diverses voies possibles d’inhibition extracellulaire comme des petits peptides, des adnectines, voire une stratégie vaccinale.
Ce sont toutefois les anticorps monoclonaux dirigés contre PCSK9 qui ont fait l’objet du développement le plus rapide avec deux anticorps totalement humains, alirocumab et évolocumab, enregistrés dès 2005 tant par l’EMA que par la FDA sur la base des résultats d’efficacité biologique et de tolérance obtenus dans deux programmes complets de développement de phase 3, montrant des réductions des taux de LDL-C de l’ordre de 50 à 70% selon les catégories de patients traités et les modalités de traitements. Un 3ème anticorps humanisé, le bococizumab, a été stoppé fin 2016 en raison de l’apparition d’anticorps anti-drogues neutralisants avec réduction de l’efficacité au cours du temps.
Inhibition de PCSK9 : les résultats cliniques
L’efficacité clinique des anticorps monoclonaux dirigés contre PSCK9 a été évaluée dans 4 grandes études de morbi-mortalité cardiovasculaire, l’étude FOURIER avec l’évolocumab, les études SPIRE-1 et 2 avec le bococizumab et l’étude ODYSSEY-Outcomes avec l’alirocumab.
Étude FOURIER 3
Dans cette étude, 27564 patients avec maladie cardiovasculaire établie mais stabilisée dont 81% avaient eu un infarctus du myocarde (IDM), 18% un accident vasculaire cérébral (AVC), et 13% une artériopathie obstructive des membres inférieurs (AOMI) symptomatique, traités par statines (69% avec des statines de forte intensité) ont été inclus si le taux de LDL-C était supérieur ou égal à 0.70 g/l ou le non HDL-cholestérol (non-HDL-C) supérieur à 1.0 g/l. Les patients ont été randomisés entre évolocumab à la dose de 150 mg toutes les 2 semaines ou de 420 mg tous les mois en injection SC ou placebo.
Après un suivi médian de 2.2 années, le LDL-C a été abaissé de 59% avec un taux médian sous évolocumab de 0.30 g/l. Le critère primaire composite associant les décès cardiovasculaires, IDM, AVC, hospitalisation pour angor instable et revascularisations coronaires a été réduit significativement de 15% (HR 0.85; IC 95% 0.79-0.92, p < 0.001), avec une réduction du risque absolu de 1.5%. Ce bénéfice est aussi observé sur le critère secondaire principal qualifié de “dur” regroupant les décès cardiovasculaires, IDM ou AVC avec une réduction du risque relatif de 20%.
Le bénéfice clinique est essentiellement lié à une réduction significative des IDM et des AVC ischémiques, ainsi que des revascularisations coronaires. Par contre, l’effet sur la mortalité totale a été neutre avec, il faut le signaler, peu de décès attribués à un IDM ou un AVC pour cette catégorie de patients en prévention secondaire. Le bénéfice absolu est logiquement plus important pour des sous-groupes de patients à très haut risque comme ceux ayant eu un IDM moins de 2 ans avant l’inclusion, ou plus d’un IDM avant la randomisation, ou une atteinte multi-vasculaire, de même que les patients avec AOMI. Les résultats de FOURIER ont permis d’obtenir en mai 2018 une nouvelle indication pour évolocumab de réduction du risque cardiovasculaire en abaissant le LDL-C chez les patients adultes avec maladie cardiovasculaire établie (IDM, AVC, ou AOMI). La tolérance d’évolocumab a été excellente, sans effet secondaire notable, incluant l’évaluation des évènements neurocognitifs.
Étude ODYSSEY-Outcomes 4
Cette étude a inclus 18 924 patients ayant présenté un syndrome coronaire aigu (SCA) 1 à 12 mois avant la randomisation et avec un taux de LDL-C ≥ 0.70 g/l (ou non-HDL-C ≥ 1.0 g/l ou apoB≥ 0.80 g/l) sous statine à dose maximale tolérée utilisée dans une période de run-in (89% sous statine de forte intensité). Le temps médian entre le SCA initial et la randomisation était de 2.6 mois et les patients ont été randomisés soit dans le groupe alirocumab, soit sous placebo avec un ajustement de la dose d’alirocumab (75 ou 150 mg SC toutes les 2 semaines) en double aveugle afin d’obtenir un niveau de LDL-C entre 0.25 et 0.50 g/l. De plus, si le niveau de LDL-C était inférieur à 0.15 g/l à 2 visites consécutives, alirocumab était remplacé par du placebo, ce qui a été le cas pour 7.7% des patients initialement sous alirocumab.
Après un suivi médian de 2.8 années, le taux de LDL-C a été abaissé de 54.7% (diminution de 62.7% à 4 mois). Le critère primaire composite associant les décès d’origine coronaire, les IDM non mortels, les AVC ischémiques et les angors instables nécessitant une hospitalisation a été réduit significativement de 15% (HR 0.85; IC 95% 0.78-0.93, p=0.0003) avec une réduction du risque absolu de 1.6%. L’analyse des critères composant le critère principal a montré une réduction significative de chacun de ces critères, excepté les décès par coronaropathie réduits de 8% sans atteindre la significativité. A noter que la mortalité totale a été réduite de 15% mais ce résultat n’est qu’une donnée informative en raison de la hiérarchisation prédéfinie des critères d’analyses. Dans des analyses complémentaires, ce sont les patients pour lesquels le LDL-C initial était supérieur à 1.0 g/l qui ont eu le maximum de bénéfice du traitement par alirocumab, mais c’est certainement dans ce sous-groupe que se trouve la majorité des patients recevant alirocumab 150 mg par jour. La tolérance globale du traitement par alirocumab a été excellente sans différence entre alirocumab et placebo, à l’exception des réactions au site d’injection un peu plus fréquentes sous alirocumab.
Études SPIRE-1 et -2 5
Les études SPIRE ont été arrêtées prématurément en raison de l’apparition d’anticorps neutralisant le bococizumab. Ces études ont toutefois permis de montrer une diminution des évènements cardiovasculaires chez les patients à haut risque de SPIRE-2 qui avaient un taux de LDL-C supérieur à 1.0 g/l à l’inclusion, avec un LDL-C initial moyen de 1.33 g/l. Dans cette étude, dont le suivi médian n’a été que de 12 mois, il a été observé une réduction significative de 21% du critère principal composite (IDM non mortel, AVC non mortel, hospitalisation pour angor instable ayant nécessité une revascularisation urgente ou décès cardiovasculaire). Dans une analyse combinée des études SPIRE-1 et -2, le bénéfice clinique a été significatif pour les patients ayant eu une baisse absolue du LDL-C supérieure à la médiane (réduction de 25%, p= 0.006 des évènements du critère principal).
Inhibition de PCSK9 : pour quels patients ?
Le bénéfice clinique à inhiber PCSK9 ayant été démontré dans les études FOURIER avec évolocumab et ODYSSEY-Outcomes avec alirocumab, l’enjeu est maintenant de définir les catégories de patients prioritaires pour cette nouvelle stratégie thérapeutique utilisant des anticorps monoclonaux dont le facteur limitant essentiel est le coût global actuel du traitement. Le niveau de LDL-C sous traitement par statine est en lui-même un indicateur d’un risque résiduel élevé. Des analyses complémentaires de l’étude FOURIER ont identifié des catégories de patients avec risque résiduel sous statine plus important comme les patients avec maladie athéromateuse récurrente, les atteintes pluri-vasculaires, les coronaropathies extensives, les patients diabétiques …
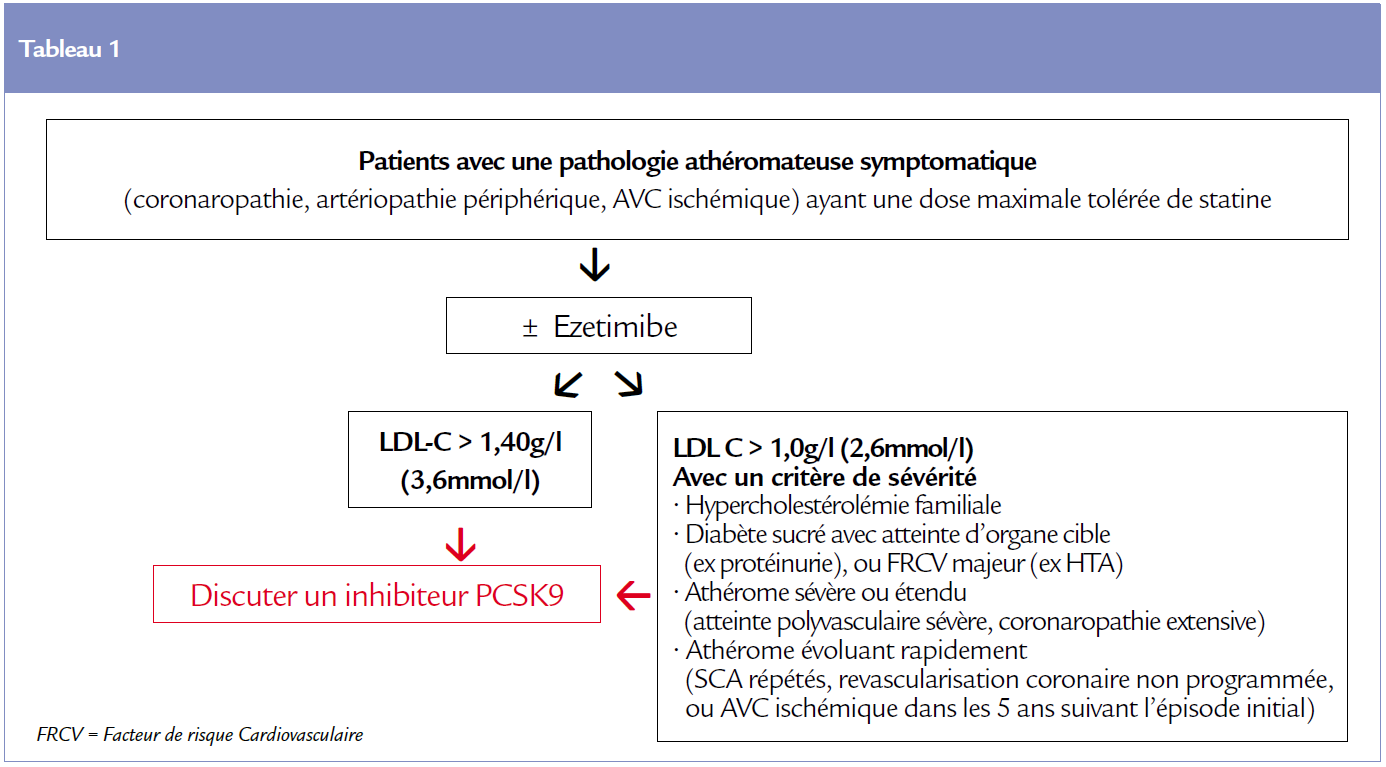
Toutes ces données ont permis à un groupe d’experts de proposer des recommandations d’utilisation des inhibiteurs de PCSK9 6 : 2 catégories de patients sont retenues comme prioritaires, les patients en prévention secondaire avec proposition de seuils de LDL-C sous traitement oral maximal toléré (Tableau 1) et également les patients avec hypercholestérolémie familiale hétérozygote en prévention primaire (Tableau 2). Pour ces 2 catégories, les seuils de LDL-C proposés pour discuter l’association à un inhibiteur de PCSK9 dépendent de la présence ou non de critères de sévérité indiqués sur les tableaux 1 et 2. Pour l’instant, l’utilisation des deux anticorps monoclonaux alirocumab et évolocumab est très restreinte en France en raison d’un remboursement limité aux formes familiales homozygotes pour évolocumab et aux formes hétérozygotes sous traitement oral maximal toléré et éligibles à la LDL-aphérèse pour alirocumab. Les résultats positifs des essais de prévention FOURIER et ODYSSEY-Outcomes devraient toutefois permettre de réexaminer la place de ces anticorps monoclonaux chez les patients en prévention secondaire de la maladie athéro-thrombotique.
Conclusion
En complément des traitements disponibles (et en particulier par statines), inhiber PCSK9 est certainement une stratégie très efficace pour abaisser les taux de LDL-C. C’est essentiellement le coût des anticorps monoclonaux humains alirocumab et évolocumab qui limite actuellement leur utilisation.
L’enjeu est de définir les catégories de patients qui devraient bénéficier en priorité de cette nouvelle classe thérapeutique.
Yves Cottin, Service de Cardiologie, CHU Dijon
yves.cottin@chu-dijon.fr
Michel Farnier Point Médical, Service de Cardiologie CHU, DIJON
michelfarnier@nerim.fr
L’auteur déclare avoir reçu des honoraires en tant qu’investigateur, expert scientifique et/ou conférencier de la part des firmes suivantes :
Abbott, Akcea/Ionis, Amarin, Amgen, AstraZeneca, Eli Lilly, Genzyme, Kowa, Merck and Co, Mylan, Pfizer, Roche, Sanofi/Regeneron et Servier.

REFERENCES
1. Ference BA, Ginsberg HN, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European
Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 38: 2459-2472.
2. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J 2016; 37: 2999-3058.
3. Sabatine MS, Giugliano RP, Keech AC, et al. for the FOURIER steering committee and investigators.Evolocumab and clinical outcomes in patients with cardiovascular disease. New Engl J Med 2017 376: 1713-22.
4. Schwartz GG, Szarek M, Bhatt DL,et al. The ODYSSEY OUTCOMES Trial: Topline Results. Alirocumab in patients after Acute Coronary Syndrome. ACC, March 10, 2018.
5. Ridker PM, Revkin J, Amarenco P, et al. Cardiovascular efficacy and safety of bococizumab in high-risk patients. N Engl J Med 2017; 376:1527-39.
6. Landmesser U, Chapman MJ, Stock JK, et al. 2017 Update of ESC/EAS Task Force on practical clinical guidance for proprotein convertase subtilisin/kexin type 9 inhibition in patients with atherosclerotic cardiovascular
disease or in familial hypercholesterolaemia. Eur Heart J 2018; 39: 1131-43.
Consultez les questions réponses d’Yves Cottin sur l’inhibition de PCSK9 :
“Quel est le pourcentage de patients concernés par un inhibiteur de PCSK9 ?„
Sur un plan théorique, les patients candidats à un inhibiteur de PCSK9 sont les patients en prévention secondaire non à l’objectif LDL-C, de même que les patients avec hypercholestérolémie familiale en prévention primaire non à l’objectif. Toutefois le nombre de patients concernés va dépendre directement des conditions de remboursement. Les patients doivent déjà recevoir le traitement oral maximal toléré et une simulation réalisée aux Etats Unis a montré qu’après intensification du traitement oral, 14% des patients auraient besoin d’un inhibiteur de PCSK9 pour atteindre l’objectif LDL-C souhaitable.
“Quelle est la bonne posologie de statine avec les inhibiteurs de PCSK9 ? „
Lorsque l’on envisage d’utiliser un inhibiteur de PCSK9, il faut déjà avoir titré la statine jusqu’à la dose maximale tolérée et il est recommandé de ce fait d’avoir un patient sous statine de forte intensité, puis sous association statine et ézétimibe, avant d’initier un inhibiteur de PCSK9.
“A-t-on des données sur le long terme avec les inhibiteurs de PCSK9 ? „
Les 2 études de prévention cardiovasculaire réalisées avec l’évolocumab (étude FOURIER) et avec l’alirocumab (étude ODYSSEY-Outcomes) ont eu une durée de suivi médian relativement courte, inférieure à 3 ans. Par contre, le suivi global de patients ayant participé aux programmes de phase 3, et en particulier pour les patients avec hypercholestérolémie familiale, dépasse maintenant 6 ans et nous avons de bonnes données de tolérance pour ces patients. Il sera toutefois nécessaire d’avoir dans le futur des données de tolérance au très long terme, comme cela a été fait avec les statines.
“Concernant l’hypercholestérolémie familiale faut-il se limiter aux scores ou faire une recherche génétique systématique ? „
Une recherche génétique systématique n’est pas indispensable pour le diagnostic d’hypercholestérolémie familiale. Un diagnostic de certitude peut être obtenu par les seuls critères clinico-biologiques, les plus utilisés étant ceux de la Dutch Lipid Clinic. Le diagnostic génétique est toutefois très utile pour affirmer le diagnostic lorsque les scores cliniques donnent la catégorie “probable”, et même lorsque le diagnostic est “certain”, le diagnostic génétique positif a un impact sur la prise en charge thérapeutique et facilite le dépistage en cascade dans la famille.
“En cas de recherche génétique comment est-elle organisée ? „
L’organisation de l’analyse génétique est certainement le point le plus limitant en France car le diagnostic génétique d’une hypercholestérolémie familiale n’est pas cotée dans les actes de biologie. Il faut donc faire appel à un centre spécialisé pour pouvoir transférer le prélèvement d’une part et obtenir l’analyse génétique d’autre part.
“Quels sont les nouvelles stratégies en développement ? „
Pour inhiber PCSK9, la stratégie en développement la plus avancée et différente des anticorps monoclonaux est l’utilisation de l’inclisiran qui permet de bloquer la synthèse intracellulaire de PCSK9. Cette molécule est en phase 3 de développement. L’utilisation d’un vaccin anti-PCSK9 est également à l’étude, mais des résultats récents n’ont pas montré semble-t-il d’efficacité suffisante en terme d’abaissement du LDL-cholestérol.
C’est donc essentiellement inclisiran qui parait prometteur avec comme intérêt de nécessiter uniquement une injection tous les 6 mois, mais avec nécessité d’avoir des données de tolérance à long terme avec cette stratégie d’inhibition intracellulaire.
L’auteur déclare les liens d’intérêt suivants : conférencier ou consultant pour Servier, Novartis, Sanofi, Boehringer, BMS, Pfizer, Bayer
