
Traitement antithrombotique chez le coronarien chronique en fibrillation atriale
La maladie coronaire est fréquente, avec une incidence au-delà de 10% chez les patients âgés de 65 ans et plus. Elle constitue la cause isolée de décès la plus fréquente dans les pays développés1,2.
Les données disponibles suggèrent une incidence annuelle de la maladie coronaire chronique entre 20 000 et 40 000 cas par million d’habitants3 . Elle concerne ainsi 1,3 à 1,5 millions de personnes en France. Une fois l’événement aigu passé, la maladie coronaire se stabilise sur le mode du syndrome coronarien chronique, dont les enjeux thérapeutiques comprennent le contrôle des facteurs de risque (notamment du LDLc) et les traitements antithrombotiques afi n d’éviter une récidive d’évènement aigu (coronaire ou d’un autre territoire artériel d’ailleurs). On considère la maladie coronaire « stabilisée » 6 à 12 mois après un syndrome coronaire aigu (SCA) et/ou la dernière revascularisation coronaire, et la thérapeutique antithrombotique recommandée au long cours est alors une mono-antiagrégation plaquettaire (AAP) par aspirine (ou clopidogrel).
Près de 10 à 15% des patients atteints d’une maladie coronaire nécessitent par ailleurs une anticoagulation orale (ACO) au long cours, principalement pour une fibrillation atriale (FA), dont l’incidence augmente aussi avec l’âge4,5. Cette situation déjà fréquente en pratique clinique risque de le devenir encore plus. D’ici 2030, on estime qu’environ 15 millions de patients seront atteints par la FA dans l’Union Européenne, avec 120 000 à 215 000 nouveaux cas par an6 . L’augmentation de la prévalence de la FA peut être attribuée à la fois à une meilleure détection de la FA infra clinique et au vieillissement de la population, avec l’augmentation parallèle de la prévalence des facteurs de risque.
Les patients coronariens chroniques avec antécédent de FA (ou nécessitant une anticoagulation au long cours) sont à risque particulièrement élevé de récidive d’événement cardiovasculaire majeur (environ 6,5% par an soit 3 à 4 fois plus que les coronariens sans FA), mais aussi de saignement majeur avec un risque 5 fois plus élevé, estimé à 2,5% par an7,8. La question du traitement antithrombotique optimal après stabilisation de la maladie coronaire, particulièrement après implantation d’un stent, chez les patients atteints de FA avec indication d’une anticoagulation au long cours est donc fréquente en pratique clinique et cruciale pour le devenir du patient.
Dans cet article nous proposons de revenir sur les données permettant d’adapter au mieux le traitement antithrombotique de ces patients coronariens chroniques qui nécessitent une anticoagulation au long cours.
Épidémiologie des risques
Le patient coronarien chronique
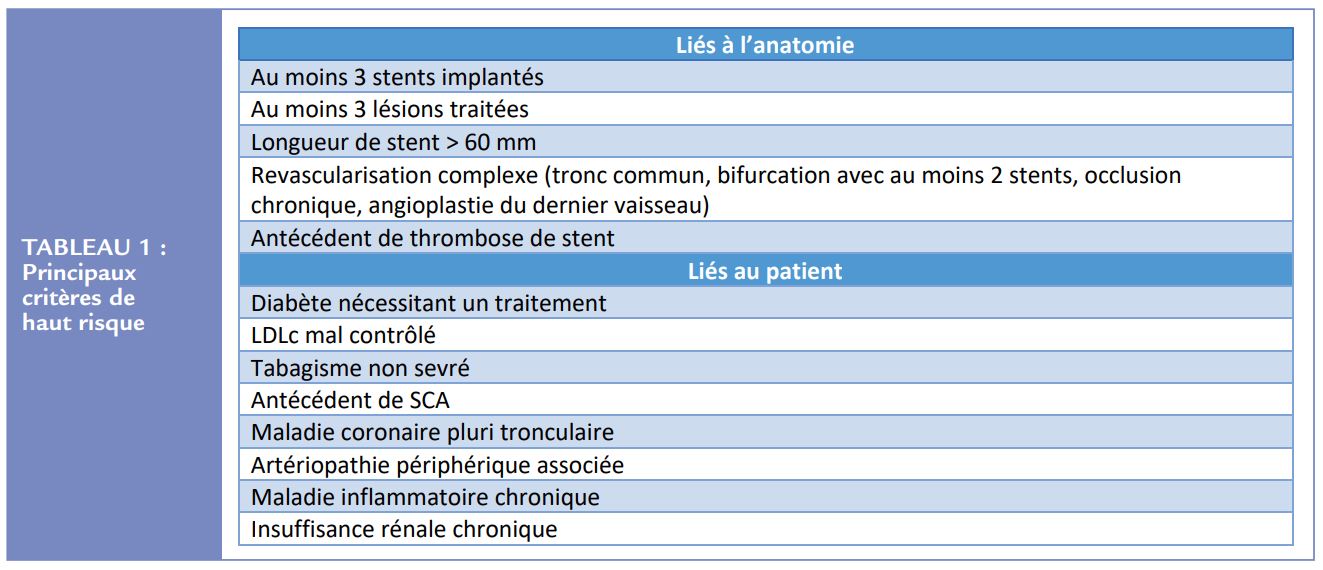
L’objectif du traitement antithrombotique est de prévenir le risque de récurrence d’évènements ischémiques liés à l’athérome. Dans le registre CLARIFY qui a inclus des coronariens chroniques, le risque d’infarctus du myocarde (IDM) était de 3,9% et le risque de revascularisation de 9% à 5 ans. Le risque d’accident vasculaire cérébral (AVC) à 5 ans était de 2,5%, et la mortalité cardiovasculaire de 5,5% à 5 ans9 . Certains facteurs de risque confèrent un risque plus élevé de récidive d’évènements athérothrombotiques (Tableau 1). On peut citer les facteurs anatomiques coronaires (nombre de vaisseaux atteints, diffusion de l’athérome, nombre de stent, de leur longueur et de la complexité des lésions traitées). Les facteurs liés au patient sont représentés par l’antécédent de SCA, le diabète, un mauvais contrôle du LDLc, l’atteinte polyvasculaire et l’insuffisance rénale chronique notamment. Encore une fois, une monothérapie AAP est recommandée par défaut chez le coronarien chronique pour limiter ce risque. Parfois, en cas de risque résiduel très élevé une double AAP pourra être poursuivie sur le long terme mais jamais dans la situation où une anticoagulation est également nécessaire pour un autre motif.
Le patient en fibrillation atriale
En ce qui concerne la FA, l’enjeu du traitement antithrombotique est la prévention du risque de mortalité et de morbidités par le biais de la prévention du risque d’AVC et des embolies systémiques. Dans les essais cliniques actuels, le taux annuel d’AVC moyen est d’environ 1,5% par an et la mortalité de toutes causes autour de 3% par an chez les patients anticoagulés pour de la FA10. Environ 80% des patients atteints de FA ont une indication formelle d’ACO au long cours (score de CHADS-VASc > 1). L’ACO est le traitement de référence pour la prévention des événements cardio-emboliques. Les anticoagulants oraux directs (AOD) sont non inférieurs aux AVK (voire supérieurs pour le dabigatran à la dose de 150 mg deux fois par jour ou l’apixaban) et réduisent le risque de saignement majeur, en particulier les saignements intracérébraux4,5,11,12. En France, les AOD sont recommandés en première intention pour la prévention des AVC dans la FA.
Le risque hémorragique sous anticoagulants
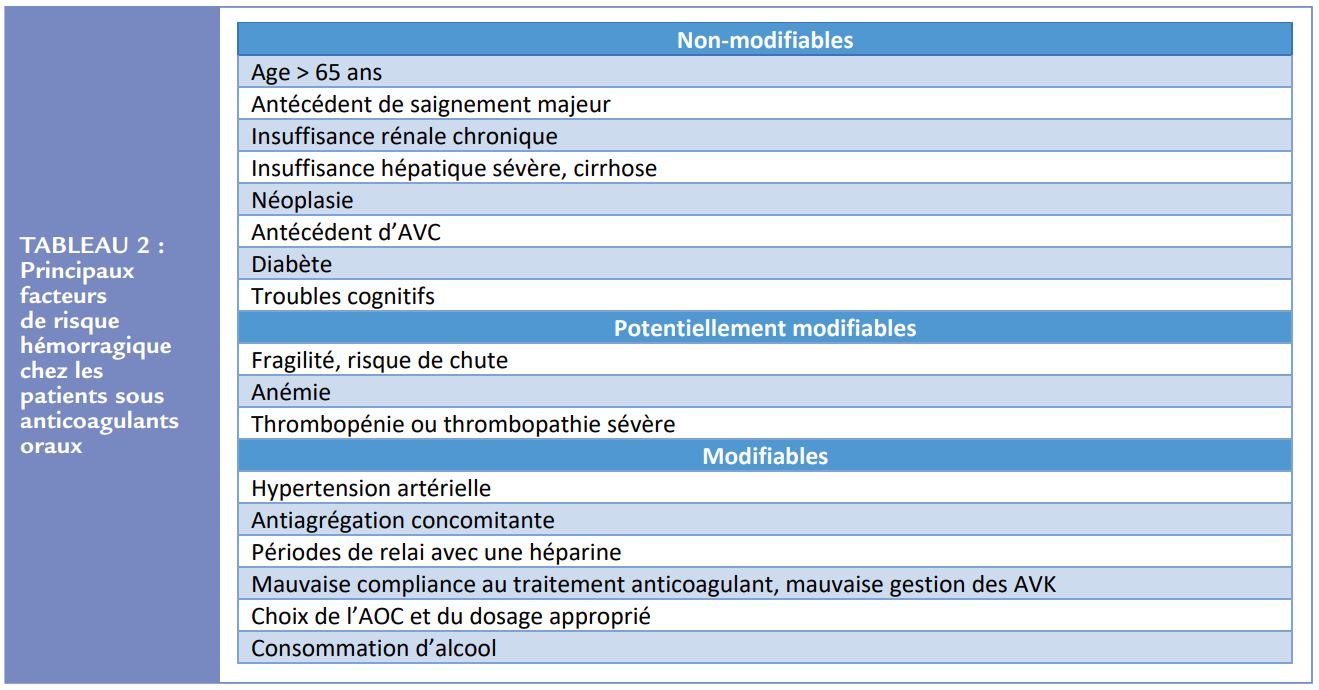
Lorsqu’une ACO est débutée, le risque hémorragique du patient doit également être évalué. Les principaux facteurs de risque hémorragique dans ce contexte sont repris dans le Tableau 2. Les contre-indications absolues à l’ACO incluent notamment les saignements majeurs actifs, les comorbidités associées (par exemple la thrombopénie < 50 G/L, l’anémie sévère en cours d’investigation …), ou un saignement intracrânien récent. La prévention d’embolies systémiques par des moyens non médicamenteux peut alors être considérée dans ce cas-là, comme par exemple par la fermeture de l’auricule gauche par voir percutanée (ou chirurgicale si une chirurgie cardiaque est prévue pour un autre motif).
Données des études guidant le choix du traitement antithrombotique
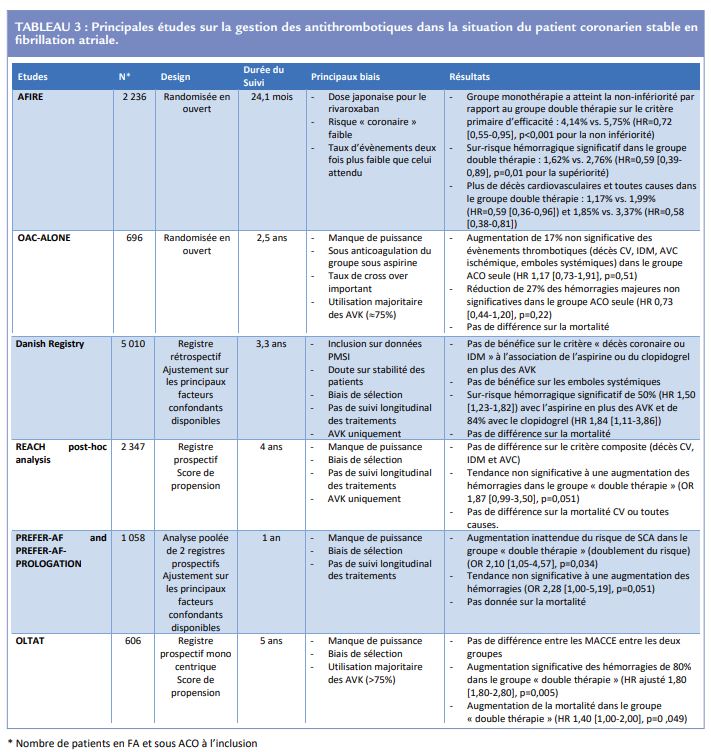
La littérature s’intéressant à la gestion des antithrombotiques chez les patients atteints de maladie coronaire chronique (ou stable) et de FA est surtout composée de données de registres, et de deux essais randomisés. Ces principales données sont résumées dans le Tableau 3.
Premièrement, plusieurs analyses ont été tirées du registre national Danois, s’intéressant respectivement aux coronariens stables en FA (n = 8 700), au premier événement ischémique coronaire chez les patients anticoagulés pour de la FA (n = 71 959), et les patients insuffisants cardiaques en FA avec une maladie vasculaire coexistante (la maladie coronaire dans la plupart des cas) (n = 37 464)13-15. Citons aussi les analyses rétrospectives sur les patients des registres OLTAT (n = 606), ORBIT-AF (n = 7 347) et REACH (n = 2 347)7,16,17. Globalement, on peut « copier coller » la conclusion de toutes ces études de registre : l’ajout d’un AAP à un ACO chez un patient coronarien chronique stable atteint de FA ne semble pas mieux prévenir le risque d’événement ischémique, tout en augmentant le risque hémorragique. Toutefois, ces études de registre comportent de nombreux biais communs, au-delà même de leur caractère rétrospectif. En effet, l’utilisation de l’AAP (ou non) n’était de fait pas contrôlée : la prescription était ainsi laissée à la discrétion des médecins qui ont pu créer un biais de sélection en ciblant les patients à haut risque et donc de ce fait limiter la possibilité de montrer un bénéfice potentiel de la double thérapie antithrombotique (mono AAP + ACO) sur les critères ischémiques de jugement. De plus, l’indication même de l’AAP n’était pas toujours recherchée dans ces travaux et beaucoup de patients avaient un AAP sans stent implanté (le niveau de risque coronaire des patients inclus dans ces registres était mal connu). Enfin, dans la plupart de ces études, le traitement antithrombotique n’était recueilli qu’à l’inclusion et les changements éventuels durant le suivi (particulièrement long dans ces études, plusieurs années) ou le traitement effectivement pris par le patient au moment des événements ischémiques ou hémorragiques n’étaient pas recensés. Plus récemment, il y a eu deux essais randomisés à notre disposition cherchant à explorer la thérapie antithrombotique optimale dans cette situation : OAC-ALONE et AFIRE18,19.
Le premier (OAC-ALONE) est un essai japonais randomisé multicentrique, en ouvert, testant la non-infériorité de l’ACO seul, contre l’ACO associé à un AAP. Le critère de jugement principal était les événements ischémiques, et le secondaire les événements hémorragiques. L’étude a été stoppée prématurément en raison de difficultés de recrutement de patients (n = 696 au lieu de 2 000 prévus), et ne peut donc pas conclure par manque de puissance statistique. En résumé, cet essai ne montrait aucune différence entre les deux groupes, ni sur les évènements thrombotiques, ni sur les évènements hémorragiques. On notait par ailleurs que seulement 1/4 de ces patients étaient traités avec un AOD, la plupart étant sous AVK et que le niveau d’anticoagulation était plus intense dans le groupe ACO seul en comparaison du groupe double thérapie en raison du caractère ouvert de l’essai (absence d’aveugle). Enfin, de nombreux cross-over (plus de 10%) ont été observés dans cet essai rendant encore plus complexe l’analyse des résultats. Malheureusement, aucune conclusion ne peut donc être tirée de cet essai.
L’étude plus récente AFIRE est un essai japonais randomisé multicentrique en ouvert lui aussi, testant la non-infériorité du rivaroxaban seul (10 ou 15 mg par jour – dose japonaise) contre le rivaroxaban et un AAP chez les coronariens chroniques (angioplastie ou pontage > 1 an) nécessitant une anticoagulation pour de la FA, avec de la même façon, un critère principal ischémique et un critère secondaire hémorragique. Au total, 2 236 patients ont été inclus. Le suivi (24,1 mois en moyenne) a été arrêté prématurément (3 mois avant la fin prévue) devant une mortalité trop importante dans le groupe rivaroxaban + AAP, avec un seuil de non-infériorité statistiquement atteint pour le rivaroxaban seul sur le critère primaire. Cette étude comporte plusieurs biais structurels. Tout d’abord bien entendu son design en ouvert, avec le risque de biais de mesure et d’effet placebo. Ensuite, la prescription de l’AAP dans le groupe concerné n’était pas contrôlée et constituait potentiellement un sur-risque hémorragique en fonction de l’AAP utilisé (aspirine 70% et clopidogrel 27%). Notons par ailleurs, sans que cela ne soit un biais attribuable à l’étude, que la population ciblée par les critères d’inclusion : angioplastie (avec stent ou non) > 1 an, ou pontage > 1 an, ou sténose significative d’un tronc épicardique même sans antécédent de revascularisation, fait coexister dans l’étude des patients avec des niveaux de risque de récurrence d’événement ischémique très différents. Ainsi, le risque « coronaire » était plutôt faible puisque seuls 35% des patients avaient un antécédent d’infarctus et 70% seulement avaient eu une angioplastie coronaire avec stent (30% sans stent). Pour terminer, l’arrêt précoce du suivi a possiblement conduit à une surestimation du bénéfice de l’ACO seul. D’un point de vue méthodologique, selon le calcul de puissance initial, le taux d’évènement attendu pour le critère primaire dans le groupe double thérapie était de 6,1% par an soit un taux observé qui aurait dû être aux alentours de 12% à la fin du suivi de l’étude et non pas seulement de 5,75% comme celui réellement observé. Avec un taux d’évènement aussi faible dans les deux groupes, il était très simple de montrer la non-infériorité sur le critère primaire. Il est en revanche difficile de savoir si ces résultats, y compris ceux observés sur un critère secondaire telle que la mortalité, sont réellement extrapolables à une pratique de vie réelle.
Pratiques et Recommandations
Les données de la littérature, bien que basées essentiellement sur des registres rétrospectifs et une seule étude randomisée « bien construite », concordent : le maintien d’un AAP en plus de l’ACO chez le coronarien chronique atteint de FA à plus d’un an d’un événement ischémique ne doit pas être la stratégie par défaut.
Toutefois, en pratique quotidienne, selon des registres récents, l’AAP est souvent encore prescrite en combinaison de l’ACO au-delà d’un an d’une revascularisation ou d’un SCA, probablement en raison des inquiétudes quant au risque de thrombose de stent à l’arrêt de l’AAP20,21.
Les recommandations européennes actuelles sont présentées dans les recommandations de 2019 sur le syndrome coronarien chronique22, et dans une conférence de consensus de 2018 s’intéressant plus précisément à la maladie coronaire coexistant avec une fibrillation atriale23.
Basées sur les seules données à notre disposition, elles suggèrent qu’une monothérapie par ACO seul est généralement recommandée comme stratégie par défaut 12 mois après une angioplastie coronaire et/ ou un SCA chez les patients en FA. Cependant, elles disent que dans certains cas spécifiques à haut risque ischémique, quand les circonstances anatomiques et/ou cliniques indiquent un haut risque athérothrombotique résiduel, l’association aspirine + ACO ou clopidogrel + ACO peut être considérée au long cours. En effet, ces patients à haut risque thrombotique coronaire étaient, comme déjà mentionné, sous représentés dans les études randomisées. Ces situations à haut risque peuvent en effet amener à faire pencher la balance en faveur du risque ischémique et donc du maintien de l’AAP (en plus de l’ACO). Les critères de haut risque thrombotique résiduel sont bien connus et repris en résumé dans le Tableau 1. Il n’existe cependant pas pour le moment de données de la littérature dédiée pour étayer cette attitude.
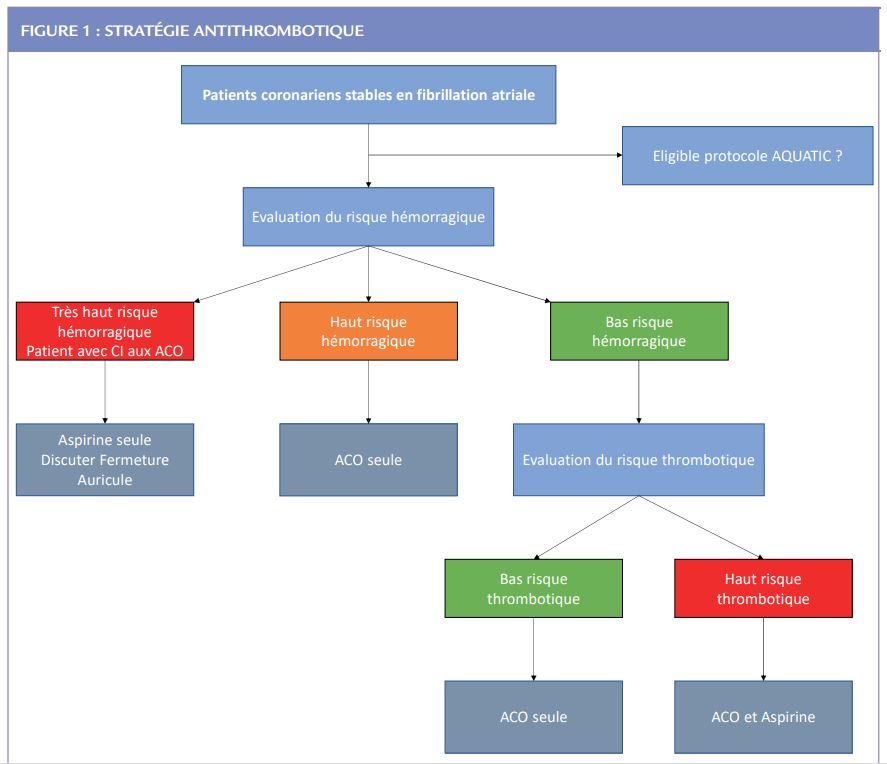
Enfin, il est précisé que lorsque le patient est éligible, on doit préférer un traitement par AOD (apixaban, dabigatran, edoxaban ou rivaroxaban) plutôt qu’un AVK. La Figure 1 résume la stratégie antithrombotique qui pourrait être adoptée à ce jour en l’absence de nouvelles données.
Conclusion Futur et Perspectives, l’essai AQUATIC
En conclusion, la nécessité de devoir adapter les traitements antithrombotiques chez les patients coronariens et anticoagulés au long cours est une situation fréquente.
A ce jour, les données de la littérature restent imparfaites pour guider le choix. La stratégie par défaut, chez les patients à haut risque hémorragique et/ou à faible risque athérothrombotique résiduel, est un ACO seul par AOD (vs. AVK) chaque fois que possible.
En revanche, chez le patient à haut risque athérothrombotique résiduel, il reste de nombreuses incertitudes aujourd’hui. Afin de répondre à cette question et de cibler ces patients à haut risque athérothrombotique résiduel qui pourraient bénéficier d’une bithérapie antithrombotique (ACO + mono AAP) au long cours, une étude randomisée multicentrique française est en cours (l’étude AQUATIC, NCT04217447) qui évalue l’arrêt contre la poursuite de l’aspirine (en double aveugle contre placebo) chez les patients coronariens chroniques à haut risque ischémique, et traités par ailleurs par un ACO au long cours.
L’auteur ne déclare pas de liens d’intérêts en relation avec cet article.
Thomas Denis, Guillaume Schurtz, Basile Verdier, Gilles Lemesle
RÉFÉRENCES
- Townsend N, Wilson L, Bhatnagar P, Wickramasinghe K, Rayner M, Nichols M. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J. 7 nov 2016;37(42):3232-45.
- Sundaram V, Bloom C, Zakeri R, Halcox J, Cohen A, Bowrin K, et al. Temporal trends in the incidence, treatment patterns, and outcomes of coronary artery disease and peripheral artery disease in the UK, 2006–2015. Eur Heart J. 1 mai 2020;41(17):1636-49.
- Daly CA, Clemens F, Sendon JLL, Tavazzi L, Boersma E, Danchin N, et al. The clinical characteristics and investigations planned in patients with stable angina presenting to cardiologists in Europe: from the Euro Heart Survey of Stable Angina. :15.
- Granger CB, Alexander JH, McMurray JJV, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med. 15 sept 2011;365(11):981-92.
- Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. N Engl J Med. 8 sept 2011;365(10):883-91.
- Krijthe BP, Kunst A, Benjamin EJ, Lip GYH, Franco OH, Hofman A, et al. Projections on the number of individuals with atrial fi brillation in the European Union, from 2000 to 2060. Eur Heart J. 1 sept 2013;34(35):2746-51.
- Lemesle G, Ducrocq G, Elbez Y, Van Belle E, Goto S, Cannon CP, et al. Vitamin K antagonists with or without long term antiplatelet therapy in outpatients with stable coronary artery disease and atrial fi brillation: Association with ischemic and bleeding events. Clin Cardiol. 10 juill 2017;40(10):932-9.
- Hamon M, Lemesle G, Tricot O, Meurice T, Deneve M, Dujardin X, et al. Incidence, Source, Determinants, and Prognostic Impact of Major Bleeding in Outpatients With Stable Coronary Artery Disease. J Am Coll Cardiol. oct 2014;64(14):1430-6.
- Sorbets E, Fox KM, Elbez Y, Danchin N, Dorian P, Ferrari R, et al. Long-term outcomes of chronic coronary syndrome worldwide: insights from the international CLARIFY registry. Eur Heart J. 14 janv 2020;41(3):347-56.
- Kirchhof P, Breithardt G, Camm AJ, Crijns HJ, Kuck K-H, Vardas P, et al. Improving outcomes in patients with atrial fi brillation: Rationale and design of the Early treatment of Atrial fi brillation for Stroke prevention Trial. Am Heart J. sept 2013;166(3):442-8.
- Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med. 17 sept 2009;361(12):1139-51.
- Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med. 28 nov 2013;369(22):2093-104.
- Lamberts M, Gislason GH, Lip GYH, Lassen JF, Olesen JB, Mikkelsen AP, et al. Antiplatelet Therapy for Stable Coronary Artery Disease in Atrial Fibrillation Patients Taking an Oral Anticoagulant: A Nationwide Cohort Study. Circulation. 15 avr 2014;129(15):1577-85.
- Lee CJ-Y, Pallisgaard JL, Olesen JB, Carlson N, Lamberts M, Gislason GH, et al. Antithrombotic Therapy and First Myocardial Infarction in Patients With Atrial Fibrillation. J Am Coll Cardiol. juin 2017;69(24):2901-9.
- Lamberts M, Lip GYH, Ruwald MH, Hansen ML, Özcan C, Kristensen SL, et al. Antithrombotic Treatment in Patients With Heart Failure and Associated Atrial Fibrillation and Vascular Disease. J Am Coll Cardiol. juin 2014;63(24):2689-98.
- Fischer Q, Georges JL, Le Feuvre C, Sharma A, Hammoudi N, Berman E, et al. Optimal long-term antithrombotic treatment of patients with stable coronary artery disease and atrial fi brillation: “OLTAT registry”. Int J Cardiol. août 2018;264:64-9.
- Steinberg BA, Kim S, Piccini JP, Fonarow GC, Lopes RD, Thomas L, et al. Use and Associated Risks of Concomitant Aspirin Therapy with Oral Anticoagulation in Patients with Atrial Fibrillation: Insights from the ORBIT-AF Registry. Circulation. 13 août 2013;128(7):721-8.
- Matsumura-Nakano Y, Shizuta S, Komasa A, Morimoto T, Masuda H, Shiomi H, et al. Open-Label Randomized Trial Comparing Oral Anticoagulation With and Without Single Antiplatelet Therapy in Patients With Atrial Fibrillation and Stable Coronary Artery Disease Beyond 1 Year After Coronary Stent Implantation: OAC-ALONE Study. Circulation. 29 janv 2019;139(5):604-16.
- Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M, et al. Antithrombotic Therapy for Atrial Fibrillation with Stable Coronary Disease. N Engl J Med. 19 sept 2019;381(12):1103-13.
- Ono F, Tanaka S, Nakao YM, Kawakami K. Utilization of Anticoagulant and Antiplatelet Agents Among Patients With Atrial Fibrillation Undergoing Percutaneous Coronary Intervention Retrospective Cohort Study Using a Nationwide Claims Database in Japan . Circ J. 2018;82(2):361-8.
- Ancedy Y, Lecoq C, Saint Etienne C, Ivanes F, Angoulvant D, Babuty D, et al. Antithrombotic management in patients with atrial fibrillation undergoing coronary stent implantation: What is the impact of guideline adherence? Int J Cardiol. janv 2016;203:987-94.
- Knuuti J. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Russ J Cardiol. 11 mars 2020;25(2):119-80.
- Lip GYH, Collet J-P, Haude M, Byrne R, Chung EH, Fauchier L, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). EP Eur. 1 févr 2019;21(2):192-3.
