
Point sur la thrombose veineuse cérébrale & actualités
La thrombose veineuse cérébrale (TVC) ou thrombophlébite cérébrale est une localisation atypique de la maladie thromboembolique veineuse (MTEV) liée à la formation d’un thrombus au sein du réseau veineux cérébral. Elle représente une cause rare d’accident vasculaire cérébral (AVC) (<1%) comparativement aux thromboses artérielles. Le diagnostic de TVC est difficile compte-tenu de la grande hétérogénéité des symptômes cliniques et du mode d’installation. Les progrès et l’accessibilité de la neuro-imagerie permettent actuellement un diagnostic plus précoce des TVC dont l’évolution est, dans la majorité des cas, favorable.
Rappel anatomique
Au sein du réseau veineux cérébral, on peut distinguer deux types de systèmes en fonction des caractéristiques anatomiques et fonctionnelles des vaisseaux sanguins : les sinus veineux duraux et les veines cérébrales. Les sinus duraux sont des canaux veineux intracrâniens formés entre le feuillet méningé et endostéal de la dure-mère et collectent le sang à partir des veines cérébrales. Ils drainent également le liquide cérébro-spinal (LCS) au niveau des espaces sous-arachnoïdiens grâce aux granulations arachnoïdiennes de Pacchioni situées en particulier au niveau du sinus sagittal supérieur (SSS). D’un point de vue topographique, on distingue le système veineux superficiel et profond dont le drainage s’effectue au niveau des veines jugulaires internes (Figure 1)1 .
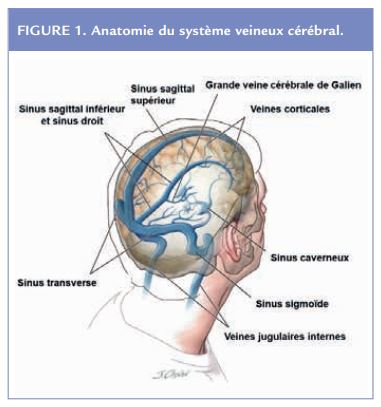
Le système veineux superficiel comprend les veines cérébrales corticales supérieures et inférieures. Les veines corticales supérieures se drainent dans le SSS puis dans le sinus transverse et sigmoïde (= sinus latéral). Les veines du groupe inférieur se drainent dans le sinus caverneux puis dans le sinus transverse.
Physiopathologie
Comme décrit dans la MTEV, la stase veineuse, l’hypercoagulabilité et les anomalies pariétales sont des facteurs favorisant la TVC liée à une rupture de l’équilibre entre les processus pro-thrombotique et fibrinolytique. Dans 40 à 60% des cas, l’occlusion des veines et/ou des sinus duraux conduit à des lésions du parenchyme cérébral 2,3. Les mécanismes physiopathologiques sous-jacents ne sont pas complètement élucidés. Ils semblent liés à des modifications hémodynamiques et des modifications du parenchyme cérébral secondaire à la thrombose 4 . Initialement compensée par une vasodilatation et le recrutement du réseau veineux collatéral, la thrombose conduit à une augmentation de la pression veinulaire/capillaire et à la formation d’un œdème vasogénique. Il peut en résulter une diminution de la perfusion cérébrale responsable d’infarctus veineux. Ces infarctus peuvent s’accompagner d’une composante hémorragique. La fréquente disparition des lésions suggère qu’il s’agit plus souvent d’un processus œdémateux et ischémique transitoire que d’un véritable infarctus. En cas de thrombose du SSS, une altération de la résorption du LCS par les granulations arachnoïdiennes conduit à un tableau d’hypertension intracrânienne.
Épidémiologie
La TVC est une localisation rare et atypique de thrombose veineuse par rapport aux formes classiques de MTEV (thrombose veineuse profonde et embolie pulmonaire). Chez l’adulte, son incidence est d’environ de 0,5-1,75 cas pour 100 000 habitants par an soit ≈100 fois inférieure à celle de la MTEV classique 5 . La TVC survient à tout âge et particulièrement chez l’adulte jeune et l’enfant. Dans l’étude internationale ISCVT, l’âge médian des patients était de 37 ans dont moins de 10% avait plus de 65 ans 3 . Chez l’adulte, plus de 70% des cas de TVC surviennent chez la femme jeune (sex ratio 3F : 1H)2,3,6,7. Cette différence s’explique par la présence de facteurs de risque spécifi ques liés au sexe tels que la prise de contraceptifs oraux (CO), la grossesse, le post-partum. Chez l’enfant, l’incidence est estimée entre 0,67-1,08 cas pour 100 000 habitants avec une prépondérance chez le nouveau-né 5 .
Causes et facteurs de risque de TVC
La TVC est une pathologie multifactorielle dont les causes favorisantes sont nombreuses. Cela inclut les facteurs de risque classiques décrits dans la MTEV auxquels s’ajoutent des causes locales et spécifiques de la TVC (infection, tumeurs cérébrales, traumatismes crâniens) (Tableau 1). Les étiologies les plus fréquemment associées à la TVC sont la prise de CO, les thrombophilies héréditaires, la grossesse/post-partum, les maladies systémiques et les causes locales. Cependant, l’étiologie reste indéterminée chez 20-30% des patients malgré un bilan exhaustif à la recherche de facteurs pro-thrombotiques 2,3,7,8.
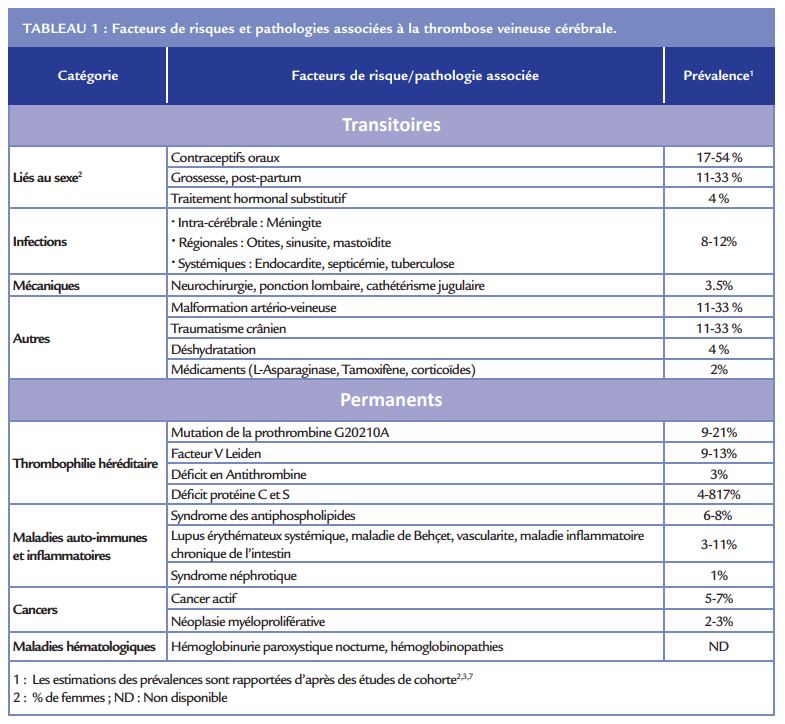
Causes locales
Les infections régionales comme les otites, sinusites constituent des circonstances reconnues de TVC liée à une infl ammation et une activation locale de la coagulation. Cependant, la fréquence des TVC d’origine septique a significativement diminué depuis l’introduction des antibiotiques. Dans les séries récentes, elles représentent ≈10% des cas de TVC2,3,7.
Causes générales liées au sexe
Comme décrit dans la MTEV, la prise de CO est associée à une augmentation du risque de TVC avec un odds ratio de 5,599 . Il s’agit du 1er facteur de risque lié au sexe identifi é chez 34 à 54% des femmes avec une TVC dans les pays industrialisés3,7,9. La grossesse et le post-partum représentent le 2ème facteur de risque lié au sexe rapporté dans 11 à 59% des cas10. L’incidence des TVC durant la grossesse et le post-partum est estimé à 1 cas pour 2 500 accouchements6 . La majorité des évènements surviennent en post-partum (>70%) avec une augmentation majeure du risque dans les 6 semaines suivant l’accouchement (odds ratio de 18,7)2,3,6,11,12.
Causes générales non liées au sexe
La thrombophilie héréditaire constitue le 1er facteur de risque de TVC non lié au sexe (≈30-40%)10. Les mutations du facteur II (G20210A) et du facteur V Leiden, les plus fréquentes, sont associées à un augmentation du risque de TVC (odds ratio de 6,05 et 2,89 respectivement)13. Les déficits héréditaires en inhibiteurs de la coagulation (incluant l’antithrombine, les protéines C et S) sont plus rarement identifiés et constituent également des facteurs de risque de TVC (odds ratio de 3,75, 6,45, 8,35 respectivement). Actuellement, la réalisation d’un bilan de thrombophilie n’est recommandée que chez les patients avec une histoire personnelle ou familiale de thrombose et chez les patients sans facteur de risque identifiés 14. En effet, peu d’études ont évalué l’impact de ces anomalies sur le taux de récidive, le pronostic neurologique et la mortalité. Cependant, la recherche de thrombophilie héréditaire reste intéressante car le risque thrombotique augmente d’autant plus qu’elle est associée à d’autre facteur de risque comme la prise de CO9,15. En dehors des facteurs de risque de thrombose veineuse, de nombreuses pathologies ont été associées aux TVC incluant les cancers et les malades inflammatoires.
Clinique
La symptomatologie associée à la TVC est très variée (Tableau 2). Parmi les symptômes le plus souvent rencontrés, figurent les céphalées, décrites dans près de 90% des cas 3 . L’installation des céphalées est liée à l’augmentation de la pression intracrânienne. Les céphalées sont souvent décrites comme diffuses et progressives, survenant sur plusieurs jours. Quelques cas de céphalées en coup de tonnerre ont également été décrits 16. Finalement, toute céphalée inhabituelle et persistante chez un patient aux antécédents ou non de céphalée primaire, doit faire suspecter une TVC.
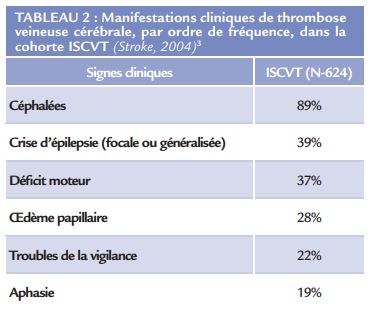
De façon associée aux céphalées, en rapport avec le syndrome d’hypertension intracrânienne, les patients peuvent développer un œdème papillaire, se manifestant parfois par une baisse de l’acuité visuelle ou des éclipses visuelles. La TVC peut également se manifester fréquemment par des crises d’épilepsie, focales ou généralisées (environ 40% des cas). Les autres manifestations cliniques dépendent de la localisation des complications parenchymateuses de la TVC (infarctus veineux ou hémorragie) : déficit moteur, aphasie parfois troubles sensitifs.
Enfin, certains tableaux caractéristiques doivent faire évoquer une TVC. C’est le cas de l’atteinte du système veineux cérébral profond qui peut se manifester par un coma, précédé de troubles psychiatriques, associé à un déficit moteur bilatéral, par atteinte des 2 thalami. La thrombose du sinus caverneux est également assez typique, associant ophtalmoplégie douloureuse et chémosis.
Diagnostic
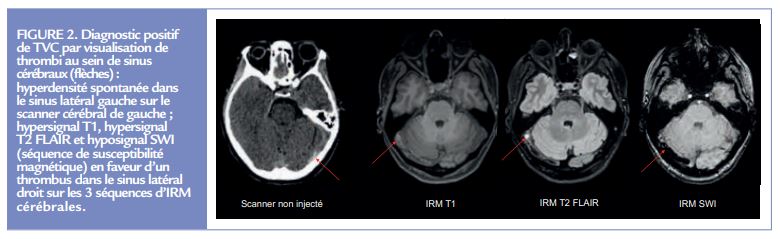
Le diagnostic repose majoritairement sur l’imagerie cérébrale. L’imagerie permet en effet la visualisation du thrombus au sein du système veineux cérébral. Le thrombus peut être détecté grâce à plusieurs modalités d’imagerie. Parmi les principales méthodes non invasives utilisées, on peut citer le scanner et l’IRM. Au scanner, le thrombus apparaît comme une hyperdensité spontanée (visible dans 30% des cas 17) au sein d’une veine corticale ou d’un sinus veineux. En IRM, le thrombus apparaît différemment en fonction du type de séquences, et également du délai de réalisation de l’imagerie (Figure 2).
Parfois, le thrombus n’est pas détecté par l’imagerie, notamment du fait du retard diagnostique. Dans ces cas-là, le diagnostic est évoqué grâce à des séquences d’imagerie injectées (angioscanner avec temps tardif et/ ou angioRM veineuse) qui mettent en évidence un défect d’opacification des sinus veineux (Figure 3).
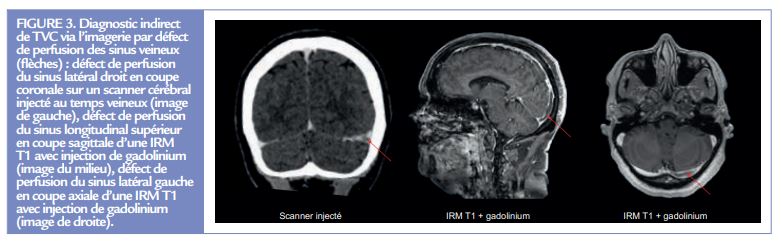
Si le thrombus est situé au niveau du SSS dans sa portion postérieure, le défaut d’opacification apparaît en coupe axiale comme un delta (signe du delta). L’imagerie permet également de déterminer les complications parenchymateuses pouvant être associées à la TVC comme l’infarctus veineux et les hémorragies cérébrales intra-parenchymateuses (Figure 4). Le dosage des D-dimères apporte également parfois une aide au diagnostic. Un dosage normal des D-dimères étant associé à une faible probabilité de TVC18.

Traitement
Le traitement principal de la TVC est basé sur l’anticoagulation. Il permet en effet de prévenir l’extension du thrombus, faciliter la recanalisation du ou des sinus veineux thrombosés, et prévenir également le développement d’autres pathologies thromboemboliques comme l’embolie pulmonaire. Bien qu’utilisé en pratique courante, le bénéfice de l’anticoagulation n’a pas été clairement démontré dans la TVC. Le premier essai randomisé contre placebo a été arrêté précocement après l’inclusion de 20 patients devant la mise en évidence d’un bénéfice (2/10 patients avec un déficit mineur dans le groupe anticoagulation versus 3/10 décès dans le groupe placebo)19. Concernant le deuxième essai randomisé, aucune différence statistique significative n’a été mise en évidence pour le critère de jugement principal évaluant à 3 mois le handicap et la survenue d’un décès (4/30 avec un handicap et/ou décès dans le groupe anticoagulation versus 6/29 dans le groupe placebo)20. De même, la méta-analyse regroupant les deux essais n’a pas mis en évidence de différence statistique significative sur la mortalité et le handicap 21. Néanmoins, l’anticoagulation tend à montrer un bénéfice en termes de pronostic, avec une réduction du risque de décès ou de handicap de 14%21. Le traitement anticoagulant reste donc primordial et est à débuter précocement, quelles que soient les complications associées à la TVC, notamment l’hémorragie cérébrale.
En général, l’anticoagulation par héparine de bas poids moléculaire (HBPM) est utilisée initialement (préférentiellement à l’héparine non fractionnée, HNF22), puis relayée par des Antivitamines K. Récemment, une étude a comparé l’administration de dabigatran (anti-IIa) versus Coumadine chez des patients présentant une TVC non grave et a montré une efficacité comparable en termes de récurrence d’évènements thrombotiques (0 évènement sur un suivi de 6 mois) et un risque de saignements similaires entre les deux groupes 23. L’utilisation de cet anticoagulant oral direct peut donc s’envisager chez certains patients présentant une TVC non grave et en l’absence de contre-indication. Concernant la durée de l’anticoagulation, elle n’est pas déterminée de façon certaine, mais les recommandations américaines et européennes préconisent une durée de traitement entre 3 et 12 mois 14,24. Un essai est également en cours pour déterminer la durée la plus adaptée entre un traitement court (3-6 mois) et un traitement long (12 mois)25. Pour les patients ayant présenté une récidive de TVC, ou présentant un risque thrombotique élevé (thrombophilie héréditaire type déficit en protéine C, S, antithrombine III, thrombophilie acquise type SAPL), il est recommandé de poursuivre une anticoagulation au long cours, en référence aux pratiques établies dans la maladie thromboembolique veineuse. Enfin, il est primordial de débuter rapidement le ou les traitement(s) en rapport avec l’étiologie responsable de la TVC, notamment le traitement antibiotique dans le cadre d’une infection locale associée, ou les traitements immunosuppresseurs dans le cadre d’une infection autoimmune (cf Causes et facteurs de risque).
Pronostic
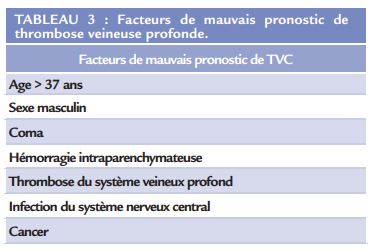
Le pronostic des TVC dépend de la précocité de la prise en charge thérapeutique, mais reste dans l’ensemble plutôt favorable. Environ 80% des patients ont une guérison complète à 6 mois 1 , 90% à 3 ans 7 . La mortalité associée aux TVC est par ailleurs faible, évaluée entre 5 et 10%. Elle est due soit à une conséquence directe de la TVC (œdème vasogénique diffus, engagement temporal) soit associée à une pathologie sous-jacente (néoplasie). Néanmoins, certains patients développent des séquelles neuropsychologiques (dans 10 à 15% des cas), entraînant un handicap certain. Parmi les facteurs de mauvais pronostic, les complications parenchymateuses associées à la TVC sont souvent décrites (Tableau 3).
Concernant le risque de récurrence d’un évènement thrombotique veineux, il reste faible (évalué entre 4,4 et 6,5%7 ). Le seul facteur de risque par ailleurs de développer un évènement thrombotique chez les patients ayant présenté une TVC est l’évènement thrombotique initial.
TVC et COVID-19
Récemment, une augmentation des événements thrombotiques veineux et artériels a été observée au cours de l’infection par le coronavirus SARS-CoV-2 induisant la COVID-1926. Les mécanismes physiopathologiques sous-jacents incluent un état d’hypercoagulabilité, une dysfonction endothéliale et un syndrome inflammatoire. Une étude prospective internationale a montré que la TVC représentait 4,2% des événements cérébrovasculaires chez 432 patients hospitalisés avec la COVID-1927. L’incidence de la TVC au cours du COVID-19 a été estimée à 3,9 pour 100 000 cas 28. Elle survient majoritairement dans les 15 jours suivant le diagnostic de COVID-19 sans autre facteur de risque identifié dans 70% des cas 27–29.
TVC et vaccination contre le SARS-CoV-2
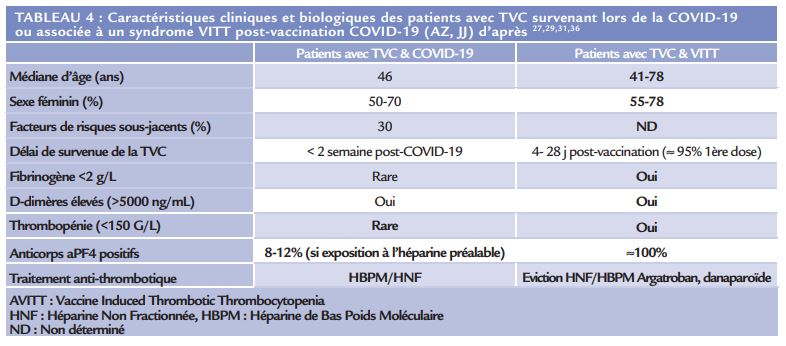
Plusieurs études ont rapporté dernièrement la survenue d’événements thrombotiques associés à des thrombopénies liées aux vaccins à adénovirus ChAdOx1-S (Vaxzevria®, AstraZeneca, AZ) et Ad26.COV2.S-recombinant (Johnson & Johnson, J&J) développé contre le SARS-CoV-230. Ce syndrome est désigné sous le terme « VITT » (Vaccine Induced Immune Thrombotic Thrombocytopenia) ou « VIPIT » (Vaccine Induce Prothrombotic Immune Thrombocytopenia). L’incidence des VITT est estimée entre 0,3-1 cas pour 100 000 doses de vaccin31. Les VITT partagent des similitudes physiopathologiques avec la thrombopénie induite à l’héparine auto-immune (TIHa) caractérisée par : une thrombopénie, des complications thrombotiques et par la présence d’anticorps anti-facteur 4 plaquettaire (anti-PF4) sans exposition préalable à l’héparine. La TVC est la localisation principale des VITT (38-80% des cas) et présente des caractéristiques différentes de celles liées à la COVID-19 (Tableau 4)31. En effet, une coagulopathie de consommation est retrouvée dans > 70% des cas avec une recherche d’anticorps anti-PF4 positive (Tableau 4)32. Dans l’état actuel des connaissances, l’éviction des traitements anticoagulants de type HNF/HBPM et des transfusions plaquettaires au cours des TVC avec VITT est préconisée33–35. Les traitements anti-thrombotiques disponibles sont ceux décrits dans la TIH (argatroban, fondaparinux…).
Agnès Aghetti, Marie-Charlotte Bourrienne, Mikael Mazighi, Paris
RÉFÉRENCES
- Silvis, S. M., de Sousa, D. A., Ferro, J. M. & Coutinho, J. M. Cerebral venous thrombosis. Nat Rev Neurol 13, 555–565 (2017).
- Duman, T. et al. A Multicenter Study of 1144 Patients with Cerebral Venous Thrombosis: The VENOST Study. Journal of Stroke and Cerebrovascular Diseases 26, 1848–1857 (2017).
- Ferro, J. M., Canhão, P., Stam, J., Bousser, M.-G. & Barinagarrementeria, F. Prognosis of Cerebral Vein and Dural Sinus Thrombosis: Results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT). Stroke 35, 664–670 (2004).
- Stam, J. Thrombosis of the cerebral veins and sinuses. N Engl J Med 352, 1791–1798 (2005).
- Kristoffersen Espen Saxhaug et al. Incidence and Mortality of Cerebral Venous Thrombosis in a Norwegian Population. Stroke 51, 3023–3029 (2020).
- Bushnell, C. et al. Guidelines for the Prevention of Stroke in Women. Stroke 45, 1545–1588 (2014).
- Dentali, F. et al. Long-term outcomes of patients with cerebral vein thrombosis: a multicenter study. Journal of Thrombosis and Haemostasis 10, 1297–1302 (2012).
- Wasay, M. et al. Asian Study of Cerebral Venous Thrombosis. Journal of Stroke and Cerebrovascular Diseases 28, 104247 (2019).
- Dentali, F., Crowther, M. & Ageno, W. Thrombophilic abnormalities, oral contraceptives, and risk of cerebral vein thrombosis: a meta-analysis. Blood 107, 2766–2773 (2006).
- Silvis, S. M., Middeldorp, S., Zuurbier, S. M., Cannegieter, S. C. & Coutinho, J. M. Risk Factors for Cerebral Venous Thrombosis. Semin Thromb Hemost 42, 622–631 (2016).
- Palazzo, P. et al. Venous Thrombotic Recurrence After Cerebral Venous Thrombosis: A Long-Term Follow-Up Study. Stroke 48, 321–326 (2017).
- Silvis, S. M. et al. Postpartum Period Is a Risk Factor for Cerebral Venous Thrombosis. Stroke (2019) doi:10.1161/STROKEAHA.118.023017.
- Lauw, M., Barco, S., Coutinho, J. & Middeldorp, S. Cerebral Venous Thrombosis and Thrombophilia: A Systematic Review and Meta-Analysis. Semin Thromb Hemost 39, 913–927 (2013).
- Ferro, J. M. et al. European Stroke Organization guideline for the diagnosis and treatment of cerebral venous thrombosis – endorsed by the European Academy of Neurology. Eur. J. Neurol. 24, 1203–1213 (2017).
- Martinelli, I., Battaglioli, T., Pedotti, P., Cattaneo, M. & Mannucci, P. M. Hyperhomocysteinemia in cerebral vein thrombosis. Blood 102, 1363–1366 (2003).
- Cumurciuc, R., Crassard, I., Sarov, M., Valade, D. & Bousser, M. G. Headache as the only neurological sign of cerebral venous thrombosis: a series of 17 cases. J Neurol Neurosurg Psychiatry 76, 1084–1087 (2005).
- Bousser, M.-G. & Ferro, J. M. Cerebral venous thrombosis: an update. Lancet Neurol 6, 162–170 (2007).
- Kosinski, C. M. et al. Do normal D-dimer levels reliably exclude cerebral sinus thrombosis? Stroke 35, 2820–2825 (2004).
- Einhäupl, K. M. et al. Heparin treatment in sinus venous thrombosis. Lancet 338, 597–600 (1991).
- de Bruijn, S. F. & Stam, J. Randomized, placebo-controlled trial of anticoagulant treatment with low-molecular-weight heparin for cerebral sinus thrombosis. Stroke 30, 484–488 (1999).
- Stam, J., De Bruijn, S. F. & DeVeber, G. Anticoagulation for cerebral sinus thrombosis. Cochrane Database Syst Rev CD002005 (2002) doi:10.1002/14651858.CD002005.
- Misra, U. K., Kalita, J., Chandra, S., Kumar, B. & Bansal, V. Low molecular weight heparin versus unfractionated heparin in cerebral venous sinus thrombosis: a randomized controlled trial. Eur J Neurol 19, 1030–1036 (2012).
- Ferro, J. M. et al. Safety and Efficacy of Dabigatran Etexilate vs Dose-Adjusted Warfarin in Patients With Cerebral Venous Thrombosis: A Randomized Clinical Trial. JAMA Neurology (2019) doi:10.1001/jamaneurol.2019.2764.
- Saposnik, G. et al. Diagnosis and management of cerebral venous thrombosis: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 42, 1158–1192 (2011).
25 Miranda, B. et al. The benefit of EXtending oral antiCOAgulation treatment (EXCOA) after acute cerebral vein thrombosis (CVT): EXCOA-CVT cluster randomized trial protocol. Int J Stroke 13, 771–774 (2018).
- Piazza, G. et al. Registry of Arterial and Venous Thromboembolic Complications in Patients With COVID-19. J Am Coll Cardiol 76, 2060–2072 (2020).
- Shahjouei, S. et al. SARS-CoV-2 and Stroke Characteristics. Stroke 52, e117–e130 (2021).
- Taquet, M., Husain, M., Geddes, J. R., Luciano, S. & Harrison, P. J. Cerebral venous thrombosis and portal vein thrombosis: a retrospective cohort study of 537,913 COVID-19 cases. medRxiv 2021.04.27.21256153 (2021) doi:10.1101/2021 .04.27.21256153.
- Baldini, T. et al. Cerebral venous thrombosis and severe acute respiratory syndrome coronavirus-2 infection: A systematic review and meta-analysis. European Journal of Neurology n/a,.
- Greinacher, A. et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med 384, 2092–2101 (2021).
- Arepally, G. M. & Ortel, T. L. Vaccine-Induced Immune Thrombotic Thrombocytopenia (VITT): What We Know and Don’t Know. Blood (2021) doi:10.1182/blood.2021012152.
- US Case Reports of Cerebral Venous Sinus Thrombosis With Thrombocytopenia After Ad26.COV2.S Vaccination, March 2 to April 21, 2021 | Coagulation Disorders | JAMA | JAMA Network. https://jamanetwork.com/journals/jama/ fullarticle/2779731.
- Nazy, I. et al. Recommendations for the clinical and laboratory diagnosis of VITT against COVID-19: Communication from the ISTH SSC Subcommittee on Platelet Immunology. Journal of Thrombosis and Haemostasis 19, 1585–1588 (2021).
- On Behalf of the American Heart Association/American Stroke Association Stroke Council Leadership. Diagnosis and Management of Cerebral Venous Sinus Thrombosis with Vaccine-Induced Thrombotic Thrombocytopenia. Stroke STROKEAHA.121.035564 (2021) doi:10.1161/STROKEAHA.121.035564.
- Prise en charge SARS-CoV-2 Vaccine Induced Thrombotic Thrombocytopenia, sous l’égide des SFNV, SFMV, GFHT, GIHP, SFAR, ANARLF, SFNR. Avril 2021. Disponible sur : https://site.geht.or/docutheque/.
- See, I. et al. US Case Reports of Cerebral Venous Sinus Thrombosis With Thrombocytopenia After Ad26.COV2.S Vaccination, March 2 to April 21, 2021. JAMA 325, 2448–2456 (2021).
Cordiam N°41 – AOÛT – SEPTEMBRE 2021
